叔丁基苯咔唑衍生物发光材料的合成与性能研究*
池振国,黎小芳,周 林,李海银,许炳佳,周 炜,张 艺,许家瑞
(中山大学化学与化学工程学院∥聚合物复合材料及功能材料教育部重点实验室∥广东省教育厅高分子化学与物理重点实验室∥光电材料与技术国家重点实验室,广东 广州 510275)
有机发光材料是有机电致发光二极管(OLED)器件的重要组成部分[1-4],它的性能直接影响到器件的性能,如发光效率和使用寿命等,是OLED器件能否真正大规模产业化的关键因素之一。OLED器件的使用寿命与发光材料的热稳定性特别是玻璃化转变温度(Tg)密切相关。低Tg的有机发光材料在OLED器件的使用过程容易发生聚集态结构的改变,导致器件性能的老化,缩短器件的使用寿命。因此,研究开发高稳定性和高发光效率的有机发光材料,具有重要的理论意义和应用价值。
近年来,许多咔唑衍生物受到了人们高度重视。因为咔唑衍生物往往具有优异的载流子传输性能、发光性能和高的热稳定性[5-9],有望成为一类性能优异的发光材料和载流子传输材料。为了进一步提高咔唑衍生物的Tg,本论文把具有较大空间位阻的叔丁基苯引入到咔唑结构的3-和6-位,合成叔丁基苯咔唑苯甲醛,再与相应的膦酸酯叶立德试剂进行Wittig-Horner反应合成具有H型结构的叔丁基苯咔唑衍生物(合成路线如图1所示),并对它们的热性能和光物理性能进行了初步的表征。
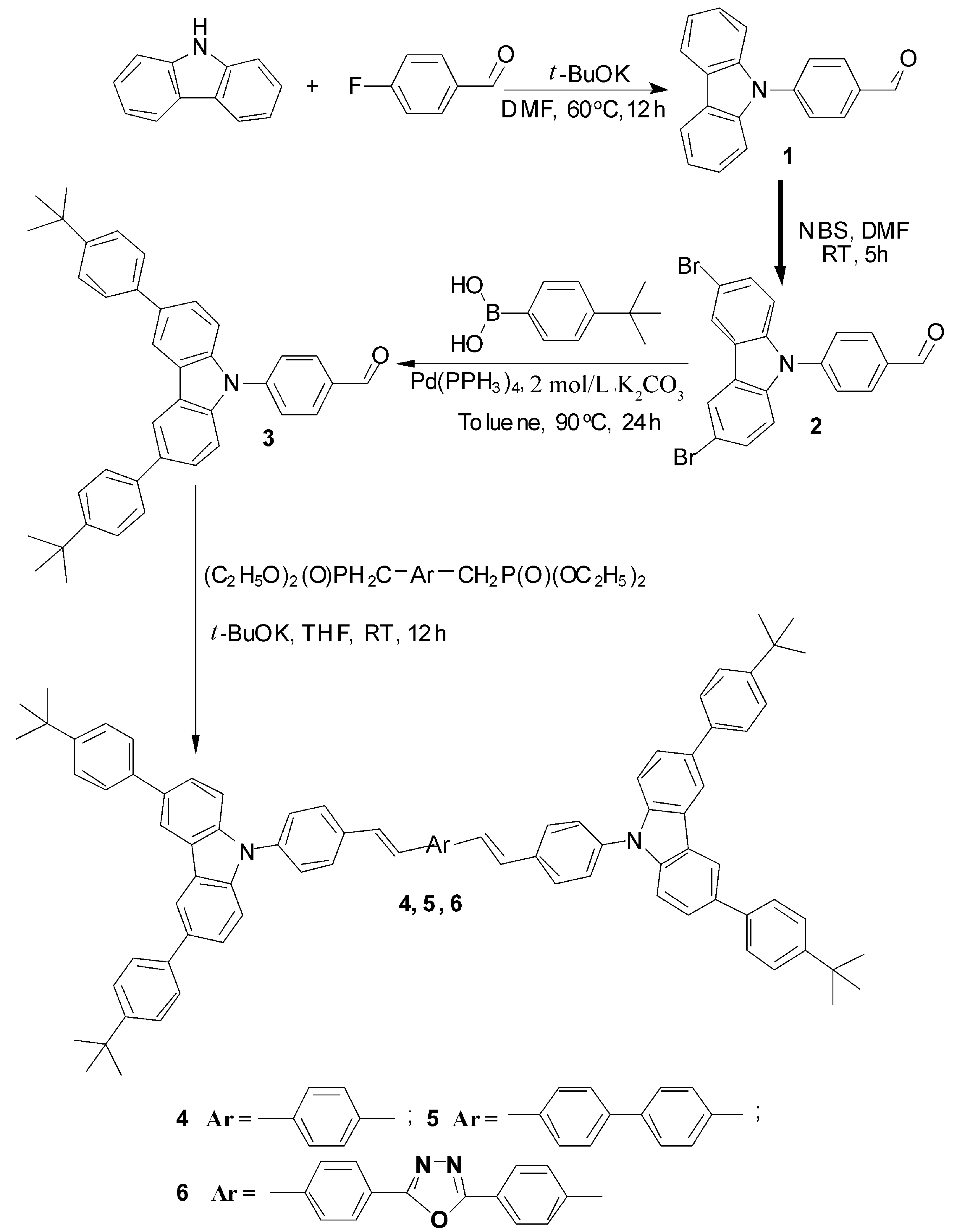
图1 叔丁基苯咔唑衍生物的合成路线
1 实验部分
1.1 试剂与表征
咔唑、4-氟苯甲醛、叔丁醇钾、N-溴代丁二酰亚胺(NBS)、四(三苯基膦)钯、4-叔丁基苯硼酸、1,4-二(溴甲基)苯和4-甲基苯甲酸购自Alfa Aesar公司。亚磷酸三乙酯 (Fluka),纯度≥95%;4,4'-二(氯甲基)联苯(江苏省宝应县中宝云鹏化工有限公司), 纯度≥98%。三氯氧磷(天津市福晨化学试剂厂),分析纯;其它分析纯试剂和溶剂购自广州化学试剂厂。除特别说明纯化外,购得的试剂均直接使用,没有作进一步纯化处理。溶剂N,N-二甲基甲酰胺(DMF)使用前经过分子筛干燥并减压重蒸;四氢呋喃(THF)在金属钠存在下干燥蒸馏。对咔唑基苯甲醛(1)按文献[5]的方法合成; 3,6-二溴代对咔唑基苯甲醛(2)按文献[10]的方法制备;3个膦酸酯叶立德试剂分别按文献[11-13]的方法制备。
核磁共振氢谱(1H NMR)在 Mercury-plus 300核磁共振波谱仪(美国 Varian)上测定,以氘代氯仿(CDCl3)做溶剂;红外光谱(FT-IR)在Nexus 670红外光谱分析仪(美国Nicolet公司)上测定,KBr压片;高分辨质谱(HR-MS)在MAT95XP-HRMS 质谱仪上测定(Thermo spectrometers), 快原子轰击源(FAB);元素分析(EA)在Vario EL元素分析仪 (德国 Elementar 公司)上进行;利用UV-3150紫外可见分光光度计(日本岛津)测定产物的紫外可见吸收谱(UV),样品溶于二氯甲烷中,配成适当浓度,以纯溶剂二氯甲烷作参比;荧光发射光谱(PL)在Cary Eclipse荧光分光光度计(澳洲Varian公司)上进行,试样溶于二氯甲烷中,配成适当浓度,用UV谱上获得的最大吸收波长进行激发。以9,10-二苯基蒽为标准,测定荧光量子产率(ΦFL)[14]。热重分析(TGA)在TGA Q50热重分析仪(美国TA公司)进行,升温速率为20 ℃/min,氮气气氛;示差扫描量热法(DSC)的测定在Q10示差扫描量热仪(美国TA公司)上进行,升温和降温速率为10 ℃/min,测试温度范围为50~400 ℃,氮气气氛;利用循环伏安法(CV)测定分子的HOMO能级,CHI660C电化学工作站(上海辰华仪器公司),二茂铁为标准。
1.2 3,6-二对叔丁基苯对咔唑苯甲醛(3)的合成
在三颈瓶中加入3,6-二溴代对咔唑苯甲醛2 g (4.7 mmol),对叔丁基苯硼酸1.92 g (10.8 mmol),2 mol/L的K2CO3水溶液60 mL,甲苯90 mL,相转移剂Aliquat 336 0.1 g。搅拌下通氩气30 min后,加入四(三苯基膦)钯0.01 g。加热至90 ℃在氩气保护下搅拌反应24 h。停止反应,分液取上层甲苯层,加入少量无水硫酸钠干燥后过滤,减压下旋蒸除去甲苯。粗产物利用硅胶柱层析方法进行提纯,V(二氯甲烷)∶V(正己烷)=2∶1的混合溶剂作淋洗剂。得到黄色粉末1.75 g,产率71.1%。
1H NMR(300 MHz,CDCl3)δ:1.41(s,18H),7.39~7.77(m,12H),7.79~7.91(d,2H),8.09~8.23(d,2H),8.32~8.42(s,2H),10.13(s,1H);m/z: 535(M+);EA测定值(计算值) C39H37NO (w/%):C 87.21 (87.44), H 6.92 (6.96), N 2.65(2.61)。
1.3 利用Wittig-Horner反应合成终产物
在三颈瓶中加入中间体醛(3) 0.7g (1.3 mmol)和相应的膦酸酯叶立德试剂0.6 mmol。加入20 mL干燥THF搅拌使其完全溶解后,一次性加入叔丁醇钾0.17 g (1.5 mmol),在氩气保护下室温(RT)搅拌反应12 h。将反应混合物倒入约100 mL无水乙醇中进行沉淀。抽滤,无水乙醇淋洗3次,真空干燥得目标产物:1,4-[4-(3,6-二叔丁基苯咔唑基)苯乙烯基]苯(4);4,4’-[4-(3,6-二叔丁基苯咔唑基)苯乙烯基]联苯(5); 2,5-二{4-[4-(3,6-二叔丁基苯咔唑基)苯乙烯基]苯基}-1,3,4-噁二唑(6)。
产物(4)为黄色粉末,产率70.5%。1H NMR (300 MHz,CDCl3)δ:1.42(s,36H),7.42~7.55(m,12H),7.55~7.74(m,24H),7.75~7.83(d,4H),8.38(d,4H);IR(KBr)ν/cm-1: 3 025,2 959,1 602,1 507,1 477,1 367,1 267,1 226,810;m/z: 1142(M+);EA测定值(计算值) C86H80N2(w/ %):C 90.26 (90.48), H 7.02 (7.06), N 2.41(2.45)。
产物(5)为黄色粉,产率70.6%。1H NMR (300 MHz,CDCl3)δ:1.42(s,36H),7.27~7.32(d,4H),7.46~7.58(m,12H),7.59~7.75(m,24H),7.75~7.85(d,4H),8.39(d,4H);IR(KBr)ν/cm-1: 3 029,2 960,1 607,1 507,1 472,1 361,1 266,1 230,806;m/z: 1218(M+);EA测定值(计算值) C92H84N2(w/%):C 90.71 (90.75), H 6.89 (6.95), N 2.33(2.30)。
产物(6)为黄色粉末,产率93.8%。1H NMR (300 MHz,CDCl3)δ:1.42(s,36H),7.48~7.56(m,12H),7.62~7.79(m,24H),7.78~7.84(m,8H),8.39(d,4H);IR(KBr)ν/cm-1: 3 029,2 954,1 602,1 512,1 477,1 356,1 266,1 226,805;m/z: 1286(M+);EA测定值(计算值) C94H84N4O (w/%):C 87.78 (87.81), H 6.52 (6.59), N 2.31(4.36)。
2 结果与讨论
该系列的3个化合物的结构如图1所示。从它们的结构式可以看到,该系列化合物的结构特点是咔唑的3-和6-位连接了叔丁基苯形成叔丁基苯基咔唑这样的结构。两个叔丁基苯基咔唑通过9-位由不同的芳环桥连接起来,成为一个H型的对称结构。这样的分子结构设计是为了利用咔唑基的刚性结构来提高化合物的热稳定性;同时,引入叔丁基则是为了提高所合成化合物的溶解性,便于溶液加工。这3个化合物的区别在于中间连接桥基团Ar的不同。
2.1 紫外吸收和荧光发射光谱
图2是化合物4、5和6的紫外吸收光谱(UV)。从图中可以看到,4、5和6在二氯甲烷溶液中UV吸收光谱分别在300和380 nm附近有两个明显的吸收带。紫外最大吸收波长分别为386,376和380 nm。从化合物4和5的分子结构看,前者Ar基团是单个苯环,后者是联苯。从表面上看,似乎是后者的共轭结构更长。理论上讲,共轭结构越长,紫外吸收波长越长。但是比较它们的UV吸收谱可以看到,化合物4的最大吸收波长比5长约10 nm,实验结果似乎与理论不相符。

图2 化合物4、5和6的紫外吸收光谱图
因此,利用ChemOffice的MM2对这3个化合物进行能量最小化处理,得到它们的最稳定构象(图3)。从图中可以看到,化合物5的联苯桥的两个苯环相互偏转一定的角度呈扭曲状态,两苯环之间的二面角是37.9°。由此可见,在这里,联苯并不能有效地增加共轭结构的长度,这种扭曲结构反而使整个分子的共轭程度不如单苯连接的化合物4,这就很好地解释了上述测得的化合物4的最大吸收波长要比5长的实验结果。
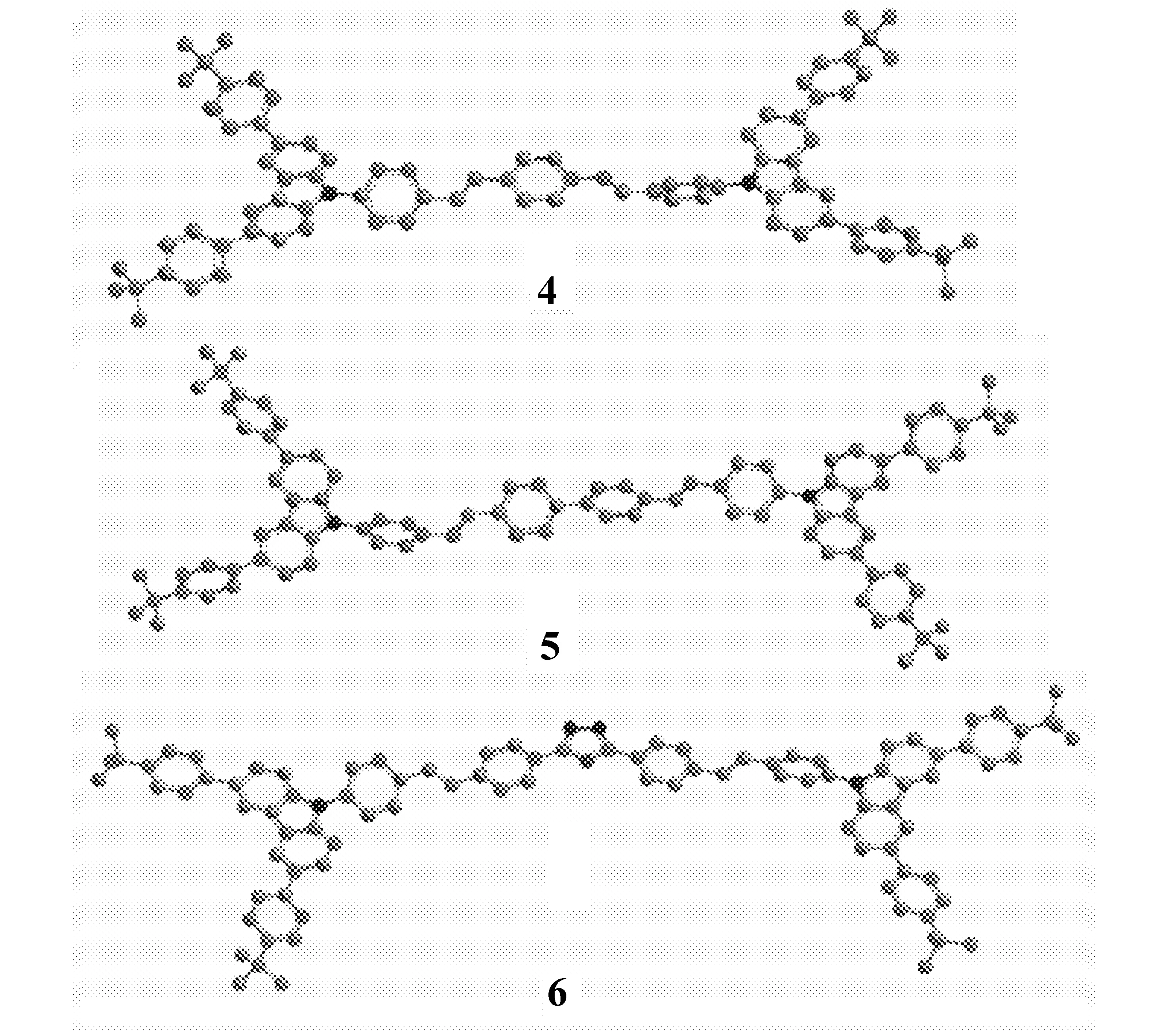
图3 化合物4、5和6的最稳定构象(MM2模拟,为清楚起见略去了氢原子)
对于化合物6,由于它含有噁二唑结构,而噁二唑这种电子受体结构(Acceptor,A)和咔唑这种电子给体结构(Donor,D)形成了D-π-A-π-D推拉电子效应,这种效应往往使紫外吸收波长往长波方向移动;另外,从分子结构的最稳定构象看,桥上的两个苯环和噁二唑环具有很好的平面性,使得共轭程度提高,从而使紫外吸收波长往长波方向移动。
图4和图5是化合物4、5和6分别在溶液状态和固体粉末状态下的荧光发射谱图。从图中可以看到,化合物4、5和6的二氯甲烷溶液的最大荧光发射波长分别为462,456和489 nm。可见在二氯甲烷溶液中,前两者发射的是蓝色荧光,后者则发射蓝绿色荧光。在固体粉末状态下,4、5和6样品的最大荧光发射波长分别是480、470和481 nm。与溶液荧光相比,前两者最大荧光发射波长发生了明显的红移,分别红移了18和14 nm。但是对于含噁二唑结构的化合物6则蓝移了8 nm。对于一般的有机发光材料,往往固体比溶液的荧光发射波长要长。这是因为在固体状态下,分子间的作用力比较强,有利于分子间的π-π堆砌,使带隙变窄,导致荧光发射波长红移。

图4 化合物4、5和6在二氯甲烷溶液中荧光发射光谱图
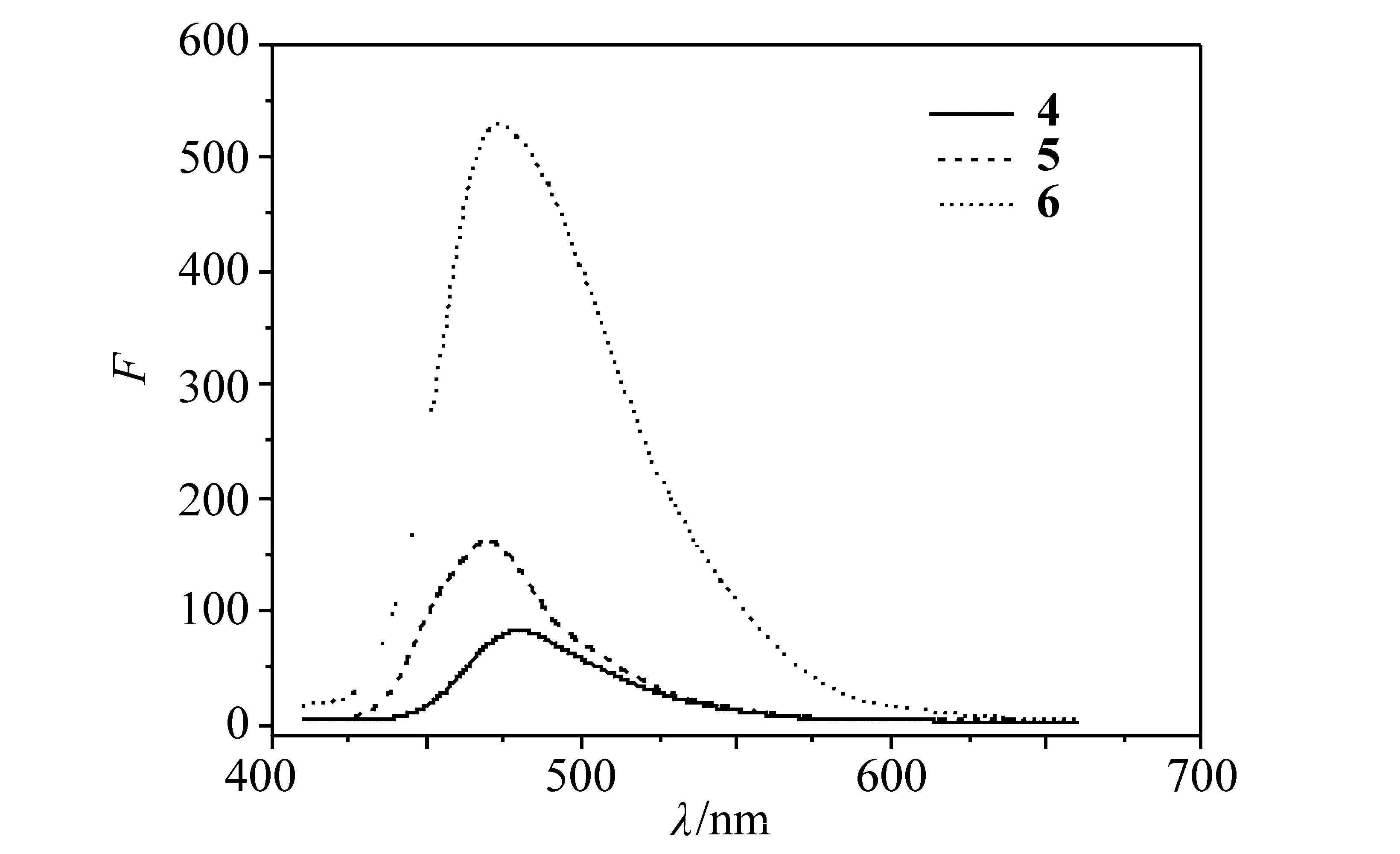
图5 化合物4、5和6的固体粉末荧光发射光谱图
对于化合物5的荧光发射波长比4短,同样也可以从图3的分子模拟结果得到解释,因为5的分子共轭程度不如4高,因此5无论在溶液还是固体状态荧光发射波长都比4短。对于6的反常现象,我们认为固体的堆砌状态可能对D-π-A-π-D推拉电子效应有一定的影响,另外,由于这个分子的极性较大,溶剂化程度与前两者应有较大的差别,这些综合因素的作用导致其固体荧光发射波长蓝移。
以9,10-二苯基蒽为标准,测得化合物4、5和6的二氯甲烷溶液(浓度为10-6mol/L)的荧光量子产率ΦFL分别为77%,69%和54%,说明所合成的化合物具有较高的溶液荧光量子产率。尽管化合物6的ΦFL达到54%,具有较高的荧光量子产率,但是与前两者相比,引入噁二唑结构对于合成高荧光量子产率化合物不是很有利。化合物4的荧光量子产率比5高,主要原因前者的共轭程度比较高,能隙比较窄,有利于提高荧光量子产率。
2.2 热性能
从化合物4、5和6的热失重图可以看到(图6),它们失重5%的温度(Td)分别为491、484和478 ℃。可见这些化合物的热失重温度都非常高,说明它们具有很高的热稳定性;另外,它们的热失重温度依次降低,这似乎和连接桥Ar的长度有关,Ar越长,热失重温度越低,热稳定性越差。
图7是化合物4、5和6的升温DSC图。从图中可以看到,这三个化合物具有非常高的玻璃化转变温度(Tg),分别为231、214和245 ℃。而一般的发光化合物,玻璃化转变温度往往在100 ℃左右,例如,商品化的蓝光材料二苯乙烯基联苯(DPVBi)的Tg只有64 ℃。众所周知,高Tg发光材料对于制备高稳定性的发光器件是十分重要的。
比较这三者的Tg可以发现,引入噁二唑结构对于提高材料的Tg非常有利,可能是由于噁二唑基团的强极性,导致其分子间作用力增大;另外,从分子模拟的结果看,这个分子的平面性比较好,有利于分子紧密堆砌,因此化合物6的Tg在三者中是最高的。化合物4的Tg比5高,同样可以从分子的平面性得到解释。从图3的模拟结果看,由于联苯的扭曲结构,化合物4稳定构象的平面性比化合物5高,因此其分子堆砌的紧密程度要比后者高,因此前者具有较高的Tg。

图6 化合物4、5和6的TGA曲线
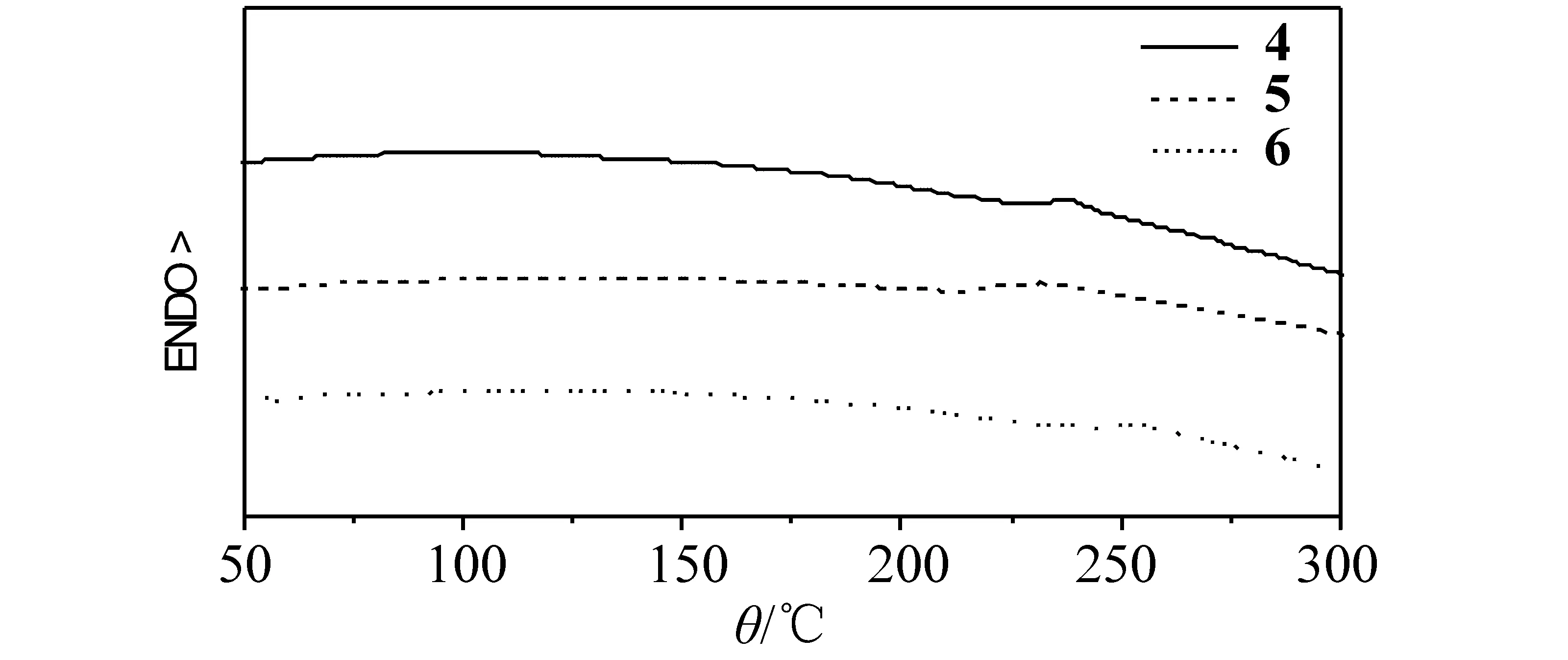
图7 化合物4、5和6的DSC图
另外,在整个升温过程中,在DSC曲线上都没有出现熔融转变峰,说明这3个化合物都很难结晶。从分子结构看,它们不仅具有非常刚性的结构,而且叔丁基苯取代的咔唑基团的空间位阻非常大,这样的分子结构使得其很难规整排列而结晶,因此在DSC升温曲线上看不到熔融转变。
2.3 分子能级水平
有机发光材料的能级水平对构建高性能发光器件非常重要。通过循环伏安曲线上的氧化起始电位(图8),我们通过计算得到了最高占有分子轨道(HOMO)的能级水平。化合物4、5和6的HOMO能级分别是5.39、5.44和5.43 eV。从紫外吸收光谱得到它们的能隙分别是2.89、2.93和2.89 eV,这3化合物具有较窄的能隙结构。因此,它们的LUMO能级分别是2.50、2.51和2.54 eV。而且从循环伏安曲线上也可以看到这3个化合物的氧化还原过程具有较好的可逆性。

图8 化合物4、5和6的循环伏安曲线
3 结 论
合成了3个含叔丁基苯基咔唑结构的H型衍生物,这些化合物在溶液和固体状态均能发射强烈荧光,其中两个在二氯甲烷溶液中发射蓝色荧光,一个发射蓝绿色荧光,它们在固体状态均发射蓝绿色荧光;化合物都具有较高的荧光量子产率;它们的能隙结构较窄,小于3.0 eV,约为2.9 eV;在紫外吸收光谱上,化合物的最大吸收波长与连接基团有明显的关系,我们用分子模拟的结果解释了由单苯环连接和联苯连接的化合物在紫外吸收和荧光发射波长上的差异。各产物的荧光发射均具有一定的规律性:中间连接基团为苯环结构的化合物其固体状态较溶液状态荧光发射波长红移;中间连接基团含有噁二唑结构的化合物其固体状态较溶液状态荧光发射波长蓝移,这种差异主要是由它们分子结构的差异造成的;合成的产物均具有非常高的热稳定性,它们的Td超过470 ℃,Tg超过220 ℃。通过循环伏安法可以测得各产物的氧化还原电位,并计算出它们的HOMO值,从各产物的循环伏安图上可以看到它们的氧化还原过程都是可逆的。
参考文献:
[1] SHI J, TANG C W. Doped organic electroluminescent devices with improved stability [J]. Applied Physics Letters, 2002, 80: 3201-3203.
[2] CULLIGAN S W, CHEN A C A, WALLACE J U,et al. Effect of hole mobility through emissive layer on temporal stability of blue organic light-emitting diodes[J]. Advanced Functional Materials, 2006, 16: 1481-1487.
[3] CHAO T C, LIN Y T, YANG C Y,et al. Highly efficient UV organic light-emitting devices based on bi(9,9-diarylfluorene)s [J]. Advanced Materials, 2005, 17: 992-996.
[4] KIM Y H, JEONG H C, KIM S H,et al. High-purity-blue and high-efficiency electroluminescent devices based on anthracene[J]. Advanced Functional Materials, 2005, 15: 1799-1805.
[5] WU J Y, PAN Y L, ZHANG X J, et al. Synthesis, photoluminescence and electrochemical properties of a series of carbazole-functionalized ligands and their silver(I) complexes[J]. Inorganica Chimica Acta, 2007, 360: 2083-2091.
[6] FU H Y, WU H R, HOU X Y,et al. N-Aryl carbazole derivatives for non-doped red OLEDs[J]. Synthetic Metals, 2006, 156: 809-814.
[7] FENG G L, LAI W Y, JIA S J, et al. Synthesis of novel star-shaped carbazole-functionalized triazatruxenes[J]. Tetrahedron Letters, 2006, 47: 7089- 7092.
[8] CHA S W, JIN J I. A field-dependent organic LED consisting of two new highTgblue light emitting organic layers: a possibility of attainment of a white light source[J]. J Materials Chemistry, 2003, 13: 479-484.
[9] JUSTIN THOMAS K R, LIN J T, TAO Y T,et al. Light-emitting carbazole derivatives: potential electroluminescent materials[J]. J American Chemical Society, 2001, 123: 9404-9411.
[10] WONG W Y, LIU L, CUI D M, et al. Synthesis and characterization of blue-light-emitting alternating copolymers of 9,9-dihexylfluorene and 9-arylcarbazole[J]. Macromolecules, 2005, 38: 4970-4976.
[11] 郑新友, 吴有智, 朱文清,等. 联苯乙烯类蓝色发光材料DPVBi的合成及发光性质研究[J]. 发光学报, 2003, 24(03): 265-269.
[12] 胡建立, 郭芳茹, 李云霞. 新型荧光增白剂的合成和表征[J].郑州大学学报:理学版, 2005, 137: 92-94.
[13] ZHU X Q, QIAN Y, LU Z F. Synthesis and characterization of 2,5-bis[4-(2- arylvinyl)phenyl]-1,3,4-oxadiazoles with two-photon fluorescence properties[J]. Frontiers of Chemical Engineering in China, 2007, 1: 381-384.
[14] INOUE M, SUZUKI T, NAKADA M. Asymmetric catalysis of nozaki-hiyama allylation and methallylation with a new tridentate bis(oxazolinyl) carbazole ligand[J]. J American Chemical Society, 2003, 125: 1140-1141.

