颈内动脉分叉处动脉瘤的血流动力学特点
薛绛宇 白卫星 王子亮 李钊硕 李立 曹广劭 曹会存 翟水亭 李天晓
动脉分叉是血管网中血流动力压力最大的位置,由于血流动力削弱了动脉分叉顶点的血管结构,在动脉分叉顶点就会形成囊状动脉瘤。动脉瘤囊内的涡流和震动导致动脉瘤壁变性、变薄、增大。颈内动脉分叉 (internal carotid artery bifurcation, ICBi) 动脉瘤的发生率较低,甚至在颈内动脉(internal carotid artery, ICA)发出的动脉瘤中也属少见,大约占颅内动脉瘤的3%~5%,然而,我们观察到ICBi动脉瘤的瘤颈并不位于颈内动脉分叉顶点(the apex of the arterial bifurcation),而是偏向大脑前动脉一侧。我们总结了这些动脉瘤的特点,并且分析了血流动力学原因。
材料与方法
从2004年10月到2009年6月,我院共治疗破裂出血的颅内动脉瘤患者577人,有18人(3.1%)患ICBi动脉瘤,其中男7人,女11人,年龄31~78岁,平均50.5岁。18人中有2人患多发动脉瘤,1人伴有同侧大脑中动脉M2段动脉瘤和对侧后交通动脉瘤,1人伴有同侧后交通动脉瘤。18个ICBi动脉瘤中10个在左侧,8个右侧。18人都经历了动脉瘤破裂的蛛网膜下腔出血,两个多发动脉瘤患者都是后交通动脉瘤出血,检查发现了额外的ICBi动脉瘤,其余16人都是ICBi动脉瘤出血。入院时Hunt and Hess分级Ⅰ级2人,Ⅱ级8人,Ⅲ级6人,Ⅳ级2人。所有18人均经过数字减影血管造影(digital subtraction angiography, DSA)检查,并且都制作了三维图像。16人进行了介入栓塞术治疗,2人行开颅夹闭手术。16个患者恢复良好,1个患者介入术中出血形成颅内血肿,又经过颅内血肿清除术,遗留中等残疾,1个开颅手术患者因手术中大出血,术后5天死亡。
ICBi动脉瘤的特点经过DSA评估,采用Intergris Allura C型臂(Philips Medical Systems,Best,the Netherlands)DSA机和Siemens Asiom Artis 平板DSA机,测量了动脉瘤的瘤体直径、瘤颈宽度,大脑前动脉水平段(A1段)和大脑中动脉水平段(M1段)的管径,瘤颈中点距离颈内动脉顶点的长度,对比了大脑前动脉和大脑中动脉分别由颈内动脉发出后形成的弯曲度,注意了动脉瘤的生长方向。
根据动脉瘤颈和颈内动脉分叉处几个血管的关系,我们把ICBi动脉瘤进行分类:当动脉瘤颈位于颈内动脉顶点的称为IC-Bi型动脉瘤,位于大脑前动脉的称为IC-A-Bi型,位于大脑中动脉的称为IC-M-Bi型。

性别 年龄 侧别 突出方向 瘤体最大径(mm) 瘤颈宽度(mm) 瘤颈中点与分叉顶点距离(mm) 大脑中动脉直径(mm) 大脑前动脉直径(mm)1 男 43 右 上 15.05 6.21 0 2.55 2.37 2 女 49 左 后 2.45 1.86 2.24 3.24 2.27 3 男 31 左 前上 9.72 2.49 1.1 2.93 2.18 4★ 女 58 左 后下 4.25 2.06 1.9 2.46 2.13 5 女 53 左 后下 7.98 2.09 1.7 2.39 2.66 6 男 37 右 后 5.16 3.24 1.79 2.34 1.83 7 女 44 右 后下 7.08 1.51 2.83 3.67 2.13 8★ 女 55 右 后上 3.75 1.82 1.24 2.81 3.08 9 男 50 左 后下 4.42 2.82 2.31 2.4 1.92 10 女 52 左 后下 4.29 1.46 1.42 3.7 1.78 11 女 78 右 上 4.40 2.81 2.44 3.37 3.06 12 女 63 左 后下 5.53 2.47 1.6 3.55 1.98 13 女 50 右 后下 4.43 2.33 1.82 2.99 2.19 14 男 38 左 后下 6.26 2.13 1.87 2.32 2.13 15 男 48 左 上 5.59 1.64 0 2.38 1.77 16 女 35 左 后上 2.77 2.2 2.1 2.82 1.89 17 男 58 右 后下 4.92 2.71 2.91 3.25 2.41 18 女 68 右 后上 5.22 3.31 1.68 3.64 2.14
结果
患者发病时的年龄31~78岁,平均50.5±11.9岁。
IC-Bi型动脉瘤2例,IC-A-Bi型16例,IC-M-Bi型0例。
动脉瘤体的最大直径为2.45~15.05 (平均5.74±2.91)mm,瘤颈宽度1.46~6.21 (平均2.51±1.07)mm。动脉瘤颈中心距离颈内动脉分叉顶点0~2.91(平均1.72±0.79)mm。
大脑前动脉水平段管径1.77~3.08(平均2.22±0.37)mm,大脑中动脉水平段管径2.32~3.64(平均2.93±0.51)mm。
动脉瘤向前或向上生长的4例,向后上、后、或后下生长的14例。
17例患者的大脑前动脉由颈内动脉发出后形成的弯曲明显大于大脑中动脉的弯曲度,1例大脑前动脉由颈内动脉发出后径直走向前内侧,没有形成弯曲。
讨论
ICBi动脉瘤发生率较低,约占颅内动脉瘤的3%~5%[1,2],但2007年Sunil Kumar GUPTA等[3]报道999个手术治疗的动脉瘤患者中有89人(8.9%)患ICBi动脉瘤,而且其中42人在30多岁或者更年轻,手术后出现严重并发症者达到31.4%。2008年van Rooij WJ等[4]报道了50例ICBi动脉瘤(46人)的介入栓塞治疗,占同期2249个动脉瘤的2.4%,其中7个动脉瘤(14%)进行了再次手术治疗。我们治疗这些动脉瘤时也发现有特殊的技术困难,与动脉瘤的位置关系密切,所以我们回顾了18个ICBi动脉瘤患者(占同期患者的3.1%)的疾病特点,并从流体力学的角度对该部位动脉瘤作了分析。

图1 大型动脉瘤,瘤颈范围包括了A1和M1起始部分。

图2 A1段径直走向前内,没有形成弯曲。动脉瘤位于ICBi的顶点。

图3 动脉瘤位于A1起始段,突向后上。

图4 动脉瘤位于A1起始段,突向后下。
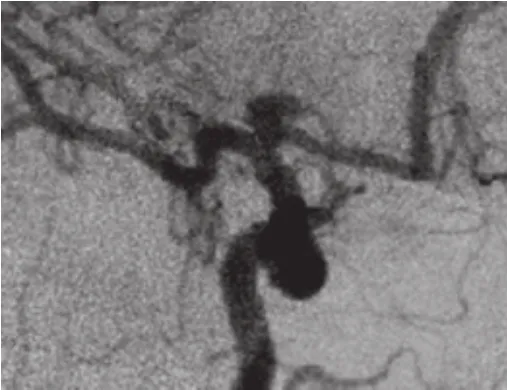
图5 动脉瘤位于A1起始段,突向后上。
在血管壁上主要有三种血流动力学的作用力:冲击力、压力和剪切力。1997年Foutrakis GN等[5]在有限元法分析计算机脑血流模拟试验中,证明冲击力对血管分叉的作用。假设血管是刚性圆管,圆管中的血流是层流,那么中心血流(central blood flow streams)的流速最大,在血管分叉顶点(the apex of the arterial bifurcation),由于受到中心血流冲击,跨壁压力比近端母血管的跨壁压高2~3倍;而心肌收缩使分叉区形成一个搏动性刺激,冲击力的峰值很高,因为冲击时间很短,对于特定量的变化,冲击时间短则输出更高的力。在冲击时,分叉顶点的动能改变为压力能(停滞压力),其他区域的血管没有这种额外的压力,作用在顶点的全部压力等于跨壁压与停滞力之和。中心流的血流动力学结果使分叉顶点血管内弹力层局部变性,导致动脉瘤的生成。
2006年S.Sakamoto等[1]总结了10例ICBi动脉瘤患者,发现这些动脉瘤的瘤颈往往并不长在颈内动脉的分叉处,而是偏向一侧分支,其中7个(70%)是IC-A-Bi型,3个是IC-Bi型。与之相似,我们的18个患者有16个(89%)是IC-A-Bi型,2个是IC-Bi型,动脉瘤颈中心平均距离颈内动脉分叉顶点1.72±0.79mm。看来,ICBi动脉瘤规律性地易于偏向大脑前动脉生长。看来,用分叉处血流冲击力最大的血流动力学原理不能解释这种现象。
S.Sakamoto等[1]测量了大脑前动脉和大脑中动脉与颈内动脉之间形成的角度,发现大脑前动脉形成的角度更陡,认为大脑强动脉受到剪切力更大,更易生长动脉瘤。但是,他们忽略了血管的弯曲,假设血管是直的,并且假设这几个血管在同一个二维平面上,与实际解剖差别太大,结论不可靠。
1999年台湾国立清华大学动力机械研究所的刘通敏、刘顺男总结了侧壁动脉瘤、分叉动脉瘤和终端动脉瘤的血流动力特性[6],认为ICBi动脉瘤和基底动脉顶端动脉瘤都属于终端动脉瘤(terminal aneurysm),在动脉分叉模型的顶点可以看到轴心血流(axial stream)冲击,内弹力层变性,小动脉瘤形成。流体冲入动脉瘤内形成螺旋状或S形的涡流衰减(vortex breakdown),涡流衰减像是一个开关,如果上游来的是层流,在这里启动为下游的紊流,不管是对称分流模式还是不对称分流模式,涡流衰减都在动脉瘤附近造成很大的震动,使瘤壁变性,动脉瘤逐渐生长。这同样不能解释大多数ICBi动脉瘤位置的偏差。
1999年Foutrakis GN[7]等在对血管分叉的冲击力计算模型分析基础上,继续分析血流的压力、剪切力与不均衡血管分叉处动脉瘤的生成与生长的关系,注意到位于较大分支一侧的动脉瘤颈处受到的压力最大(瞬时压力曲线图显示:大分支一侧的动脉瘤颈处形成高压滞留区);而较小分支一侧的动脉瘤颈处受到的剪切力最大(切变率-时间曲线图显示:在完整的心动周期内,小分支侧的瘤颈处切变率始终大于大分支侧);血流自主干血管来,由较大分支一侧的动脉瘤颈进入动脉瘤腔内,形成涡流,在瘤体内环绕后,由较小分支一侧的动脉瘤颈处流出,并加入小分支的血流,这个血流变化又在心肌收缩的减速期出现一个压力震荡,使小分支一侧的压力出现一个继发增高。这种压力特点使动脉瘤颈区发生结构疲劳,瘤颈生长,而小分支一侧的瘤颈生长速度超过大分支一侧,那么,动脉瘤颈会逐渐向两侧增宽,从顶点向小分支一侧增加的幅度大于大分支一侧,却不能离开血管分叉顶点。与我们观察到的多数动脉瘤生长在小分支上不一致。
同时,在弯曲血管模型中,Foutrakis GN[7]等发现高压出现在弯曲动脉的外侧壁顶点,这个位置的动脉瘤形成后,可见由管道内整齐通过的流体质点进入局部膨大,外层血流与内层血流形成分隔,外层流体质点在动脉瘤内绕一圈后出来再由主流带到下游区。这种血流方式造成远端瘤颈处的局部切变率明显大于近端瘤颈,提示远侧端瘤颈易受到更大血流动力学压力,使动脉瘤向远侧瘤颈处生长,即这种类型的动脉瘤的突出方向会偏向它的血流方向。
刘通敏等[8]对弯曲血管的研究认为弯曲度很大的血管,很小的剪切力也可能造成内膜的损害。瘤内会形成与主流方向相反的涡流,血管弯曲度越大,流体进入动脉瘤内的速度越大,瘤壁的压力和剪切力越大,剪切力最大位于动脉瘤颈口的下游边缘,与前述研究一致。
对于弯曲血管的研究,大多文献假设动脉瘤已经形成,然后强调在动脉瘤内和动脉瘤附近获得的参数并进行分析,Yixiang FENG等[9,10]从没有动脉瘤的弯曲管道着手,关注动脉瘤如何生成并生长。他们认为受到弯曲的影响,血流开始歪曲向外侧壁,在弯曲顶点的局部血管壁,因受到很大的剪切力而发生变性,一旦剪切力突破动脉瘤形成的“门槛”,就开始出现局部膨大,动脉瘤形成。剪切力最大位于动脉瘤的远侧瘤颈口处,这种高剪切力使瘤颈生长成瘤囊的一部分,新的瘤颈区域被创造出来,变成新的高剪切力区。动脉瘤的生长是血管壁剪切力和管壁变性的结果。
我们的患者女性多于男性,和先前的文献一致。患者的大脑前动脉在离开颈内动脉末端所形成的弯曲度都明显大于大脑中动脉的弯曲度;大脑前动脉的平均管径小于大脑中动脉的平均管径。动脉瘤更多地突向后方,而不是像文献中描述的突向上方或前方[1,3,4]。
颈内动脉床突上段位于蛛网膜下腔内,由前到后外,走行于前、后床突上方的假想连线上,并于前穿质下方续为终段。大脑前动脉由颈内动脉发出后,水平向前内,行走于视交叉上面进入大脑纵裂内。向后外方向的颈内动脉发出大脑前动脉走向前内,使大脑前动脉起始处形成一个很大的弯曲,这个弯曲的顶点突向后方。以弯曲血管模式分析动脉瘤的形成,能够较好地解释ICBi动脉瘤的特点:通常瘤发生于大脑前动脉起始段的弯曲顶点,主要是剪切力,而不是冲击力或压力的作用结果,而且,动脉瘤顶常常突向后方。
我们有2例患者动脉瘤颈位于颈内动脉分叉顶点,其中1例是大型宽颈动脉瘤,可以理解为瘤颈向两侧增宽,完全覆盖了颈内动脉分叉顶点。另1例患者是小型窄颈动脉瘤,瘤颈也恰好位于颈内动脉分叉顶点,从这个患者的血管造影上可以看到,大脑前动脉从颈内动脉上分出后,径直走向前内,没有形成弧形弯曲,这样就与Foutrakis GN等[5]模拟的血管分叉——直的主干血管上发出两个直的分支血管——完全吻合,可以用血流冲击力在血管分叉顶点最大来解释这个动脉瘤的形成。
结论
根据我们的临床观察,ICBi动脉瘤往往并不长在颈内动脉的分叉处,而是规律性地易于偏向大脑前动脉,从大脑前动脉起始段的弯曲顶点出生长。与血管弯曲的方向一致,动脉瘤通常突向后方。出现这种现象的原因是在弯曲顶点的局部血管壁,因受到很大的血流剪切力而发生变性,一旦切应力突破动脉瘤形成的“门槛”,就开始出现局部膨大,动脉瘤形成。
[1]Sakamoto S;Ohba S;Shibukawa M;Kiura Y;Okazaki T;Arita K;Kurisu K: Characteristics of aneurysms of the internal carotid artery bifurcation. Acta Neurochirurgica?148:139-143,?2006.
[2]Yasargil MG (1984) Microsurgery Ⅱ. Georg Thieme Verlag, New York, pp 109-123
[3]Sunil Kumar G UPTA , Virender Kumar K HOSLA, Rajesh C HHABRA, et al. Internal Carotid Artery Bifurcation Aneurysms: Surgical Experience.Neurologia medico-chirurgica 47: 153-158, 2007.
[4]van Rooij WJ, Sluzewski M, Beute GN. Internal carotid bifurcation aneurysms: frequency, angiographic anatomy and results of coiling in 50 aneurysms. Neuroradiology 50:583-587,2008.
[5]Foutrakis GN;Yonas H;Sclabassi RJ:Finite element methods in the simulation and analysis of intracranial blood flow. Neurological Research?19:174-186,1997.
[6]Liou TM, Liou SN. A review on in vitro studies of hemodynamic characteristics in terminal and lateral aneurysm models. Proc Natl Sci Counc Repub China B 23 :133 -148,1999.
[7]George N. Foutrakis, Howard Yonas and Robert J. Sclabassi:Saccular Aneurysm Formation in Curved and Bifurcating Arteries. American Journal of Neuroradiology 20:1309-1317, 1999.
[8]Liou TM, Liao?CC. Flowfields in lateral aneurysm models arising from parent vessels with different curvatures using PTV. Experiments in fluids? 23:?288-298, 1997.
[9]Yixiang FENG, Shigeo WADA, Ken-ichi TSUBOTA, et al. Growth of Intracranial Aneurysms Arised from Curved Vessels under the Influence of Elevated Wall Shear Stress ─ A Computer Simulation Study. JSME International Journal Series C 47: 1035-1042, 2004.
[10]Yixiang FENG, Shigeo WADA, Takuji ISHIKAWA, et al. A Rule-Based Computational Study on the Early Progression of Intracranial Aneurysms Using Fluid-Structure Interaction: Comparison between Straight Model and Curved Model. Journal of Biomechanical Science and Engineering 3: 124-137, 2008.