猪蛔虫不同发育阶段09G10基因的表达分析*
黄翠琴,赖芳芳,杨小燕,戴爱玲,李晓华
(1.龙岩学院生命科学学院,福建龙岩 364000;2.龙岩学院预防兽医学与生物技术福建省高等学校重点实验室,福建龙岩 364000)
猪蛔虫不同发育阶段09G10基因的表达分析*
黄翠琴1,2,赖芳芳1,杨小燕1,2,戴爱玲1,2,李晓华1,2
(1.龙岩学院生命科学学院,福建龙岩 364000;2.龙岩学院预防兽医学与生物技术福建省高等学校重点实验室,福建龙岩 364000)
为进一步鉴定和分析猪蛔虫感染相关基因,从构建的猪蛔虫感染期幼虫消减cDNA文库中筛选出一基因(EST编号为09G10),以肌动蛋白(β-actin)为内参,采用半定量RT-PCR方法分析该基因在猪蛔虫不同发育阶段的表达情况。通过09G10基因与内参β-actin基因的积分光密度的比值结果显示,09G10在感染期幼虫中呈现高丰度表达,在肺第3期幼虫和第4期幼虫期有微量表达,在其他各期虫体包括肝第3期幼虫、雌虫、雄虫和虫卵均未检测出该基因的表达量,表明09G10基因可能是猪蛔虫幼虫期所特有的基因,在幼虫感染宿主过程中可能扮演重要角色,为进一步研究该基因的功能提供了依据。
猪蛔虫;感染期幼虫;半定量RT-PCR
猪蛔虫(Ascaris suum)是猪体内常见的寄生虫,它感染普遍,呈世界性流行,集约化饲养的猪和散养猪均广泛发生。主要引起仔猪发育不良,生长速度可下降30%。严重时发育停滞,形成“僵猪”,甚至造成死亡。我国猪群中猪蛔虫感染率因地区和饲养条件的不同而有所差距,感染率为17.3%~85.71%[1]。猪蛔虫病不仅对养猪业造成严重的危害,而且对人类健康也构成较大的危害,如幼虫的移行可造成人体幼虫移行症。因此,对猪蛔虫的研究和控制势在必行。半定量RT-PCR是近年来用来定量测定特异性mRNA丰度的一种常用方法,主要利用PCR反应的灵敏性和特异性等特点,通过在线性增长期内目的片段的扩增强度与内参强度相比较,判定目的基因的拷贝数。本研究从构建的感染期幼虫消减cDNA文库中筛选一基因(EST编号为09G10,基因登录号为ES291002),应用半定量 RTPCR方法分析该基因在不同发育期的表达情况。
1 材料与方法
1.1 材料
1.1.1 猪蛔虫 购自龙岩市某屠宰场。
1.1.2 主要试剂 总RNA提取液Trizol;反转录试剂盒ReverTra Ace-α-TM,为TOYOBO公司产品;rTaqDNA聚合酶为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 猪蛔虫不同发育期幼虫的收集 参照黄翠琴等[2]方法收集不同发育期的猪蛔虫幼虫,保存在-70℃备用。
1.2.2 猪蛔虫各期虫体总RNA的提取 按Trizol说明书提取虫体总 RNA,取5 μ L RNA 溶解液,于10 g/L琼脂糖凝胶中电泳,取2 μ L总RNA测定其在260、280 nm处的光密度,计算A260/A280的值,估计总RNA的纯度,通过A260值对总 RNA进行定量。剩余的 RNA溶液贮存于-70℃备用。
1.2.3 逆转录反应 根据ReverTra Ace-α-TM试剂盒说明书进行。根据不同样品RNA浓度调整加入的RNA 的体积,使RNA 初始量一致,都为1 μ g。
1.2.4 PCR反应
1.2.4.1 引物 选用猪蛔虫的β-actin基因为内参,参照邓艳[3]设计的引物扩增;β-actin基因的上游引物 :5′-CTCGAAACAAGAATACGATG-3′;下游引 物 :5′-ACATGTGCCGT TGTATGATG-3′。 用Oligo软件结合手工分析的方法设计基因09G10的一对 引物,上游引物 :5′-GAGCAGAAGCAAATGTTAGG-3′;下 游 引 物 :5′-GCAGAGACAGGCAGATACAG-3′。
以上引物由上海英骏公司合成,使用时加灭菌双蒸水稀释成10 pmol/μ L,分装后于-20℃保存备用。
1.2.4.2 PCR反应条件优化 参照邓艳[3]的PCR反应体系,优化Mg2+浓度、退火温度及循环次数,获得适宜的实验参数,建立能稳定扩增09G10和βactin基因片段的有效的半定量PCR检测体系。
1.2.4.3 09G10基因在不同发育期的表达分析采用以上优化好的RT-PCR条件研究09G10基因在不同发育期的表达情况。反应在同一次PCR反应中进行。PCR产物在琼脂糖凝胶中电泳。用凝胶成像系统对电泳条带进行光密度分析,以目的基因09G1和内参β-actin基因的积分光密度的比值代表目的基因的mRNA含量。凝胶成像和定量分析采用英国UVITEC公司的UVIsoft图像采集和分析软件。
2 结果
2.1 不同发育期虫体总RNA提取及纯度检测
采用Trizol提取猪蛔虫各期虫体的总RNA,提取后用已加入溴化乙锭的10 g/L琼脂糖凝胶进行电泳,由图1可以看到28 S、18 S核糖体 RNA条带较清晰,其他RNA条带比较模糊,表明所提取的总RNA未降解。核酸蛋白测定仪检测提取的总RNA,各期虫体RNA的A260/A280比值均在1.8~2.0之间。
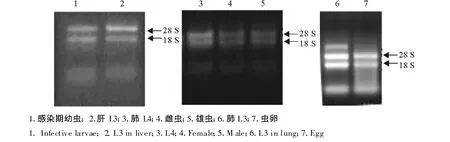
图1 猪蛔虫各发育期虫体总RNA琼脂糖电泳图Fig.1 Analysis of total RNA from different stages of Ascaris suum by agarose gel electrophoresis
2.2 半定量RT-PCR产物循环数的确定
本试验分别在 20、22、25、27、30个循环时对09G10基因片段进行扩增,电泳结果(图2)经凝胶成像系统扫描分析,以各电泳条带的光密度值(光密度曲线峰面积)作为纵坐标,循环次数为横坐标作图(图3)。从图3可见,09G10到27个循环,扩增在指数增长期,因此在正式试验中对该基因采用26个循环数,内参β-actin基因参照邓艳[3]的论文选用25个循环。
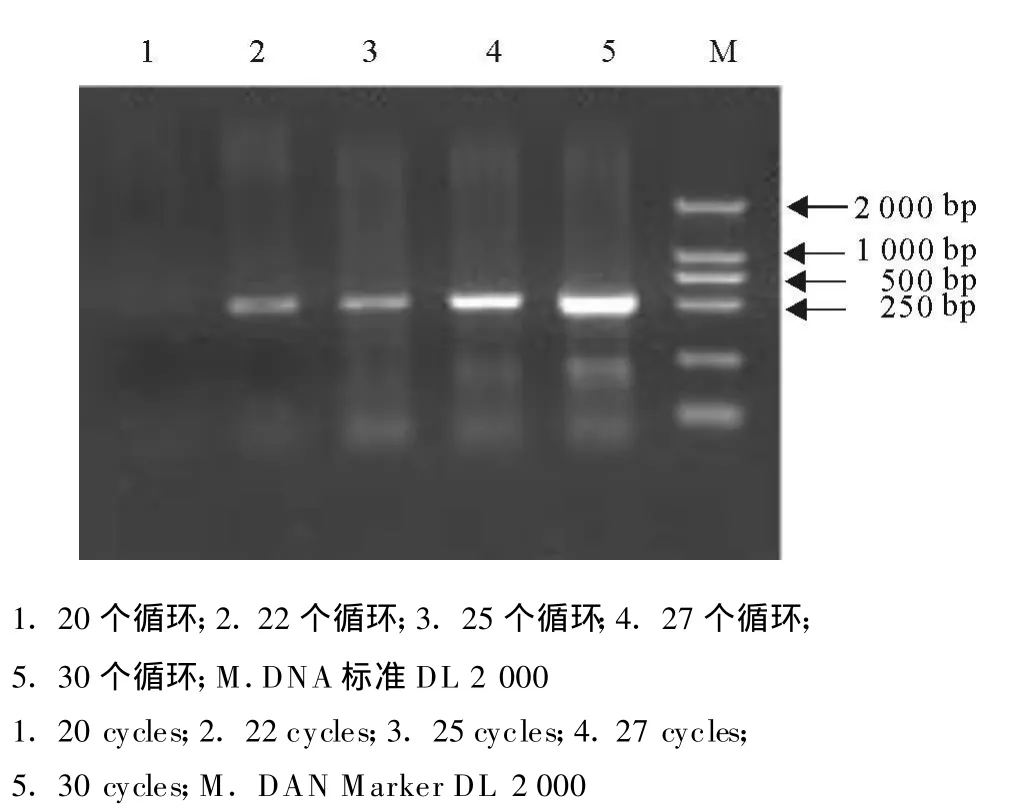
图2 不同扩增循环数对09G10基因产物的电泳分析Fig.2 Electrophoretic analy sis for products of different cy clee numbers of 09G10 gen

图3 09G10基因不同扩增循环数电泳条带IOD值分析图 Fig.3 Analy sis of IOD for the different cycle number of 09G10 gene
2.3 09G10基因半定量RT-PCR分析
看家基因β-actin在虫体中稳定表达,见图4。将目的基因PCR扩增产物和内参基因扩增产物混合后,加入同一个电样孔进行电泳(图5),用 UVI-soft图像采集和分析软件测出每条条带的完整光密度值。以目的基因与内参基因的光密度比值代表该基因在不同发育期的表达量。试验的研究结果发现,该基因在感染期幼虫中呈现高丰度表达,在肺第3期幼虫和第4期幼虫期有微量表达,在其他各期虫体包括肝第3期幼虫、雌虫、雄虫和虫卵均未检测出该基因的表达量(表1和图6)。
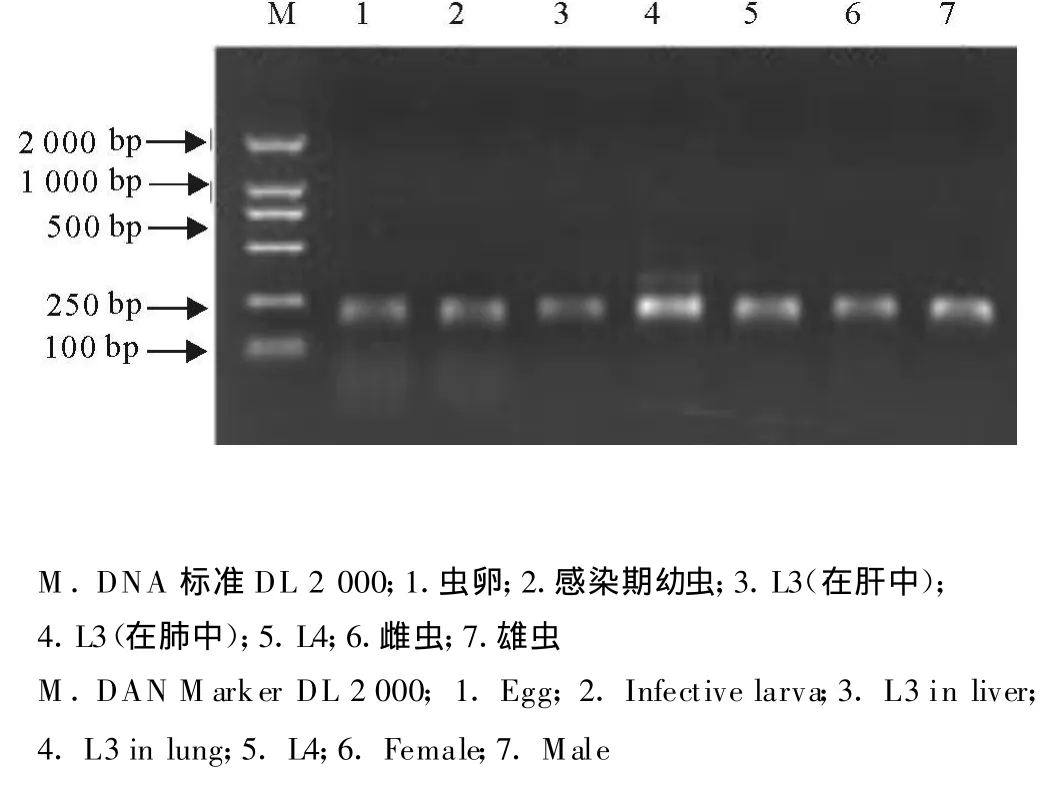
图4 β-actin基因在不同发育期虫体的PCR产物电泳分析Fig.4 Electrophoretic analysis of β-actin gene PCR products in different developmental stages of A.suum

图5 09G10基因在不同发育期的表达情况电泳分析Fig.5 Electrophoretic analysis of expression of 09G10 genes in different developmental stages of A.suum

表1 猪蛔虫感染期幼虫基因克隆09G10和β-actin PCR产物电泳相应条带的光密度比值Table 1 The IOD ratio of the PCR products of 09G10 gene andβ-actin gene in infective larvae of A.suum

图6 09G10基因在不同发育期的表达情况分析Fig.6 Analysis of expressed 09G10 gene of different developmental stages
3 讨论
本研究从已构建的猪蛔虫感染期幼虫消减cDNA文库中筛选一基因(09G10),采用RT-PCR对该基因在不同发育期虫体的mRNA丰度进行了半定量分析。半定量RT-PCR是近年来用来定量测定特异性mRNA丰度的一种常用方法,主要利用PCR反应的灵敏性和特异性等特点,通过在线性增长期内目的片段的扩增强度与内参强度相比较,判定目的基因的拷贝数。该方法的优点是mRNA经反转录后PCR数次循环,产物的量以指数形式增长,即使模板浓度较低也能检测到[4],目前已被国内外许多学者用于检测mRNA表达丰度[5-8]。该技术的关键是优化试验条件,寻求PCR线性扩增范围,确定最适Mg2+浓度和PCR循环次数。选择合适的看家基因很关键,本试验选用的是猪蛔虫的β-actin基因,此基因在各个发育期几乎均匀表达[9]。由于内参的丰度一般远远大于目的基因的丰度,所以使二者同时都在线性范围内扩增,往往使内参已饱和了而目的基因的条带还不清晰,因此,本试验采用同一次PCR反应,但内参基因在邓艳[3]研究的基础上,选用25个循环,目的基因根据其循环数的光密度值,到27个循环,扩增在指数增长期,因此试验中选择26个循环数进行扩增,从而保证目的基因和内参的扩增都在线性增长期。
本研究结果表明,目的基因09G10在猪蛔虫感染期幼虫中呈高丰度表达,在肺第3期幼虫和第4期幼虫期有微量表达,在其他各期虫体包括肝第3期幼虫、雌虫、雄虫和虫卵均未检测出该基因的表达量。生物信息学分析显示,09G10与编码秀丽新杆线虫的Poly(A)结合蛋白(PABP)的基因有70%的相似性。PABP是一类可以与mRNA 3′端Poly A结合的高度保守的蛋白质,参与mRNA的翻译并调节其稳定性,在不同的细胞类型中存在种类和功能各异的PABP。在早期发育过程中,卵母细胞中储存大量母源性mRNA以备在合子基因激活前合成发育所需的蛋白质。母源性mRNA的翻译起始和沉默受到严格的调控,此调控过程需要PABP的参与。在爪蟾中发现一种新的Poly(A)结合蛋白,命名为ePAB,在爪蟾Ⅵ期卵母细胞及早期胚胎中表达[10]。Seli E等[11]利用RT-PCR和原位杂交技术检测到ePAB的mRNA存在于小鼠PⅠ、MⅡ期卵母细胞和一、二细胞胚胎中,而在四细胞以后就检测不到其mRNA了。而且,PAB的mRNA只特异性地表达于小鼠的卵巢、睾丸和早期胚胎。由此可见,ePAB参与了爪蟾和小鼠配子发生以及早期胚胎发育过程中的基因表达调控,特别是母源性mRNA的翻译激活和沉默的调控。本试验中09G10在感染期幼虫、肺第3期幼虫和第4期幼虫期中有不同程度的表达,可能是猪蛔虫幼虫期所特有的,推测该基因在猪蛔虫幼虫的发育过程中可能参与前体mRNA的成熟,启动mRNA的翻译,并调节其稳定性。目前对 PABP的研究还存在空白,至今还没有发现PABP在翻译起始时由PABP介导的复合物的所有组分,对其在发育过程中的作用还不是很清楚,因此研究PABP的功能对揭示寄生线虫的发育具有重要意义。
[1]陈 宁,黄翠琴,朱兴全.猪蛔虫的生活史及体外培养研究进展[J].热带医学杂志,2006,2(2):220-222.
[2]黄翠琴,陈 宁,邹丰才,等.猪蛔虫不同发育期幼虫的收集方法研究[J].热带医学杂志,2006(5):487-489.
[3]邓 艳.猪蛔虫雄虫cDNA文库的构建及性别差异表达基因的筛选和鉴定[D].广东广州:华南农业大学,2006:38-49.
[4]张 翔,王寒正,龚岳亭,等.RT-PCR测定 mRNA的荧光定量分析[J].生物化学与生物物理学报,1998,30(1):70-73.
[5]周林福,陈离伟,姜云水,等.荧光定量PCR与半定量PCR检测HBVDAN的对比分析[J].中国病理生理杂志,2005,21(5):838-867.
[6]张丽娜,牛吉山,于 岭.用半定量 RT-PCR方法分析小麦TaMlo-Alc基因的表达[J].西北植物学报,2005,25(7):1368-1371.
[7]T ran M T,Lausch R N,Oakes J E.Substance P differentially stimulates IL-8 sy nthesis in human corneal epithelial cells[J].Inwest Ophthalmol Vis Sci,2000,41(12):3871-3873.
[8]Marone M,M ozzetti S,Ritis D D,et al.Semiquantitative RTPCR analysis to assess the expression levels of multiple transcripts from the same sample[J].Biol Proceed Online,2001,3(1):19-25.
[9]M c Neel R L,M ersmann H J.Distribution and quantification of betal-,beta2-,and beta3-adrenergic receptor subtype transcripts in porcine tissues[J].J Anim Sci,1999,77(3):611-612.
[10]Voeltz G K,Ongkasuwan J,Standart N,et al.A novel embry onic poly(A)binding protein,ePAB,regulates mRNA deadenylation inXenopusegg extracts[J].Genes Dev,2001,15(6):774-788.
[11]Seli E,Lalioti M D,Flaherty S M,et al.An embryonic poly(A)-binding protein(ePAB)is ex pressed in mouse oocytes and early preimplantation embryos[J].Proc Natl Acad Sci USA,2005,102(2):367-372.
Expression Analysis of 09G10 Gene in Different Developmental Stages ofAscaris suum
HUANG Cui-qin1,2,LAI Fang-fang1,YANG Xiao-yan1,2,DAI Ai-ling1,2,LI Xiao-hua1,2
(1.College of Li fe Sciences,Longyan University,Longyan,Fujian,364000,China;2.K ey Laboratory of Preventive Veterinary Medicine and Biotechnology Longyan University,Longyan,Fujian,364000,China)
To identify and analyze the gene related with infection ofAscaris suumin this study,the gene 09G10 was selecte from the suppression subtractive hybridization(SSH)of infective larvae ofA.suum.The gene expression levels were analyzed at different stage worms,using semi-quantitative RT-PCR method,with actin(β-actin)gene as internal control.Visualization of RT-PCR products of β-actin in all the stages under UV-light exposure was used to confirm equal template.The results showed that the expression level of the gene 09G10 in the infective larva is the highest and much more than L3 stage in lung and L4;no expression were tested in eggs,L3 stage in liver,male and female.T he results provide a foundation for further studying the developmental processes and infectivity ofA.suum.
Ascaris suum;infective larva;semi-quantitative RT-PCR
S852.731;Q786
A
1007-5038(2010)08-0060-04
2010-07-01
资金项目:福建省自然科学基金项目(2008J0070);福建省教育厅科技计划A类项目(JA08232)
黄翠琴(1978-),女,福建人,博士,主要从事寄生虫功能基因组学研究。