稀土元素铈对若干淡水绿藻的毒性作用
许晓路,孙金艳,徐冬梅
(浙江树人大学 生物与环境工程学院,浙江 杭州 310015)
稀土是一种具有特殊性质的矿产资源,在工业、养殖业、国防和医药等领域得到广泛应用[1-3]。我国稀土资源丰富,稀土储量及产量均居世界首位。自1984年以来,我国稀土的年产量增长率均在20%以上,尤其以石化、印染、制革及农业的应用发展最为迅速[4]。这使得稀土元素及其化合物大量进入环境,特别是随着工业废水的排放和农田地表径流进入水体,对水生生态环境构成潜在威胁,并通过食物链而影响人类健康。
绿藻是水生生态系统中重要的初级生产者,关系到水体生产力和水体生态平衡。藻类对于外来物质的刺激反应十分敏感,环境变化会出现藻类种群结构及生物多样性的变化,从而引起水质的相应变化。同时藻类对富营养水体的净化起着重要作用,其中某些种类,特别是小球藻属的存在与否可作为水质评价的重要指标[5-6]。铈是应用较多的稀土元素之一。本研究通过绿藻模拟培养试验,在不同的铈浓度下测定绿藻的半数效应浓度 (EC50)、生物量、叶绿素含量、蛋白质含量及若干理化指标,为污染物排放标准和环境质量标准制定提供基础资料。
1 材料和方法
1.1 试剂
稀土铈购自北京有研稀土新材料股份有限公司,用少量浓硝酸将氧化铈溶解再用蒸馏水稀释,配置成质量浓度为2 000 mg·L-1的标准硝酸铈溶液作为母液备用。
硫酸铵 (NH4)2SO4、硫酸镁 (MgSO4·H2O)、土壤浸出液、碳酸氢钠 (NaHCO3)、氯化钾(KCl)、氯化铁 (FeCl3)1%(m/m)、过磷酸钙、90%丙酮、考马斯亮蓝 G-250试剂、对二甲苯、95%乙醇、牛血清蛋白、浓硝酸、pH值7.8的磷酸缓冲液均为分析纯。
1.2 实验藻类
斜生栅藻及蛋白核小球藻购自中国科学院水生生物研究所。培养基为水生4号 (HB-4)人工培养液[7]:(NH4)2SO40.20 g·L-1,过磷酸钙 0.03 g·L-1,MgSO4·H2O 0.08 g·L-1,NaHCO30.10 g·L-1,KCl 0.025 g·L-1, 1%FeCl3(m/m)0.15 mL,土壤浸出液0.50 mL。将藻种在无菌条件下接种至水生4号人工培养液中,于智能人工气候箱恒温光照培养至对数生长期,并进一步扩大培养。培养方法:用1 000 mL三角瓶,移取400~600 mL水生4号人工培养液,接种藻种使之成淡绿色。用4层纱布封口以防污染,培养温度为(24±1.0)℃,4 500~5 000 lx连续静止培养。每天定时摇动4~5次,以减少水藻细胞贴壁现象,并尽可能保证对藻液光照均匀。为防止藻种老化,10 d接种1次。
1.3 仪器与设备
JY92-2 D超声波细胞粉碎机 (宁波新芝生物科技股份有限公司)、JI KA-1000台式离心机、AvantiJ-E立式大容量冷冻离心机、制冰碎冰机、智能人工气候箱 (宁波海曙赛福实验仪器厂)、超纯水机、PB-10 E PH计、LDZX-40Ⅱ型 立式自动电热压力蒸汽灭菌器 (上海申安医疗器械厂)、CS101-3 EB电热鼓风干燥器、KSW电阻炉温度控制器4-10(沈阳市节能电炉长)、101 A-3B型 电热鼓风干燥箱 (上海市实验仪器总厂)、BS224S电子天平、UV-2450紫外/可见分光光度计、SKF-6 A超声波清洗器、SW-CJ-1 F单人双面净化工作台、HI9142溶解氧仪。
1.4 急性毒性实验的绿藻培养
取进入对数生长期藻液作为接种藻液,各处理组加入不同量的硝酸铈溶液 (表1-2)。光照时间16 h,黑夜8 h,光照强度4 500~5 000 lx,培养温度为 (24±1.0)℃连续静止培养。每个处理浓度设置3个平行。

表1 蛋白核小球藻的急性实验设计
分别于培养24,48,72,96 h后取样,在波长689 nm处测定藻液光密度,建立不同藻类细胞密度 (105,纵坐标)和光密度 (横坐标)之间线性关系,以计数的藻细胞浓度和光密度表示藻生物量,通过两者线性关系进行检验。
1.5 慢性毒性实验的绿藻培养
取进入对数生长期藻液作为接种藻液,各处理组加入不同量的硝酸铈溶液 (表3-4)。光照时间16 h,黑夜8 h,光照强度4 500~5 000 lx,培养温度为 (24±1.0)℃,连续静止培养。每个处理浓度设置3个平行。测定培养96和192 h时的吸光度。并在192 h后按实验设计测定其它指标。

表2 栅藻的急性实验设计

表3 蛋白核小球藻的慢性实验设计
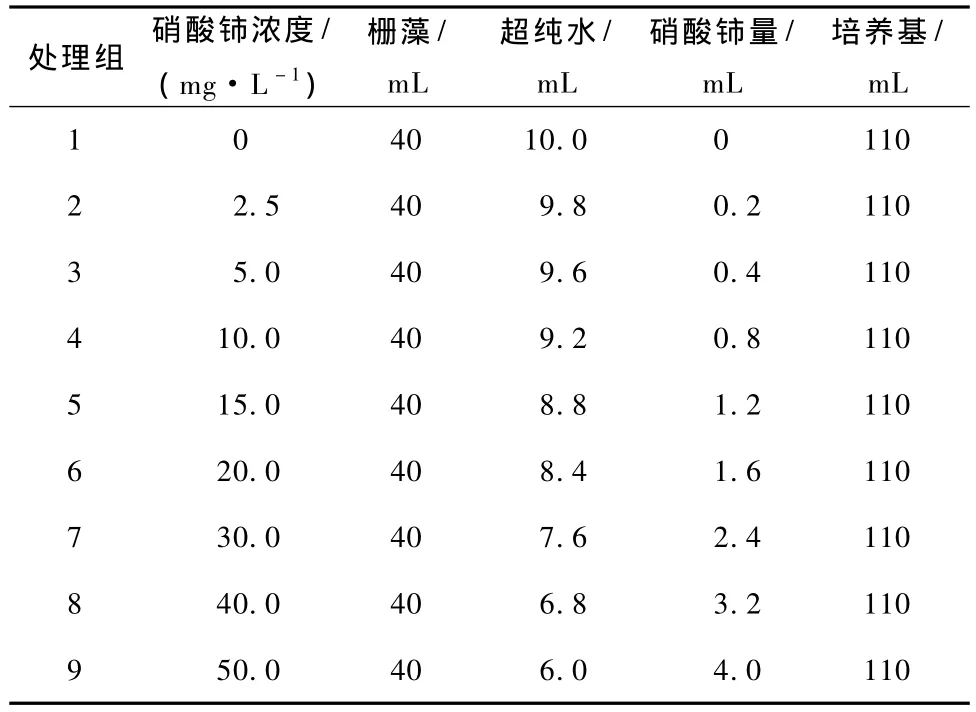
表4 栅藻的慢性实验设计
1.6 藻细胞计数
采用血球计数板在显微镜下直接计数,计算方法:藻细胞 (mL)=(N/5×25)/10-5×n。
式中:N表示5个中方格内数得藻细胞数;10-5为计数室的体积;n为藻液的稀释倍数。
1.7 绿藻急性毒性即96 h半效应浓度测定
藻生物量的测定:分别取藻原液 0,0.25,0.50,1.00,2.00,4.00,6.00,8.00 和 10.00 mL定容至10 mL,再分别测定各浓度下的藻液吸光值,并且用血球计数板对各浓度下的藻细胞进行计数,最后根据吸光度和细胞数做出生物量标准曲线。
光密度测定:取待测藻液5 mL,在波长 λ=689 nm处测其光密度。
半效应浓度:硝酸铈对淡水绿藻的毒性试验采用有毒化学品对藻类的毒性测试的标准方法[8]确定硝酸铈对淡水绿藻的96 h半效应浓度,初步试验使硝酸铈呈几何级数增加,用预实验计算出抑制淡水绿藻的96 h半效应浓度。正式试验硝酸铈浓度以初步确定的96 h EC50为中点,各向两边以等差数列形式延伸浓度并和一组对照同时进行测定[8-9]。96 h半效应浓度越大说明淡水绿藻对硝酸铈抵抗能力越强,反之则说明敏感性越大。
1.8 藻液可溶性蛋白含量的测定
可溶性蛋白质含量采用考马斯亮蓝法测定,以小牛血清蛋白作标准曲线[10]。具体测定步骤如下:已测定光密度的藻液40 mL放入离心管→12 000 r·min-1下离心30 min,倒出离心清液,将离心管倒置滴干→加入3 mL 0.05 mol·L-1pH值7.8的磷酸缓冲液,冰浴→超声波细胞破碎仪破碎30 min,镜检无完整藻细胞→定容到5 mL,离心,取上清液→595 nm处测吸光度。以 mg·g-1表示[11]。
标线制作方法:配制100 μg·mL-1标准蛋白、0.15 mol·L-1NaCl溶液及考马斯亮蓝试剂,取7只试管按表5加入各试剂后在595 nm下测定吸光度。
小牛血清蛋白标线:y=1.660 6 x+0.009 4,R2=0.990 4。
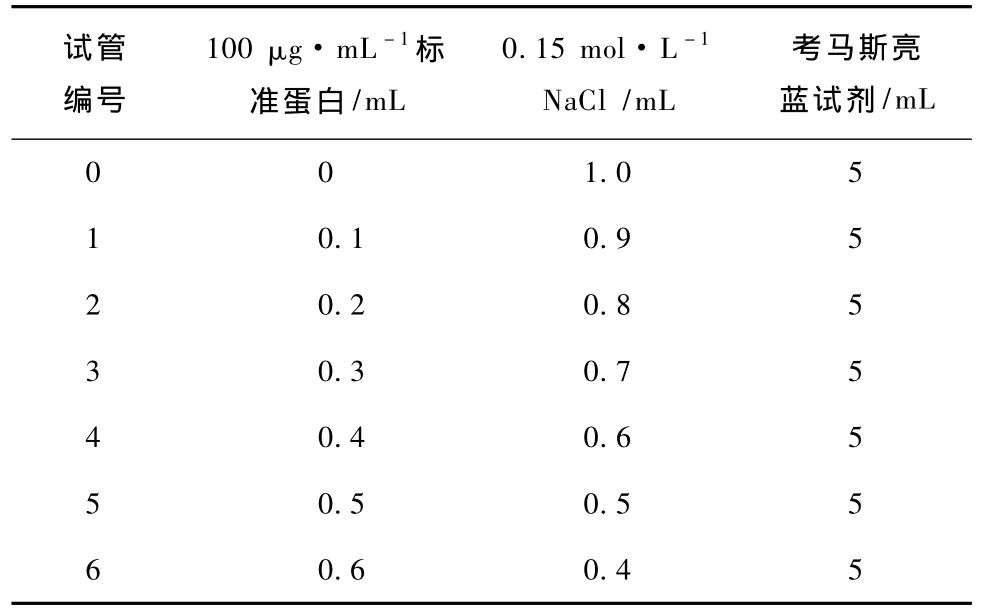
表5 小牛血清蛋白标准曲线制作方法
1.9 叶绿素含量的测定
藻液抽滤 (离心)后转入具塞刻度试管迅速转移至冰箱冷冻室-20℃冷冻过夜,取出后立即加入预热80℃的10 mL95%乙醇萃取,并在恒温水浴锅中80℃萃取2 min,紧接着在超声波细胞粉碎仪上 (冰浴)中进行浮游植物细胞粉碎 (300 W,3,5,50 s),在冰箱4℃下黑暗静置4 h后于80-2型台式离心机4 000 r·min-1离心10 min,取上清液待测[12]。
测定方法:用光径1 cm比色皿于波长665 nm和750 nm处测吸光值,然后加3滴1 mol·L-1盐酸酸化,1 min后于波长665 nm和750 nm处再测吸光值。
计算方法:c(Chl-a乙醇)=27.9×[(D665,D-D750, D)- (D665, B-D750, B )] ×V乙醇/V水样。
式中:c(Chl-a乙醇)为乙醇法测定的叶绿素a质量浓度 (μg·L-1);A665,D和 D750,D分别为乙醇萃取液酸化前于665 nm和750 nm处的吸光值;D665,B和D750,B分别为乙醇萃取液酸化后于665 nm和750 nm处的吸光值,V乙醇为乙醇萃取液的体积 (mL),V水样为离心水样的体积 (L)。
1.10 其它理化指标的测定
用溶解氧仪和pH计在培养192 h后测定相应指标。
2 结果与分析
2.1 藻细胞生物量
随着铈浓度增加,蛋白核小球藻和栅藻生物量不断增加,两者呈线性相关 (表6)。
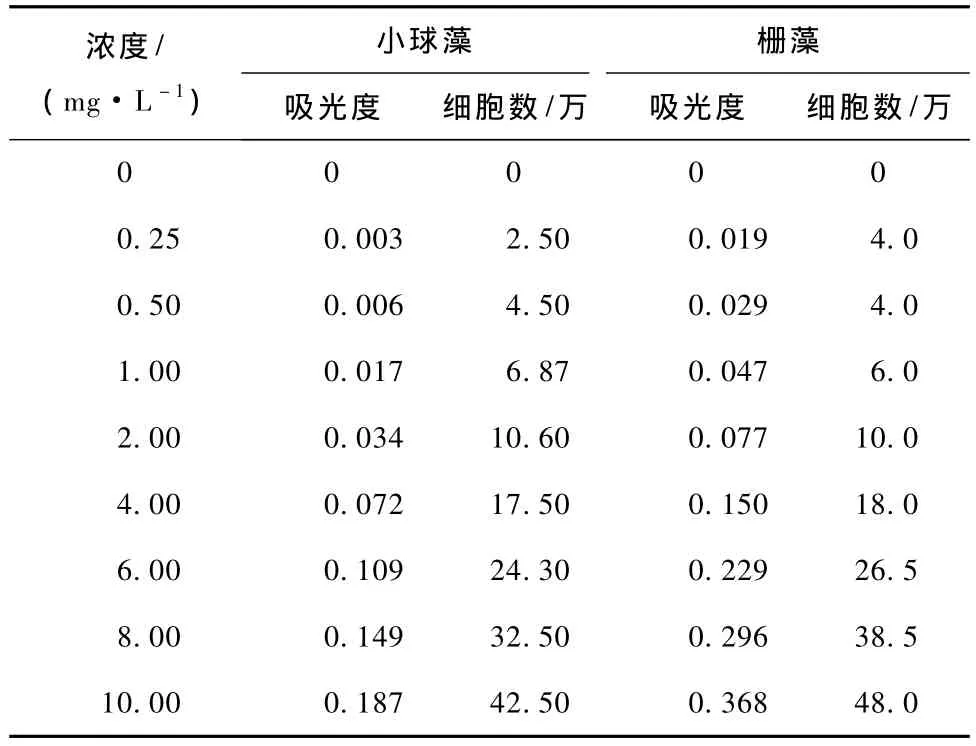
表6 蛋白核小球藻和栅藻生物量
蛋白核小球藻生物量曲线:y=210.5x+2.201,R2=0.993 3。
栅藻生物量曲线:y=126.78x+0.121 1,R2=0.994 4。
2.2 96 h半数效应浓度
对淡水绿藻进行急性毒性实验以确定半数效应浓度EC50即为50%藻生长抑制率=(空白吸光度-处理吸光度)/空白吸光度 ×100%[13]。
以蛋白核小球藻的96 h时测定的3组平行光度的平均值为 y,以硝酸铈浓度为 x,即 y=0.001 7 x+0.313 9,R2=0.316 1。可见,硝酸铈对蛋白核小球藻的毒性在0~10 mg·L-1时急剧下降,在10~20 mg·L-1时变化较缓。其96 h半数效应浓度为29.9 mg·L-1。
以栅藻的96 h时测定的3组平行光度的平均值为 y,以硝酸铈浓度为 x,即 y=0.001 5 x+0.261 4,R2=0.554 5。可见,硝酸铈对栅藻的毒性作用,在0~10 mg·L-1时毒性作用明显增强,随后趋缓,20~40 mg·L-1时作用明显。其96 h半数效应浓度为63.6 mg·L-1。
2.3 藻液可溶性蛋白含量
蛋白质含量是表征细胞状态的重要指标。本研究将细胞破碎后通过吸光度对蛋白质含量进行了测定,探究硝酸铈对藻类蛋白质含量的影响。结果(图1-2)表明,硝酸铈浓度10 mg·L-1处理后藻液的可溶性蛋白含量变化不明显。
2.4 叶绿素含量
绿藻的叶绿素含量代表其光合作用能力。在作用192 h后测其含量发现其出现明显差异,表明生物量、水体自净能力受到明显影响 (图3-4)。
从图3可见,硝酸铈浓度从0~10 mg·L-1其叶绿素含量下降迅速,尤其是在2.5~5.0 mg·L-1的毒性作用最大,其它浓度范围则变化较为平缓。图4显示,硝酸铈浓度在2.5 mg·L-1时可促进叶绿素含量的增长,2.5~5.0 mg·L-1时急剧下降,5~10 mg·L-1无明显变化,其它浓度都存在平缓下降趋势。绿藻的叶绿素含量代表其光合作用能力。高浓度的硝酸铈影响绿藻,水体的自净能力受到明显影响。
2.5 理化指标
2.5.1 pH值
Ce(NO3)3·6 H2O母液的 pH值为4.55。但加入培养基后pH值都有了不同程度的增加。

图1 蛋白核小球藻蛋白质吸光度

图2 栅藻蛋白质吸光度

图3 蛋白核小球藻叶绿素含量
从图5可见,培养基对硝酸铈有一定的缓冲作用,能使其p H值增大。但是随着浓度的增加,培养基的缓冲作用能力下降。图6表明,培养基对硝酸铈的缓冲作用并不明显。
2.5.2 溶解氧
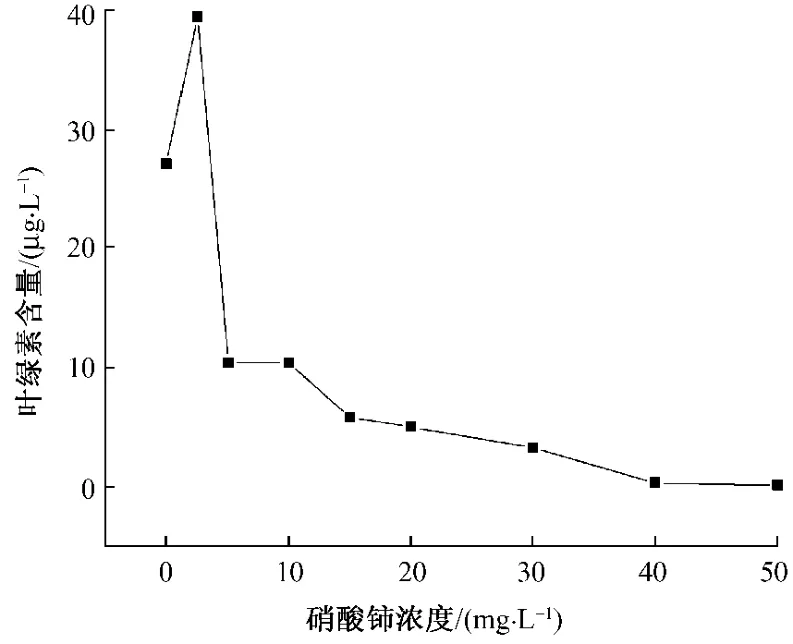
图4 栅藻叶绿素含量

图5 蛋白核小球藻的pH值

图6 栅藻的pH值
溶解氧 (DO)是水生生物生存不可缺少的条件,反映了水体自净能力。溶解氧的一个来源是水中溶解氧未饱和时,大气中的氧气向水体渗入;另一个来源是水中植物通过光合作用释放出的氧。溶解氧除了被水中硫化物、亚硝酸根、亚铁离子等还原性物质所消耗外,同时也被水中微生物的呼吸作用以及水中有机物质被好氧微生物的氧化分解所消耗。对于人类而言,健康的饮用水中溶解氧含量不得小于6 mg·L-1。氧对水中生物如鱼类的生存有着至关重要的影响,当溶解氧低于4 mg·L-1时,就会引起鱼类窒息死亡 (图7-8)。
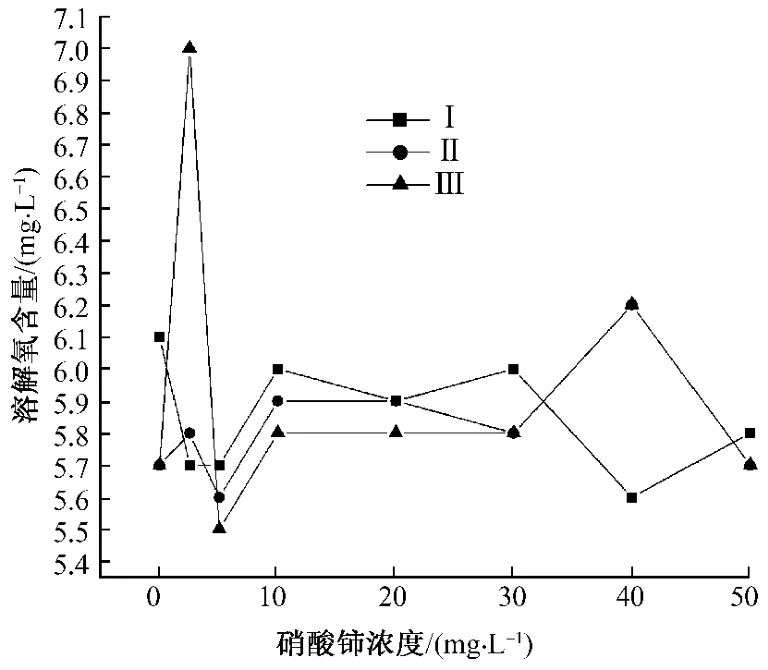
图7 蛋白核小球藻的溶解氧

图8 栅藻的溶解氧
从图7-8可见,相同浓度硝酸铈对不同藻类作用不同。但当硝酸铈浓度达10 mg·L-1以上时水体溶解氧含量在5.8 mg·L-1以下,值得关注。
3 小结
已有研究表明,稀土元素对藻类也属中、低毒性,且低浓度时反而有一定的刺激生长作用。稀土对水生藻类等水生植物生长的影响,一般取决于稀土元素种类本身,而与其化合物类型则关系不大。本次实验发现:低浓度的硝酸铈对绿藻的生长有一定的促进作用。随着浓度的增大,它的抑制作用开始显现;随着藻体生物量的变化,其叶绿素、蛋白质含量也随之增减;水体p H值有所上升。
[1] 杨凯,张雪梅.田莉瑛,等.稀土元素及其化合物在生物和医药中的应用研究进展 [J].河北化工,2008,11(31):27-27.
[2] 郭伯生.农业中的稀土 [M].北京:中国农业科技出版社,1988:1-13,45-61.
[3] 魏正贵,尹明.稀土元素在赣南非稀土矿区和不同稀土矿区土壤一铁芒萁 (Dicranopteris linearis)系统中的分布、累积和迁移 [J].生态学报,2001,21(6):900-906.
[4] 王晓蓉.稀土元素的环境化学研究现状及发展趋势 [J].环境化学,1991,10(6):73-74.
[5] Couture P,Visser S A,Van Coillie R,et al.Algal bioassays:Their significance in monitoring water quality with respect to nutrillents and toxicants[J].Schweiz Z Hydrol,1985,47:127-158.
[6] Mostafa M.Effect of atrazine herbicide on growth photosyn thesis,protein synthesis,and fatty acid composition in the unicellular green alga Chlorella kessleri[J]. Ecotoxicol Environ Safety,1994,29(3):349-358.
[7] 周永欣.水生生物毒性试验方法 [M].北京:农业出版社,1989:70-190.
[8] Rennr R.Growing concern over perfluorinated chemicals[J].Environ Sci Tech,2001,35(7):154-160.
[9] 陈海柳.六价铬抑制淡水绿藻生长对毒性效应 [J].环境科学,2003,24(2):41-51.
[10] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle oprotein dye binding [J].Analytical Biochemistry,1976,72:248-254.
[11] 欧晓明.新杀虫剂HNPC-A9908对蛋白核小球藻生理生化特性的影响 [J].农业环境科学学报,2004,23(1):154-158.
[12] 杨彩根.浮游植物叶绿素 a含量简易测定方法的比较[J].海洋科学,2007,31(1):6-8.
[13] 胡勤海,叶兆杰.稀土元素的水生生态环境效应 [J].环境污染与防治,1995,17(3):28-30.

