密蒙花总黄酮对去势雄鼠干眼症模型角膜和泪腺组织的保护作用
李怀凤 彭清华 姚小磊 王 方 陈佳文 吴权龙 李传课 李 点 朱惠安
近年来研究表明基于免疫的炎症反应是各种类型干眼症发病的共同机制,泪腺及眼表的炎症可导致泪腺及眼表上皮细胞损伤及凋亡、泪液中水样液及粘液的分泌减少。研究去势雄鼠干眼症眼表面炎症反应与干眼症病因之间的关系是研究干眼症发病机制的关键。本研究通过制作去势雄鼠干眼症模型,观察干眼症各组角膜和泪腺光镜及泪腺电镜超微组织结构的变化,为其发病机制和治疗方法提供事实依据;并通过密蒙花总黄酮对其进行干预,探讨其防治干眼症的作用机制。
1 材料与方法
1.1 实验动物与分组
健康1月龄雄性Wistar大鼠150只(中南大学湘雅医学院实验动物中心提供),体重100g左右,常规喂养。 随机分为 A1、B1、C1、D1、E1、A2、B2、C2、D2、E2、A3、B3、C3、D3、E3共 15 组,每组 10 只。 分别为:A:正常组;B:假手术对照组;C:手术对照(去势)组;D:雄激素治疗组对照;E:密蒙花总黄酮治疗组;1代表饲养1个月后;2为饲养3个月后;3为饲养5个月后。
1.2 实验动物模型制作参照有关文献〔1〕
将实验鼠切除双侧睾丸及附睾;假手术组只切开阴囊而不切除睾丸,正常组不做任何处理。
1.3 主要药品和试剂
密蒙花(产于湖南邵阳):密蒙花干药材由湖南九汇现代中药有限公司提供,其总黄酮制备由该课题组博士在湖南省植物提取工程提取中心完成 (密蒙花药材中蒙花苷含量为0.85%,提取成品中蒙花苷含量约17%,蒙花苷中总黄酮含量>80%);丙酸睾酮注射液(25mg/ml,市售):天津金耀氨基酸有限公司生产;Leica石蜡切片机:德国Leica公司生产;Hitachi h-600型透射电子显微镜:日本日立公司生产。
1.4 给药方法
各组在造模后1周,待伤口基本愈合后开始用药。雄激素治疗组丙酸睾酮注射液以1∶4麻油稀释后按0.5ml/kg大腿肌肉注射,1次/3d;密蒙花总黄酮治疗组以1%密蒙花提取物生理盐水混悬液5ml/kg灌胃,1次/天;其余3组以0.9%生理盐水5ml/kg灌胃,1 次/天。
1.5 干眼症大鼠模型的检查方法
检查均由同一人完成,每次检查时间、地点、照明亮度、湿度及温度相同。 参照有关文献〔2,3〕,各组动物分别于 1、3、5 个月后,行泪膜破裂时间(BUT)、角膜荧光素染色检查及Schirmer I试验。BUT:用玻璃棒蘸2%荧光素钠在下睑结膜囊内涂抹,使眼睑闭合荧光素均匀分布于角膜表面后,固定其上下睑使角膜充分暴露,于裂隙灯下用钴蓝光照射观察,从最后一次瞬目开始计时,记录泪膜上出现第一个破裂点的时间。角膜荧光素染色:玻璃棒蘸荧光素涂抹于下睑结膜囊,裂隙灯下观察,将角膜分为4个象限〔4〕,0 级:无染色(-),1 级:散在点状染色(+),2 级:密集型点状染色(++),3 级:片状染色(+++)。Schirmer I试验〔5〕:用 2.5mm×35mm 泪液检测滤纸条,将一端折弯5mm,置于下睑内侧1/3结膜囊内,其余部分悬垂于皮肤表面。闭眼5分钟后测量滤纸湿润长度(不包括反折)。
1.6 标本采集
1、3、5 个月后各组随机抽取10只大鼠,20%乌拉坦全身麻醉后断头法处死各组动物,即刻摘取双眼泪腺、角膜组织,4%多聚甲醛固定准备,HE染色,光镜观察各组织结构。
1.7 统计学处理
所有数据均经SPSS15.0系统软件处理。计量资料以平均数±标准差(±s)表示。若满足正态性和方差齐性,则用多因素方差分析两两比较法;不满足正态性和方差齐性时,则用非参多重比较法。以P<0.05为差异有统计学意义。
2 结果
2.1 干眼症的传统检查结果
2.1.1 角膜荧光素染色:A、B组角膜荧光素染色无明显改变;C组大鼠喂养3个月后,角膜上皮开始进行性缺损,荧光素染色呈阳性,且随时间加重;D、E组于去势治疗3、5个月后见角膜荧光素染色,染色点较C组减少(表1)。
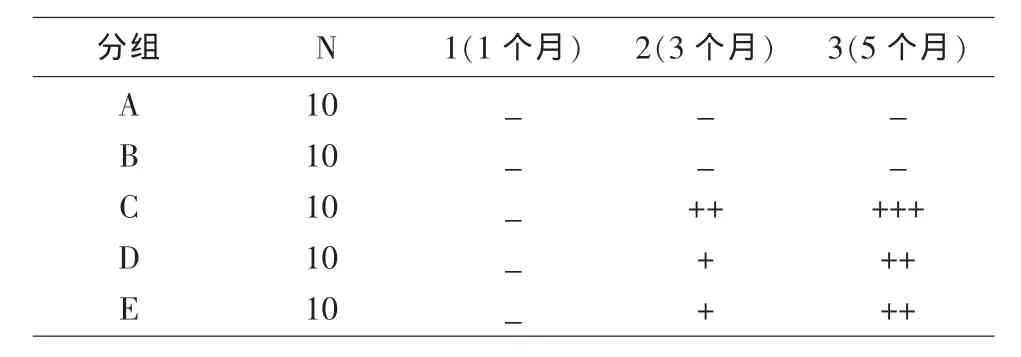
表1 各组鼠角膜荧光素染色的比较
2.1.2 Shirmer实验:同一组别不同时间段的比较:A组、B组、D组各时间段比较差异无统计学意义(P>0.05);C组3、5个月与1个月比较差异有统计学意义(P<0.01);C组 3、5个月时比较差异无统计学意义(P>0.05);E组3个月与1个月比较差异无统计学意义(P>0.05);E组5个月与1个月比较差异有统计学意义(P<0.05)。
同一时期不同组别的比较:1个月后,A、B、C、D、E 组间差异无统计学意义(P>0.05);3 个月后,A、B、C、D、E 组间差异有统计学意义(P<0.05);B、D 组与 A 组差异无统计学意义(P>0.05);A、D、E 与 C 组差异有统计学意义(P<0.05);D与E组差异无统计学意义(P>0.05);5 个月后,B、D 组与 A 组差异无统计学意义(P>0.05);D、E组与C组差异有统计学意义(P<0.01);D 组与 E 组差异有统计学意义(P<0.05,表 2)。
表2 各组鼠Shirmer实验试纸长度测定的比较(±s,mm)
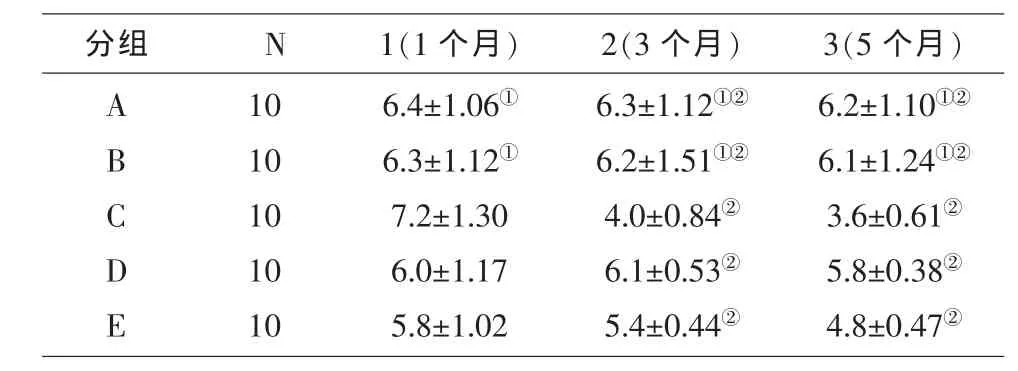
表2 各组鼠Shirmer实验试纸长度测定的比较(±s,mm)
注:采用非参多重比较法(Games-Howell)组间 F=7.982,组内F=10.949。①A组与B组比较P=0.997,②2组与3组比较P=0.47。
分组 N 1(1个月) 2(3个月) 3(5个月)A B C D E 1 0 1 0 1 0 1 0 1 0 6.4±1.0 6①6.3±1.1 2①7.2±1.3 0 6.0±1.1 7 5.8±1.0 2 6.3±1.1 2①②6.2±1.5 1①②4.0±0.8 4②6.1±0.5 3②5.4±0.4 4②6.2±1.1 0①②6.1±1.2 4①②3.6±0.6 1②5.8±0.3 8②4.8±0.4 7②
2.1.3 泪膜破裂时间(BUT):同一组别不同时间段的比较:A、B组各时间段差异无统计学意义(P>0.05);C组1个月、3个月、5个月相比差异均有统计学意义(P<0.01);D组 1、3个月比较差异无统计学意义(P>0.05),5 个月与 1、3 个月比较差异有统计学意义(P<0.05);E组 1、3及 5个月比较差异均有统计学意义(P<0.05)。
同一时期不同组别的比较:A、B组在各时间段差异均无统计学意义(P>0.05);1 个月后,A、B、C、D、E 组间差异无统计学意义(P>0.05);C2、E2与 A2组差异有统计学意义(P<0.05);3个月后,D、E 组与C组比较差异有统计学意义(P<0.05);D与E组间差异无统计学意义(P>0.05);5 个月后,C、D、E 与 A组比较差异有统计学意义(P<0.05);D、E与C组差异有统计学意义(P<0.01);D与E组差异无统计学意义(P>0.05,表 3)。
表3 各组鼠泪膜破裂时间(BUT)测定的比较(±s,秒)

表3 各组鼠泪膜破裂时间(BUT)测定的比较(±s,秒)
注:采用多因素方差分析的两两比较(LDS法)组间F=15.295,组内F=19.895。*A组与B组比较P=1。
分组 N 1(1个月) 2(3个月) 3(5个月)A B C D E 10 10 10 10 10 12.0±2.22*11.5±2.33*11.0±2.59 11.4±2.32 11.8±1.13 12.0±2.69*12.0±2.72*8.0±1.50 11.0±1.45 10.0±2.01 11.0±1.91*11.5±2.04*5.0±1.06 9.0±1.35 8.0±1.11
2.2 角膜及泪腺的光镜观察
2.2.1 正常对照组(A组):角膜:上皮层、前弹力膜、基质层、后弹力膜和内皮层清晰可见,上皮层光滑完整。基质层内见少量角膜细胞(图1)。泪腺:表面有薄层结缔组织被隔,结缔组织深入实质将腺组织分成大小不等的小叶。小叶及腺泡间可见散在的淋巴细胞、巨噬细胞及浆细胞。腺泡大小均匀,排列紧密(图 2)。
2.2.2 假手术对照组(B组):角膜和泪腺:光镜下所见基本同正常组。
2.2.3 手术模型组(C组):角膜:与正常组相比,C1组:上皮层细胞层次增加,局部扁平细胞见不规则少量脱失(图3);C2组:上皮层细胞层次增加,扁平细胞见不规则片状脱失(图4);C3组:上皮层细胞层次增加,表层扁平细胞不规则缺失,翼状细胞外露;基质层水肿增厚,其内细胞成分增多,见大量炎性细胞浸润(图5)。泪腺:与正常组泪腺相比,C1组:腺泡内分泌泡有所增多(图6);C2组:腺泡内及腺泡细胞内分泌物增多,见细胞核分裂相(图7);C3组:泪腺腺泡密集,排列规则,腺泡细胞内仍见大量分泌颗粒,腺泡间结缔组织内见细胞成分增多,见分叶核及单核细胞浸润(图8)。
2.2.4 雄激素治疗对照组(D组):角膜:与正常组相比,D1组:结构基本同正常组泪腺;D2组:上皮层细胞层次增加,局部扁平细胞见不规则少量脱失;D3组:上皮层细胞层次增加,扁平细胞见不规则片状脱失。泪腺:与正常组泪腺相比,D1组:基本同正常组泪腺;D2组:腺泡内分泌泡有所增多;D3组:腺泡内及腺泡细胞内分泌物增多,见细胞核分裂相。
2.2.5 密蒙花总黄酮治疗组(E组)
角膜和泪腺光镜与D组基本相同(图9、10)。
2.3 泪腺的透射电镜观察
正常对照组(A组)透射电镜观察:可见泪腺细胞内结构清楚,核膜完整,核仁明显,腺上皮细胞间有紧密连接,细胞内粗面内质网丰富、分泌面有大量分泌泡,细胞表面有微绒毛结构(图11)。
假手术对照组(B组)透射电镜观察:所见基本同正常组泪腺。
手术模型组(C组)透射电镜观察:C1组:所见结构基本同正常组泪腺(图12);C2组:核膜皱缩,有局灶变性坏死 (溶酶体呈黑洞状),线粒体肿胀 (图13);C3组:腺泡排列规则,每个腺泡中央见腺泡腔,腺泡细胞内上部可见大量分泌颗粒,腺泡细胞基底部见大量粗面内质网、高而基体;线粒体空泡化;腺泡细胞之间可见紧密连接;腺泡间结缔组织内见少量小静脉、毛细血管及巨噬细胞、浆细胞浸润,核膜皱缩,有局灶变性坏死(溶酶体呈黑洞状),线粒体肿胀,细胞间隙增宽,细胞边坏死状,局灶凋亡坏死,凋亡明显(核固缩,染色质边集)(图14)。
雄激素治疗对照组 (D组)透射电镜观察:D1组:空泡改变(或有类脂滴样空泡改变),细胞间隙增宽;D2组:管腔微绒毛有脱落,线粒体嵴丢失,有空泡样变,管腔有局灶性病变,线粒体肿胀,有脂滴样变,核固缩,凋亡相对明显,血管及内皮变化不大;D3组:线粒体轻肿胀,核轻肿胀,局灶水肿变性,疑核坏死,有包涵体结构。
密蒙花总黄酮治疗组(E组)透射电镜观察:E1组:线粒体肿胀,空泡变明显。E2组:内质网相对丰富,染色质边集。E3组:线粒体肿胀减轻,丢失或成空泡变(图 15)。
3 讨论
近年来多项研究结果均显示:随着年龄的增加,干眼的发病率呈明显的上升趋势,其中女性更明显〔6〕。干眼的动物模型也已经帮助我们证实了雄激素在促进泪液分泌功能方面的作用。雄激素水平的降低可通过其上的受体降低而加重干眼症患者角膜和泪腺的损害,从而加重干眼的眼表损害。
本研究以此为依据制作了去势雄鼠干眼症动物模型,手术切除雄鼠双侧睾丸,结果3个月后发现去势雄组鼠角膜荧光素染色呈点状。运用传统的检查方法对去势雄鼠的眼表情况进行检查发现,去势组雄鼠5个月后Schirmer I实验、泪膜破裂时间(BUT)明显小于正常对照组,且随观察时间延长差异有统计学意义。说明雄激素水平下降后可导致模型动物泪液分泌减少、泪膜稳定性下降、角膜表面染色,可诊断为干眼症。
本实验自大鼠造模1周后开始用药,在传统检查方面,密蒙花总黄酮治疗组3、5个月后,角膜荧光素染色明显比去势组减轻,与雄激素治疗的对照组无明显差别;SIT检查在3个月后,密蒙花总黄酮治疗组泪液浸湿滤纸长度明显长于去势组 (P<0.01),与雄激素治疗组疗效差异无统计学意义(P>0.05);5个月后,密蒙花总黄酮治疗组明显优于去势组,差异有统计学意义(P<0.05),与雄激素治疗组相比疗效稍差(P<0.05);BUT 检查在用药 3、5 个月后,密蒙花总黄酮治疗组泪膜破裂时间长于去势组,与雄激素治疗组无明显差别。
密蒙花为马钱科落叶灌木密蒙花树的花蕾,其味甘,性微寒,归肝经。有清热(泻火)养肝,明目退翳之功效。主治目赤翳障,目昏干涩等症。密蒙花提取物因其有高含量的黄酮类物质,一方面它能够与雌激素受体(ER)结合产生拟雌激素活性作用;另一方面还能间接或可能直接产生拟雄激素活性作用〔9〕。近期研究表明:密蒙花黄酮类提取物对干眼症有良好的治疗效果,其机制主要与密蒙花黄酮能够有效调节泪腺局部炎症反应和细胞凋亡有关,能改善泪腺超微结构,从而维持泪液基础分泌量〔10,11〕。
本实验,光镜观察下见密蒙花总黄酮治疗组可以减轻去势导致的角膜和泪腺炎症浸润和细胞坏死脱落,与雄激素治疗组无差别。电镜观察泪腺超微结构见泪腺细胞线粒体和内质网改变轻微,显示其对去势所致干眼症泪腺和角膜有一定的保护作用。密蒙花总黄酮在治疗去势雄鼠干眼症动物模型上有显著疗效,减轻了去势雄鼠逐渐加重的泪腺分泌功能损害,延缓了去势雄鼠泪腺超微结构等病理学改变。
总之,在去势雄鼠干眼症发病过程中,泪腺分泌功能损害,泪液量和质的改变导致泪膜稳定性下降、角膜上皮缺损,产生炎症反应,导致干眼症的发生和发展。密蒙花总黄酮在治疗去势雄鼠干眼症动物模型上有较好疗效,而且减轻了去势雄鼠逐渐加重的泪腺分泌功能和角膜上皮的损害,这可能是其治疗干眼症的关键机制之一。
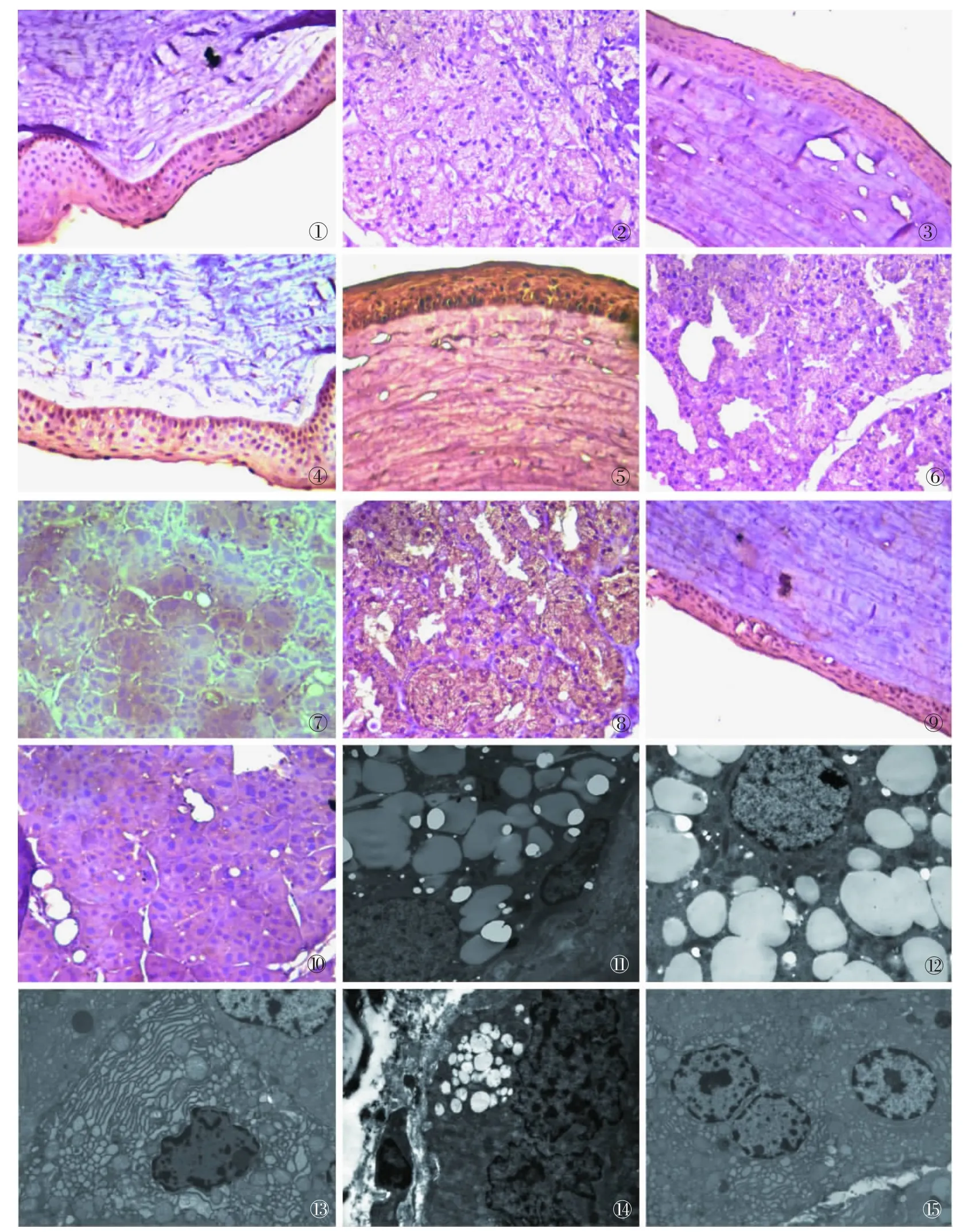
图1 正常对照组角膜HE染色×400。图2正常对照组泪腺HE染色×400。图3去势组雄鼠1个月角膜HE染色×400。图4去势组雄鼠3个月角膜HE染色×400。图5去势组雄鼠5个月角膜HE染色×400。图6去势组雄鼠1个月泪腺HE染色×400。图7去势组雄鼠3个月泪腺HE染色×400。图8去势组雄鼠5个月泪腺HE染色×400。图9密蒙花总黄酮治疗组5个月角膜HE染色×400。图10密蒙花总黄酮治疗组5个月泪腺HE染色×400。图11正常对照组泪腺透射电镜×8K。图12去势组雄鼠1个月泪腺透射电镜×12K。图13去势组雄鼠3个月泪腺透射电镜×8K。图14去势组雄鼠5个月泪腺透射电镜×8K。图15密蒙花总黄酮治疗组5个月泪腺透射电镜×8K。
1 马轶群.去势雄兔干眼症模型角膜上皮细胞凋亡及相关基因表达的研究[J].眼科研究,2004,22(3):286-289.
2 林 静.去势雌干眼症动物模型制作及发病机制的研究[C].青岛:青岛大学,2005.
3 张 梅,陈家祺,刘祖国.干眼症检查的进展[J].眼科研究,2001,19(2):184-187.
4 Macri A,Rolando M,pflugfelder S.A standardized visual scale for evluation of tear fluoresecein clearance[J].Ophthalmology,2000,107(7):1338-1343.
5 田明霞,王传富.暴露性干眼症大鼠模型角膜上皮细胞凋亡相关基因的表达[J].眼科新进展,2006,26(10):747-750.
6 Moss SE,Klein R,Klein BE.Incidence of dry eye in an older population[J].Arch Ophalmoa,2004,122(3):6 369-373.
7 Xiu Jun Song, De-Quan Li, William Farley, et a1.Neurturin-Deficient MiceDevelop Dry Eye and Keratoconjunctivitis Sicca[J].InvestigativeOphthalmologyandVisualScience,2003,44(10):4223-4229.8 AzumaM,Motegi K,Aota K,et al.Role of cytokines in the destruction of acinar structure in Sjögrn′s syndrome salivary glands[J].Lab Invest,1997,77(3):269-280.
9 姚小磊,彭清华,吴权龙,等.密蒙花提取物对去势导致干眼症白兔泪腺细胞凋亡的影响[J].中国中医眼科杂志,2007,17(3):139-144.
10 姚小磊,彭清华,吴权龙.密蒙花提取物治疗兔去势所致干眼症[J].眼视光学杂志,2008,10(1):21-26.
11 彭清华,姚小磊,吴权龙,等.密蒙花提取物对去势雄兔干眼症的预防作用[J].中华眼科杂志,2008,44(11):1011-1019.

