幽门螺杆菌感染胃癌组织中环氧合酶2的表达及其对胃癌侵袭和转移能力的影响
曹东旭,迟晶
(1.武警辽宁总队医院 消化科,沈阳 110034;2.中国医科大学 附属第一医院消化科,沈阳 110001)
胃癌是最常见的消化道恶性肿瘤,其发病率和死亡率高、预后差,而胃癌的侵袭、转移是导致不良预后的重要因素。1994年国际癌症研究机构宣布幽门螺杆菌(Helicobacter pylori,H.pylori)是人类胃癌的Ⅰ类致癌原,与胃癌的不良预后相关。研究发现环氧合酶 2(cyclooxygenase-2,COX-2)表达水平在大多数胃肠道肿瘤中明显升高,从而促进肿瘤浸润转移;抑制COX-2的表达,可抑制胃肠道肿瘤的发生和转移,但其机制不详[1]。因此,本研究分析H.pylori感染的胃癌的侵袭、转移能力,同时检测COX-2的表达情况,以探讨COX-2表达对H.pylori感染的胃癌侵袭、转移能力的影响及其机制。
1 材料与方法
1.1 材料
收集2005年9月至2007年9月中国医科大学附属第一医院经病理组织学证实的胃癌手术切除标本60例,其中乳头状腺癌15例,管状腺癌21例,低分化腺癌8例,黏液腺癌7例,未分化癌5例,印戒细胞癌3例,腺鳞癌1例;TNM分期:T1期26例,T2~T4期34例;有淋巴结转移33例,无淋巴结转移27例;高/中分化26例;低/未分化34例。所有患者术前均无非甾体抗炎药物、糖皮质激素类药、根除H.pylori药物治疗史及放、化疗等针对肿瘤的干预史。
1.2 方法
1.2.1 改良的Giemsa染色法判断胃癌组织中H.pylori的感染情况:高倍镜下以见到典型的螺旋形、S形或海鸥形,染成蓝黑色的细菌确定为H.pylori感染阳性。
1.2.2 采用链霉菌抗生物素蛋白-过氧化酶免疫组化染色法(S-P法)检测胃癌组织中COX-2的表达:兔抗人COX-2单克隆抗体(浓缩型)超敏S-P试剂盒、DAB底物显色剂,均购自福建迈新公司。COX-2单克隆抗体工作浓度1∶200。染色具体步骤:石蜡切片经脱蜡、梯度水化后,置3%的过氧化氢溶液中室温下15 min,以阻断内源性过氧化物酶的活性,置10 mmol/L的柠檬酸缓冲液(pH6.0)中,用微波处理(100℃,5 min×3次),经抗原修复,冷却至室温;滴加正常山羊血清,室温下孵育15 min,以封闭正常非特异性抗原;倾去血清,滴加按工作浓度稀释后的COX-2抗体,4℃放置过夜,PBS液浸洗3次,每次5 min。滴加生物素化二抗,37℃放置30 min,PBS液浸洗3次,每次5 min。滴加S-P复合物37℃30 min,DAB显色,苏木素复染、中性树胶封片。每次染色均采用PBS代替一抗作阴性对照。结果判定:高倍镜下计数5个视野的阳性细胞数和细胞总数,求出阳性细胞的百分比,阳性细胞数<5%为阴性,反之为阳性。
1.3 统计学分析
采用SPSS13.0软件处理数据,采用χ2检验分析H.pylori感染与患者临床病理特征及COX-2表达的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 H.pylori感染与胃癌患者临床病理特征之间的相关性
60例胃癌标本经改良的Giemsa法染色,其中36例(60.0%)存在H.pylori感染。H.pylori感染与胃癌病理分期及淋巴结转移情况有相关性,而与患者年龄、性别及组织分化程度无相关性(表1)。
2.2 H.pylori感染与COX-2表达的相关性
免疫组化结果显示,36例H.pylori感染的胃癌中,34例(94.4%)COX-2染色阳性,24例H.pylori感染阴性的胃癌中,仅9例(37.5%)COX-2染色阳性。H.pylori感染阳性和阴性的胃癌中COX-2的阳性表达率差异显著(χ2=24.326,P< 0.01)。见图1。
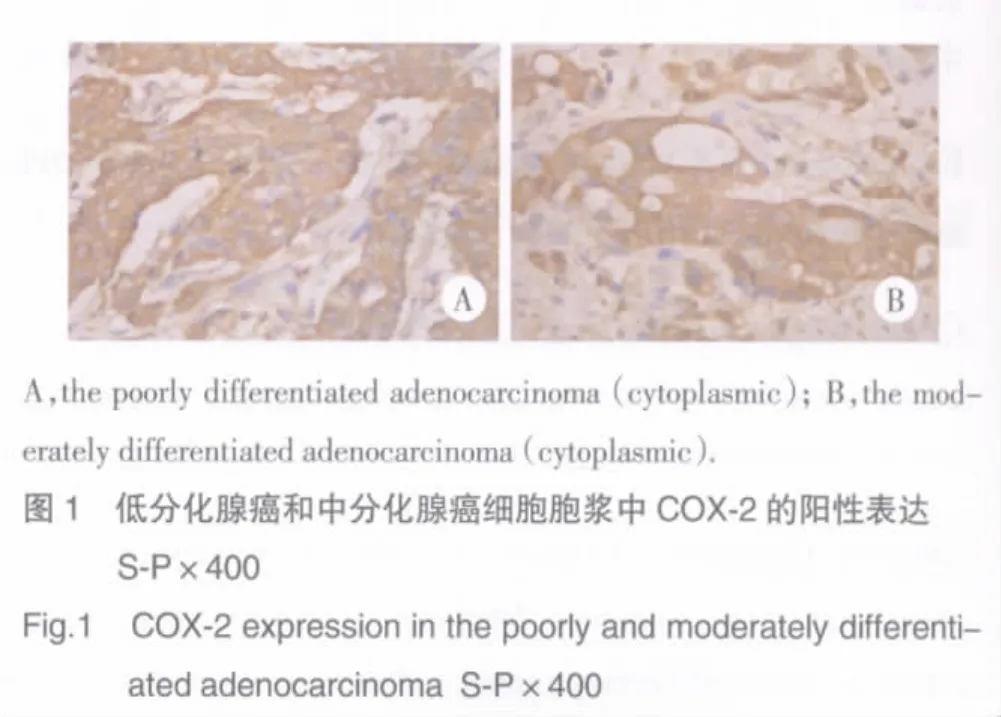
3 讨论
自1983年H.pylori被发现以来,H.pylori感染已经被认为是胃癌发病的重要原因[2,3]。胃癌是最常见的消化道恶性肿瘤,其致死率在所有癌症中高居第二位。其较高的致死率常与其较早发生局部侵袭、淋巴结转移有关。已有研究证实H.pylori能促进胃癌上皮细胞的侵袭、转移[4]。本研究采用改良的Giemsa法染色显示,H.pylori感染率为60.0%,本研究发现H.pylori感染与胃癌病理分期及淋巴结转移状况相关,而与患者年龄、性别及组织分化程度无相关性。表明H.pylori阳性的胃癌易发生转移,与以往的研究结果一致[5]。说明H.pylori感染可能促进胃癌的侵袭和转移。
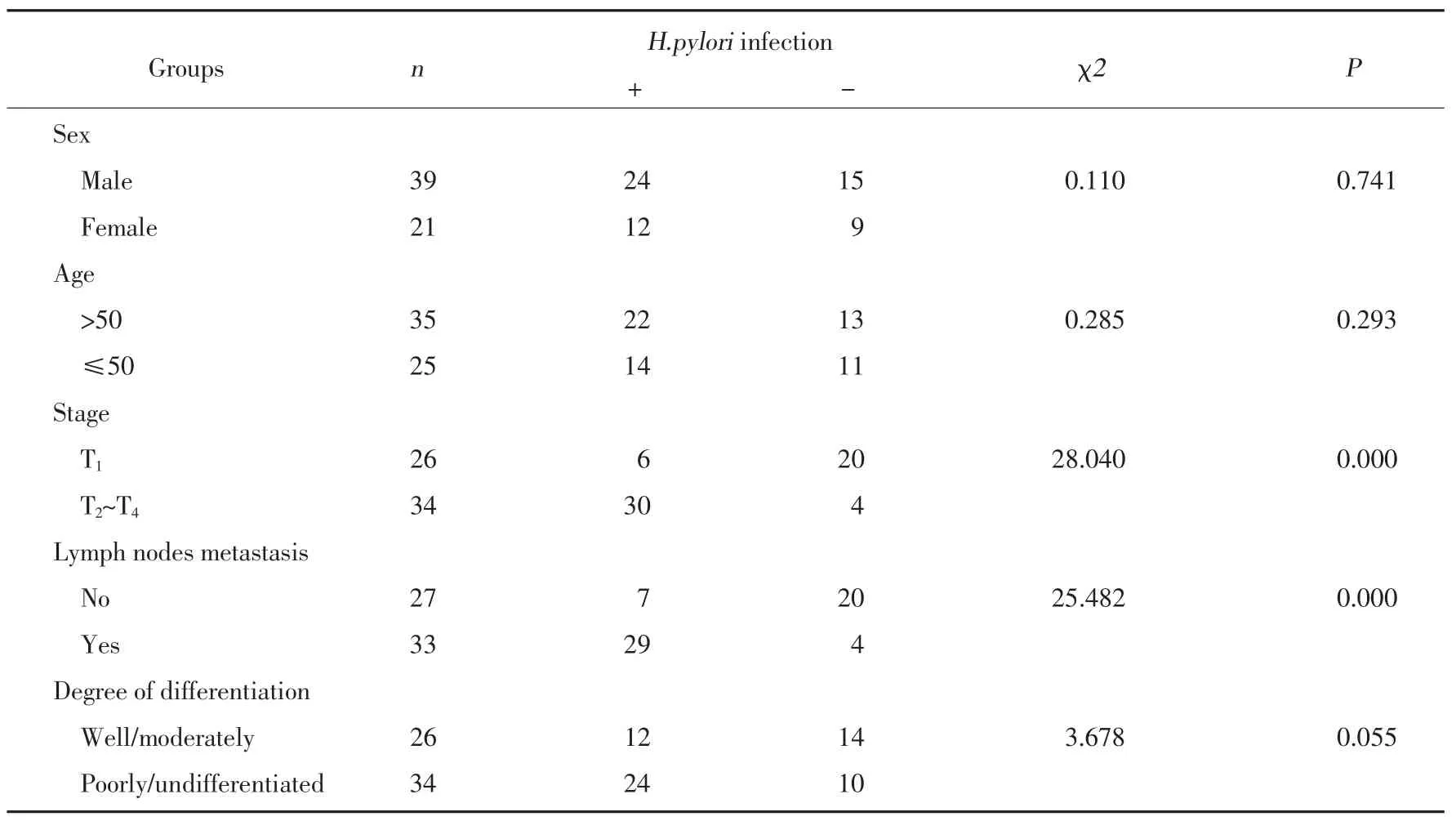
表1 H.pylori感染与胃癌患者临床病理特征之间的相关性Tab.1 The correlation between H.pylori infection and the clinicopathological features of gastric cancer
H.pylori感染促进胃癌的侵袭和转移的机制不清,可能与COX-2的高表达有关。以往Murata等[6]用Western blot检查15例胃癌组织和癌旁邻近组织中COX-2的表达,发现胃癌患者中COX-2的过度表达与癌细胞累及淋巴管和转移至淋巴结的程度密切相关,同时也和肿瘤的TNM临床分期相关。COX-2的过度表达可能会促进胃癌的淋巴结转移,提示患者的预后不佳。近年来Lee等[7]对109例胃癌进行研究,发现COX-2蛋白有过度表达,其阳性率为64.2%。Xia等[8]对61例胃癌组织进行研究亦发现H.pylori感染促进胃癌组织COX-2的表达。本研究胃癌组织中COX-2的阳性率为71.7%(43/60),与文献报道相近。本研究免疫组化染色结果显示,H.pylori感染的胃癌组织中COX-2阳性表达率为94.4%(34/36),无H.pylori感染的胃癌组织中COX-2阳性率为 37.5%(9/24),差异显著(P<0.01)。提示H.pylori感染可能促使胃癌组织COX-2高表达,从而促进胃癌侵袭转移。H.pylori感染可诱导胃黏膜上皮COX-2表达,其机制如下:(1)H.pylori感染导致胃黏膜损伤,刺激COX-2表达:H.pylori黏附于胃黏膜上皮,释放毒力因子,造成上皮细胞变性、坏死,炎细胞浸润,导致上皮损伤,已有研究证明,胃上皮损伤诱导 COX-2 表达[9];(2)H.pylori感染直接诱导COX-2表达:Kim等[10]应用水溶性蛋白及活菌刺激人中性粒细胞,发现COX-2、前列腺素2均上调,分别加用特异性COX-2抑制剂NS-398、κB核因子(nuclear factor-kappa B,NF-κB)抑制剂、细胞外信号调节激酶抑制剂后,COX-2、前列腺素2合成下降;(3)NF-κB 途径:体外实验发现 NF-κB 能诱导巨噬细胞过度表达COX-2,有研究用H.pylori刺激人的胃癌细胞,发现COX-2 mRNA和蛋白水平与NF-κB活性呈正相关,且能被 PDTA 所抑制[9],据此推测,H.pylori感染可能通过激活NF-κB,进而促进COX-2的表达,与炎症及新生物的发生有关;(4)H.pylori感染刺激生长因子和细胞因子释放,继发COX-2 表达:H.pylori感染可刺激 IL-8、TNF-α、iNOS等细胞因子的产生和表皮生长因子等生长因子的释放[11],而COX-2表达可被这些刺激因素诱导。总之,H.pylori感染诱导COX-2表达机制及其调解通路尚未十分明确,有待进一步研究。
本研究证实了H.pylori感染可能增加胃癌的侵袭转移能力,其机制可能与COX-2的表达增加有关,为临床应用COX-2的特异性抑制剂来延缓或阻止胃癌的侵袭转移提供了理论基础。
[1]Tomozawa S,Nagawa H,Tsuno N,et al.Inhibition of haematogenous metastasis of colon cancer in mice by a selective COX-2 inhibitor JTE-522[J].Br Cancer,1999,81(8):1274-1279.
[2]庄小强,郑杰,林三仁,等.胃癌中幽门螺杆菌与胃黏膜增殖及凋亡的研究[J].中国人兽共患病杂志,2005,21(9):765-768.
[3]胡品津.幽门螺杆菌研究的进展[J].胃肠病学,2005,10(1):1-2.
[4]Wu CY,Wang CJ,Tseng CC,et al.Helicobacter pylori promote gastric cancer cells invasion through a NF-kappaBand COX-2-mediated pathway[J].World JGastroenterol,2005,11(21):3197-3203.
[5]Morgner A,Miehlke S,Fischbach W,etal.Completeremission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pyloriinfection[J].Clin Oncol,2001,19(7):2041-2048.
[6]Murata H,Kawano S,Tsuji S,et al.Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma[J].Am JGastroenterol,1999,94(2):451-455.
[7]Lee TL,Leung WK,Lau JY,et al.Inverse association between cyclooxygenase-2 overexpression and microsatelliteinstability in gastric cancer[J].Cancer Lett,2001,168(2):133-140.
[8]Xiao WM,Ding YB,Shi RH,et al.Correlation of Helicobacter pylori infection with the expression of COX-2 and EGFRand VEGF in human gastric carcinoma[J].Zhonghua Zhong Liu Za Zhi,2008,30(9):668-671.
[9]Sun WH,Tsuji S,Tsujii M,et al.Cyclooxygenase-2 inhibitors suppress epithelial cell kinetics and delay gastric wound healing in rats[J].Gastroenterol Hepatol,2000,15(7):752-761.
[10]Kim JS,Kim JM,Jung HC,et al.Expression of cyclooxygenase-2 in human neutrophils activated by Helicobacter pylori water-soluble proteins:possible involvement of NF-kappaB and MAPkinase signalingpathway[J].Dig Dis Sci,2001,46(10):2277-2284.
[11]Sasayama Y,Kawano S,Tsuji S,et al.Relationship between interleukin-8 levels and myeloperoxidase activity in human gastric mucosa[J].Gastroenterol Hepatol,1997,12(2):104-108.

