同型半胱氨酸诱导的ERK调节作用与上皮生长因子受体的间接激活
杨军,万里姝,彭亮,任艳
(中国医科大学 附属第一医院神经内科,沈阳 110001)
同型半胱氨酸(homocysteine,Hcy)是蛋氨酸的代谢产物。严重的高同型半胱氨酸血症患者可存在神经系统表现异常。近年来,Hcy的神经毒性越来越引起了人们的重视。研究表明,Hcy水平的升高可能与Alzheimer病相关[1],也有人认为高同型半胱氨酸血症可能是老年认知障碍的一个早期标志[2,3]。Hcy引起神经元损伤的机制目前尚不完全清楚,可能与兴奋谷氨酸受体,引起氧化反应,DNA修复功能损害[4]有关。
研究发现,在大鼠胚胎皮层神经元等多种细胞及半胱氨酸β合成酶缺陷大鼠海马切片的同型半胱氨酸毒性试验中都发现有激活的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)存在[5],提示Hcy可能诱导了ERK激活,但其具体机制目前尚不清楚。本研究利用原代培养的CD-1小鼠小脑颗粒神经元,检测了Hcy诱导下的ERK1/2磷酸化,并观察了神经细胞ERK上皮生长因子受体(epidermal growth factor receptor,EGFR)特异性抑制剂AG1478能否对其产生抑制,探讨了Hcy与EGFR间接激活信号传导途径之间的关系。
1 材料与方法
1.1 材料
7 d龄CD-1小鼠,体质量约3.6 g,雌雄不限,由中国医科大学临床药理教研室提供。AG1478(Cal-Biochem,美国),抗 ERK、P-ERK 特异性抗体、羊抗鼠 IgGHRP 二抗(Santa Cruz,美国),L-Hcy、碘化丙锭、DMEM、阿糖胞苷(Sigma,美国)。
1.2 方法
1.2.1 小鼠小脑颗粒神经元原代培养:将小鼠置于75℅乙醇中,断颈后取出脑组织,置于含10%胎牛血清的DMEM培养液中,在解剖显微镜下剥离出小脑,用无 Ca2+、Mg2+的 Hank′s液洗涤 2 次,切碎成糊状,加入0.002%胰蛋白酶,37℃、5%CO2培养箱内孵育2 min,弃上清,加入含10%胎牛血清的DMEM培养液1 500 r/min离心后弃上清,加入DMEM培养液4℃下混匀后过滤,将滤得的细胞加入事先铺以多聚赖氨酸的平皿中,37℃、5%CO2培养箱内孵育15 min,待小脑颗粒神经元细胞贴壁后,弃上清,加入含10%胎牛血清的DMEM 1.5 ml。置37℃、5%CO2培养箱内孵育24 h。加入阿糖胞苷(40μmol/L),置37℃、5%CO2培养箱内培养并每日观察。
1.2.2 分组:将培养7 d的小脑颗粒神经元的培养液换成无血清培养液后,随机分为4组:(1)生理盐水对照组:加入生理盐水培养20 min;(2)AG1478对照组:加入 AG1478(1 mmol/L)培养 20 min;(3)Hcy处理组:加入 Hcy(0.1 mmol/L)培养 20 min;(4)AG1478+Hcy处理组:先加入 AG1478(1 mmol/L)预处理15 min后,再加入Hcy(0.1 mmol/L)培养20 min。
1.2.3 Western blot:收集各组细胞,提取蛋白,Bradford方法进行蛋白定量。取50 mg蛋白行SDS-PAGE电泳,转至硝酸纤维素膜,5%脱脂奶粉封闭1 h。加入抗p-ERK或ERK一抗于室温中孵育2 h。PBS洗膜4次。加入羊抗鼠(p-ERK)IgGHRP二抗孵育。ECL显色成像。用Window AlPhaEase TMFC 32-bit分析软件进行色带灰度分析。实验重复4次,所得结果取均值。
将原代培养7 d的小脑颗粒神经元置于含有Hcy 0.1 mmol/L的无血清培养液中,37℃孵育10、20、40、60 min,采用 Western blot法测定 ERK 磷酸化情况并绘制时间曲线。
1.2.4 流式细胞仪分析细胞凋亡率:各组细胞药物处理6 h后,将细胞轻轻吹起,1 500 r/min离心后收集细胞。PBS冲洗,再次1 500 r/min离心,弃上清,加入75%乙醇保存过夜。1 500 r/min离心,弃上清,PBS冲洗,1 500 r/min离心后弃上清,加入碘化丙锭(10 mg/ml),37℃孵箱内孵育30 min,流式细胞仪(BD公司,美国)检测细胞凋亡率。实验重复4次,结果取均值。
1.3 统计学分析
采用SPSS12.0软件进行统计学分析。计量资料数据用x±s表示。多组资料用One-Way ANOVA方法进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 Hcy引起小鼠小脑颗粒神经元ERK磷酸化(图1)

Western blot结果显示,Hcy能够引起小鼠小脑颗粒神经元ERK磷酸化,且在Hcy处理20 min时,ERK1/2磷酸化最明显。
2.2 EGFR特异性拮抗剂AG1478可阻断Hcy诱导的ERK1/2磷酸化反应(图2)
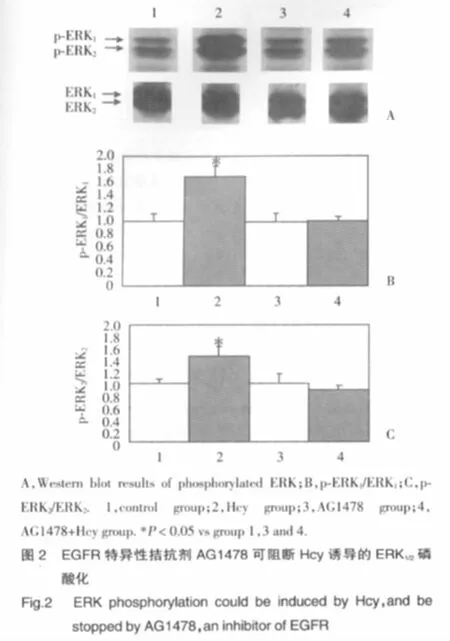

Western blot结果显示,与生理盐水对照组和AG1478对照组相比,Hcy处理组小鼠小脑颗粒神经元中磷酸化的ERK1/2明显增加(P<0.05),而经过AG1478预处理15 min后再加入Hcy的AG1478+Hcy处理组则未见统计学差异。
2.3 AG1478可促进Hcy诱导的小鼠小脑颗粒神经元凋亡
在培养7 d的小鼠小脑颗粒神经元中加入Hcy 6 h后,通过流式细胞仪可以检测到明显的细胞凋亡;AG1478+Hcy处理组当加入AG1478行预处理15 min后再加入Hcy 6 h时所检测到的细胞凋亡率明显高于单纯Hcy处理组(P<0.05);生理盐水对照组和AG1478对照组则未见明显细胞凋亡(图3)。
3 讨论
研究表明α2A-肾上腺激动剂主要通过两种途径引起ERK磷酸化[6]:一种是直接导致ERK磷酸化;另一种是通过两步间接激活:(1)Gi蛋白通过酪氨酸激酶激活β、γ亚基,导致金属蛋白酶促进上皮生长因子(epidermal growth factor,EGF)膜外部份脱落;(2)释放的EGF间接激活自身和相邻的EGFR,形成Grb2-Sos1复合物,导致ERK磷酸化。不同类型细胞不同G蛋白耦联受体均存在间接激活途径,最具代表性的是EGFR的间接激活途径。1997年首次证实G蛋白耦联受体激动剂能够诱导ERK的活性,而EGFR特异性拮抗剂AG1478能够抑制其活性[7]。这是细胞对外界刺激调节自身功能的一种新颖的方式。
Hcy与EGFR间接激活的相关性目前尚不清楚。有研究证明,Hcy可以引起ERK1/2的磷酸化,且Hcy可作用于谷氨酸受体引起神经细胞兴奋性毒性。本研究结果发现,EGFR特异性拮抗剂AG1478可以阻断原代培养的小鼠小脑颗粒神经元内Hcy激活的ERK1/2信号传导途径,从而证明了Hcy通过激活EGFR最终导致ERK1/2磷酸化。
ERK1/2的间接激活对于胶质细胞及其周围神经元的功能有重要作用。α2A-肾上腺激动剂激活星形胶质细胞β、γ亚基,导致金属蛋白酶促进HB-EGF膜外部份脱落,进而间接激活自身及相邻细胞如神经元上的EGFR,从而激活ERK磷酸化,这一过程被认为与细胞保护作用有关[8]。上皮生长因子广泛存在于脑内的神经元及星形胶质细胞内,具有促进星形胶质细胞和干细胞的增生、神经形成[9]以及促进有丝分裂神经元的生存和分化的功能[10]。
一般认为,EGFR的间接激活具有神经保护作用,但关于Hcy引起的ERK1/2磷酸化是否具有神经保护作用,目前尚无定论。Robert等[11]在半胱氨酸β合成酶缺陷大鼠海马切片同型半胱氨酸毒性试验中未发现ERK1/2磷酸化能减少海马神经元的凋亡,Pei等[12]则认为Hcy的谷氨酸兴奋性毒性与凋亡无关。本研究通过流式细胞仪检测发现,在培养7 d的小鼠小脑颗粒神经元中加入Hcy 6 h后,通过流式细胞仪可以检测到明显的细胞凋亡;而当加入AG1478行预处理15 min后再加入Hcy 6 h时所检测到的细胞凋亡率明显高于单纯Hcy处理组(P<0.05),提示ERK1/2磷酸化可能具有潜在的神经保护作用。
[1]Seshadri S,Beiser A,Selhub J,et al.Plasma homocysteine as a risk factor for dementiaand Alzheimer′sdisease[J].NEngl JMed,2002,346(7):476-483.
[2]Allen RH,Stabler SP,Lindenbaum J.Relevance of vitamins,homocystein and other metabolitesin neuropsychiatric disorders[J].Eur J Pediatr,1998,157(Suppl):122-126.
[3]Lehmann M,Gottfries CG,Regland B.Identification of cognitive impairment in the elderly:homocysteineis an early marker[J].Dement Geriatr Cogn Disord,1999,10(1):12-20.
[4]Kruman II,Carsten C,Chan SL,et al.Homocysteine elicits a DNA damage response in neurons that promotes apoptosis and hypersensitivity toexcitoxicity[J].JNeurosci,2000,20(18):6920-6926.
[5]Ho PI,Ashline D,Dhitavat S,et al.Folate deprivation induces neurodegeneration:roles of oxidative stress and increased homocysteine[J].Neurobiol Dis,2003,14(1):32-42.
[6]Choe ES,Wang JQ,Group I.Metabotropic glutamate receptors control phosphorylation of CREB,Elk-1 and ERK via a CaMKIIdependent pathway in rat striatum[J].Neurosci Lett,2001,313(3):129-132.
[7]Roberson ED,English JD,Adams JP,etal.Themitogen-activated protein kinase cascade couples PKA and PKC to cAMP response element binding protein phosphorylation in area CA1 of hippocampus[J].JNeurosci,1999,19(11):4337-4348.
[8]Brunet A,Datta SR,Greenberg ME.Transcription-dependent and independent control of neuronal survival by the PI13K-Akt signal pathway[J].Curr OPin Neurobiol,2001,11(3):297-305.
[9]Jin K,Mao XO,Sun Y,et al.Heparine-binding epidermal growth factor-likegrowth factor:hypoxia-inducibleexpression in vitroand stimulationofneurogenesisinvitroandinvivo[J].JNeurosci,2002,22(13):5365-5373.
[10]Kornblum HI,Zurcher SD,Werb Z,et al.Multipletrophic actionsof heparin-binding epidermal growth factor(HB-EGF)in the central nervoussystem[J].Eur JNeurosci,1999,11(9):3236-3246.
[11]Robert K,Pagès C,Ledru A,et al.Regulation of extracellular signalregulated kinasebyhomocysteineinhippocampus[J].Neuroscience,2005,133(4):925-935.
[12]Ho PI,Ortiz D,Rogers E,et al.Multiple aspects of homocysteine neurotoxicity:glutamate excitotoxicity,kinase hyperactivation and DNA damage[J].JNeurosci Res,2002,70(5):694-702.

