新生大鼠心房肌细胞的培养与鉴定
府晓丹,于波,李阳,孟亮,姜振环,杨滢
(中国医科大学 附属第一医院心内科,沈阳 110001)
病态窦房结综合征所致的心动过缓是临床上常见的心律失常之一,目前心动过缓的研究多靠动物模型来完成,但具有一定局限性,直接研究细胞膜离子通道中电流变化对心房肌细胞自律性的影响最为可靠。本研究旨在探索原代心房肌细胞体外培养的方法,为进一步深入研究心动过缓与心房肌细胞的离子通道之间的关系奠定基础。
1 材料与方法
1.1 材料
动物:1~3 d的SD大鼠20只,雌雄不限,由中国医科大学动物中心提供。
主要试剂和仪器:DMEM高糖培养基、胎牛血清、D-hank液(Hyclone公司),胰酶、Ⅱ型胶原酶(Sigma公司),兔抗肌钙蛋白I多抗(Santa Cruz公司),FITC标记山羊抗兔IgG(中杉公司),HERAcell 150 CO2孵箱(德国Heraeus公司),Olympus CX41倒置显微镜(日本OLYMPUS公司),Grant Ols200恒温振荡水浴锅(英国Grant公司),Sorvall Super T21冷冻高速离心机(美国Thermo Scientific公司)。
1.2 方法
1.2.1 心房肌细胞的分离培养:SD大鼠呈仰卧位固定,消毒胸部皮肤,沿胸骨右缘剪开,迅速取出心脏并置于D-hank液清洗、去血,剪除心室,留心房部分组织,无菌条件下用眼科剪将心房剪成0.5~1 mm3大小的组织块。在组织块中加入0.06%胰酶,37℃水浴8 min,随后吹打、自然沉淀后去除上清液;再加入0.08%Ⅱ型胶原酶,37℃水浴10 min,吹打后自然沉淀,留取上清液,加入含15%小牛血清的DMEM中止消化。重复加入0.08%Ⅱ型胶原酶的消化步骤2~3次。用200目金属滤网过滤每次收集的上清液,将过滤后的细胞悬液离心(1 000 rmp,4℃,5 min)。向离心后的沉淀中加入DMEM高糖培养液(含10%胎牛血清和1%青链霉素双抗),接种于培养瓶并置培养箱(5%CO2)中37℃培养1 h后,上清液转移到另一个培养瓶再培养1 h后再换新瓶,用2次差速贴壁法去除成纤维细胞。24 h后换液,并用倒置显微镜观察。
1.2.2 细胞片标本制备及免疫细胞化学染色:待细胞长好后,用4%多聚甲醛固定15 min做免疫荧光。取待用细胞片PBS洗3次,每次5 min。以5%BSA室温封闭1 h,一抗兔抗大鼠肌钙蛋白Ⅰ4℃过夜,PBS洗3次,每次5 min。加二抗山羊抗兔IgG-FITC,室温1.5 h,PBS洗3次,复染细胞核,荧光显微镜下观察并摄片。
2 结果
2.1 心房肌细胞的培养及鉴定
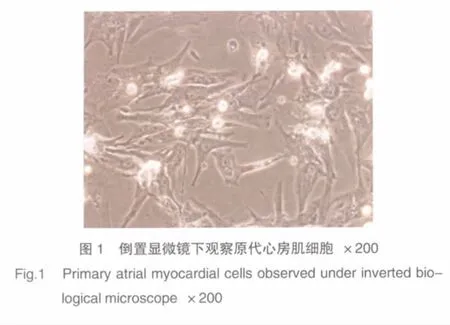
培养至第3天,倒置显微镜下观察见培养的心房肌细胞有多种形态,以杆状、梭形、三角形与不规则形为主(图1),细胞生长密度可以达到瓶底70%左右。多数细胞在贴壁后24~48 h开始出现规律搏动。
2.2 心房肌细胞的免疫荧光染色鉴定
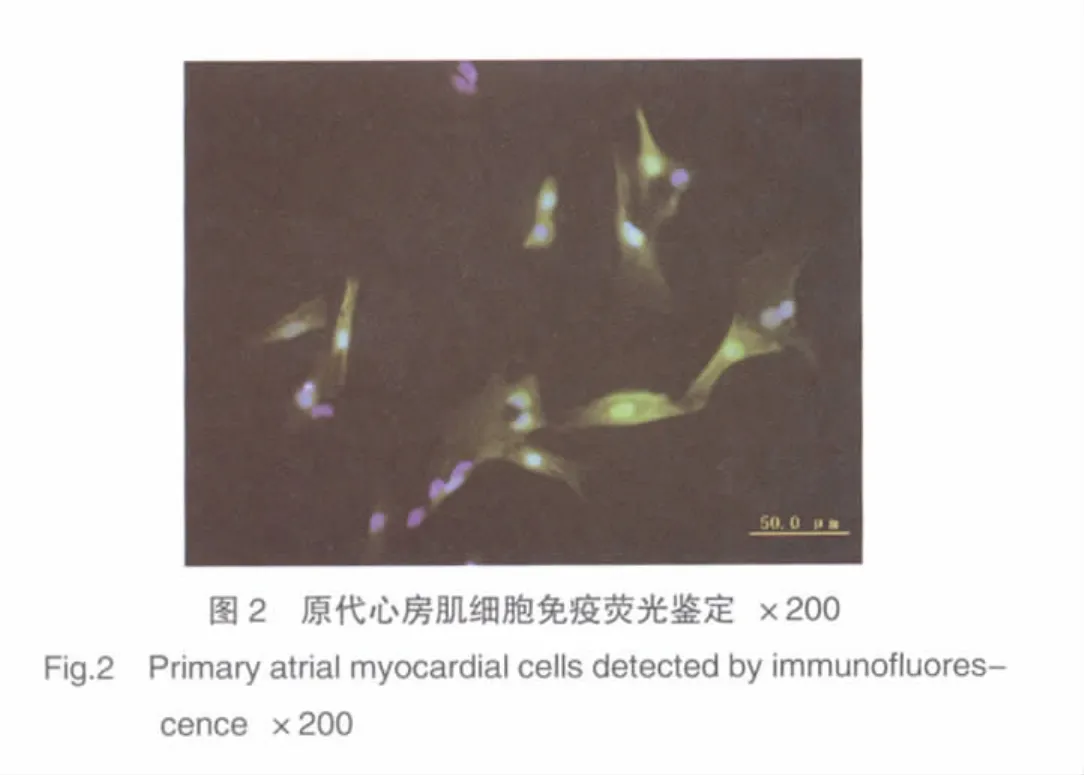
经免疫细胞荧光鉴定所培养细胞为心房肌细胞(图2),且90%以上细胞肌钙蛋白Ⅰ染色阳性。
3 讨论
研究细胞膜离子通道改变与心动过缓的关系主要将原代培养的心肌细胞作为体外模型,由于受到取材困难、细胞数量少以及分离技术等限制,目前对新生大鼠原代心房肌细胞的培养报道较少。本研究参考Benardeau等[1]的原代心房肌细胞培养方法并加以改良。利用消化法成功培养出新生大鼠心房肌细胞,经纯化、鉴定,可以满足下一步分子生物学实验要求。实践中总结以下几点。
3.1 新生大鼠鼠龄的选择
新生大鼠在出生后3 d内具有部分增殖能力,成年大鼠心肌细胞则为终末分化细胞,不再具有分裂增殖的能力。因此,大鼠出生时间越短,其心肌细胞分离成活率越高,越容易贴壁生长[2]。但是大量实验证实,若选择胎龄过小的胎鼠,其心肌细胞对于酶的反复消化耐受较差,故应选择出生后48~72 h的胎鼠心肌细胞培养效果最佳。
3.2 消化方法的改进
单用胰酶或者将胰酶与胶原酶在同一体系中进行消化,其时间不好掌握,易消化过度导致细胞释放DNA,与胶原混在一起形成黏液絮状样物质,使细胞上清液难以分离和离心,并且因细胞量大大减少而影响细胞提取率。而且单用胶原酶成本较高。故本研究采用低浓度胰酶消化1次后再用胶原酶消化,可减少胰酶和胶原酶的用量,缩短消化时间,降低细胞受损程度,从而提高细胞存活率高。
3.3 心房肌细胞的纯化
原代培养的心房肌细胞中最主要的干扰细胞为成纤维细胞,大量成纤维细胞的存在不仅限制心肌细胞的活动,而且其分泌物也影响心肌细胞的形态结构和生理功能[3]。应用差速贴壁分离法去除非心肌细胞,其原理是根据心肌细胞和成纤维细胞在培养器皿表面贴壁生长的速度不同而进行分离。在1 h时,绝大多数的成纤维细胞贴壁而心肌细胞尚未贴壁,这种方法操作简便、对细胞影响小,按此方法进行分离纯化,可得到纯度达95%的心肌细胞[4]。心肌细胞的纯化方法还有化学试剂抑制法,即利用特定的化学物质(主要是5溴脱氧尿苷)抑制组织生长活跃的成纤维细胞增殖,但有报道认为其对心肌细胞有损伤[2,5]。故本研究采取2次差速贴壁1 h分离法,不损伤细胞的同时也提高了心肌细胞的纯化度。
综上,利用低浓度酶消化法原代培养的新生大鼠心房肌细胞为研究细胞膜离子通道改变对心动过缓的影响奠定了基础。
[1]Benardeau A,Hatem SN,Rucker-Martin C,et a1.Primary culture of human atrial myocytesis associated with the appearanceof structural and functional characteristicsof immaturemyocardium[J].JMol CelI Cardiol,1997,29(5):1307.
[2]王志勇,周立,郭义威,等.乳鼠心肌细胞的培养改进[J].医学信息内外科版,2009,3(22):240-241.
[3]Miragoli M,Gaudesius G,Rohr S.Electrotonic modulation of cardiac impulseconductionbymyofibroblasts[J].Circ Res,2006,98(6):801-810.
[4]汪长华.心肌细胞的培养及注意事项[J].中国心脏起搏与心电生理杂志,2003,17(3):230-232.
[5]Simpson P,Savion S.Differentiation of rat myocytes in single cell cultureswithandwithoutproliferatingnonmyocardialcells[J].Circ Res,1982,50:101-106.

