罗格列酮对肺纤维化大鼠肺动脉壁结缔组织生长因子表达的影响*
崔茂香,陈晓玲△,陈 超,胡晓杰,金 辉
(1.河北医科大学基础医学研究所病理生理研究室,2.药学院药理研究室,3.临床学院实验中心,石家庄 050017)
肺纤维化是以细胞外基质进行性过度沉积为主要特征的肺间质疾病。对于肺纤维化迄今尚无理想的治疗方法。肺源性心力衰竭是肺纤维化致死性的并发症之一。已公认肺血管结构重塑导致不可逆转的肺动脉高压,最终引起肺源性心力衰竭。结缔组织生长因子(connective tissue growth factor,CTGF)是一种富含半胱氨酸的多肽。离体实验结果已显示,CTGF是导致动脉壁结构重塑的主要细胞因子[1]。我们以往的研究结果已显示,在博莱霉素(bleomycin,BLM)诱导的肺纤维化初期,肺动脉压已明显升高,并伴有肺动脉壁内皮和平滑肌层CTGF上调,肺动脉壁Ⅰ、Ⅲ型胶原含量增多[2]。因此,有效地阻止肺纤维化所致的肺动脉壁CTGF上调对于预防肺源性心力衰竭具有重要意义。罗格列酮(rosiglitiazone,RSG)是过氧化物酶体增殖活化受体γ(peroxisome proliferator-actived receptor-gamma,PPAR-γ)的激动剂。有文献报道,血管壁有PPAR-γ的表达[3]。还有文献报道,激活的 PPAR-γ通过阻断Smad3/Smad4而抑制转化生长因子诱导的人主动脉血管平滑肌细胞CTGF启动子活性[4]。另有研究发现,RSG对血管紧张素Ⅱ诱导的胸主动脉血管平滑肌细胞CTGF的上调有抑制作用[5]。RSG对继发于肺纤维化的肺动脉壁CTGF的上调有何影响,迄今尚未见文献报道。为此,本研究通过观察PPAR-γ激动剂RSG对BLM诱导的肺纤维化初期大鼠肺动脉壁CTGF上调、Ⅰ型、Ⅲ型胶原沉积的影响,探讨PPAR-γ激动剂RSG对此种类型肺动脉结构重塑的影响及其机制,为PPAR-γ激动剂RSG在预防肺纤维化并发症方面的应用提供实验资料。
1 材料与方法
1.1 材料
清洁级雄性SD大鼠(180~210)g,由河北省实验动物中心提供。博莱霉素A5系天津太河制药有限公司产品。天狼星红(Sigma)。兔抗鼠CTGF第一抗体(Santa Cruz),生物素化二抗IgG(羊抗兔)和辣根酶标记链霉卵白素工作液以及辣根过氧化酶标记的羊抗兔IgG为中杉生物有限公司产品。ECL化学发光试剂盒为Pierce公司产品。JEDA-801D形态学图像分析系统(江苏捷达科技发展公司)。偏振光显微镜(日本,Olympus)。
1.2 动物模型的复制、动物分组和实验设计
将48只雄性大鼠随机分为两部分:一部分大鼠(n=30)用于复制肺纤维化模型即向大鼠气管内一次性滴入BLM(5 mg/kg bw;另一部分大鼠(n=18)为模型对照即向大鼠气管内一次性滴入与BLM等体积的生理盐水(normal saline,NS)[2]。将上述大鼠分为四组:BLM+NS组(n=21)、BLM+RSG组(n=9)、NS+NS组(n=9)和NS+RSG 组(n=9)。BLM+NS组和BLM+RSG组是在气管滴注BLM后第1 d起分别灌胃给予NS(2 ml/d,14 d)或RSG(3mg/(kg◦d),14 d);NS+NS组和NS+RSG组是在气管滴注NS后第1天起分别灌胃给予NS(2 ml/d,14 d)或RSG(3 mg/(kg◦d),14 d)。各组大鼠分别于气管滴注后第14天检测。每组有6只大鼠的肺动脉分别用于免疫组织化学染色检测CTGF免疫阳性细胞和苦味酸天狼星红染色检测Ⅰ、Ⅲ型胶原;3只大鼠的肺动脉用于CTGF的Western blott分析。此外,BLM+NS组另有12只大鼠的肺动脉被进行体外孵育处理,分为RSG孵育组(DMEM中含RSG 10mmol/L,37℃,5%CO2,24h)和孵育对照组(DMEM培养液 ,37℃,5%CO2,24h),孵育后经常规固定后行CTGF的免疫组织化学染色和Ⅰ、Ⅲ型胶原的天狼星红染色。
1.3 肺动脉壁CTGF蛋白的检测
1.3.1 免疫组织化学法检测肺动脉壁CTGF蛋白含量 用免疫组化染色显示CTGF免疫阳性细胞。肺动脉壁经4%多聚甲醛固定、常规逐级脱水、透明、石蜡包埋后切片。切片经常规脱蜡至水,3%过氧化氢处理,微波炉内修复,10%羊血清工作液封闭,兔抗 CTGF抗体,4℃过夜,充分冲洗,生物素化二抗IgG(羊抗兔),37℃孵育30min,冲洗,辣根酶标记链霉卵白素工作液,37℃孵育30min,清洗,DAB显色,苏木精复染。以PBS代替一抗做阴性对照。常规梯度脱水、透明、中性树胶封片。每只大鼠取3张肺动脉切片,每张切片随机选取肺动脉不同部位的5个视野,用图像分析仪进行图像分析,测定肺动脉管壁CTGF蛋白的相对含量(用平均光密度以及CTGF阳性面积占结构面积百分比值来表示)。
1.3.2 Western blot检测肺动脉壁CTGF蛋白含量常规提取肺组织蛋白。考马斯亮蓝G250试剂盒测定蛋白浓度。10%SDS-聚丙烯酰胺凝胶分离蛋白后,用水浴式电转移法将目的蛋白转移至硝酸纤维膜上。丽春红S染色,鉴定转膜效果。5%脱脂奶粉封闭后,免疫染色。第一抗体为兔抗大鼠多克隆CTGF抗体(1∶500稀释);第二抗体为辣根过氧化酶标记的羊抗兔IgG。ECL化学发光法检测。以兔抗大鼠β-actin多克隆抗体为内对照。应用凝胶图像分析系统(Gel-Pro Analyzer Version 3.0)进行相对定量,以CTGF蛋白谱带与β-actin蛋白谱带积分光密度(Integrated optical density,IOD)的比值表示。
1.4 肺血管壁Ⅰ、Ⅲ型胶原的检测和观察
用天狼星红组化染色显示Ⅰ、Ⅲ型胶原纤维。肺组织和肺动脉经4%多聚甲醛固定、脱水、透明、石蜡包埋后切片。常规脱蜡至水,0.1%的饱和苦味酸天狼星红溶液染色,常规冲洗、乙醇脱水,二甲苯透明,中性树胶封片。在偏振光显微镜下Ⅰ型胶原呈桔黄色或黄色;Ⅲ型胶原呈绿色。每只大鼠取3张肺动脉切片,每张切片随机选取肺动脉不同部位的5个视野,用图像分析仪,进行图像分析,测定肺动脉管壁Ⅰ型、Ⅲ型胶原相对含量(用阳性面积占结构总面积百分比值来表示)。
1.5 统计学分析
2 结果
2.1 整体水平RSG对模型大鼠肺动脉壁CTGF含量的影响
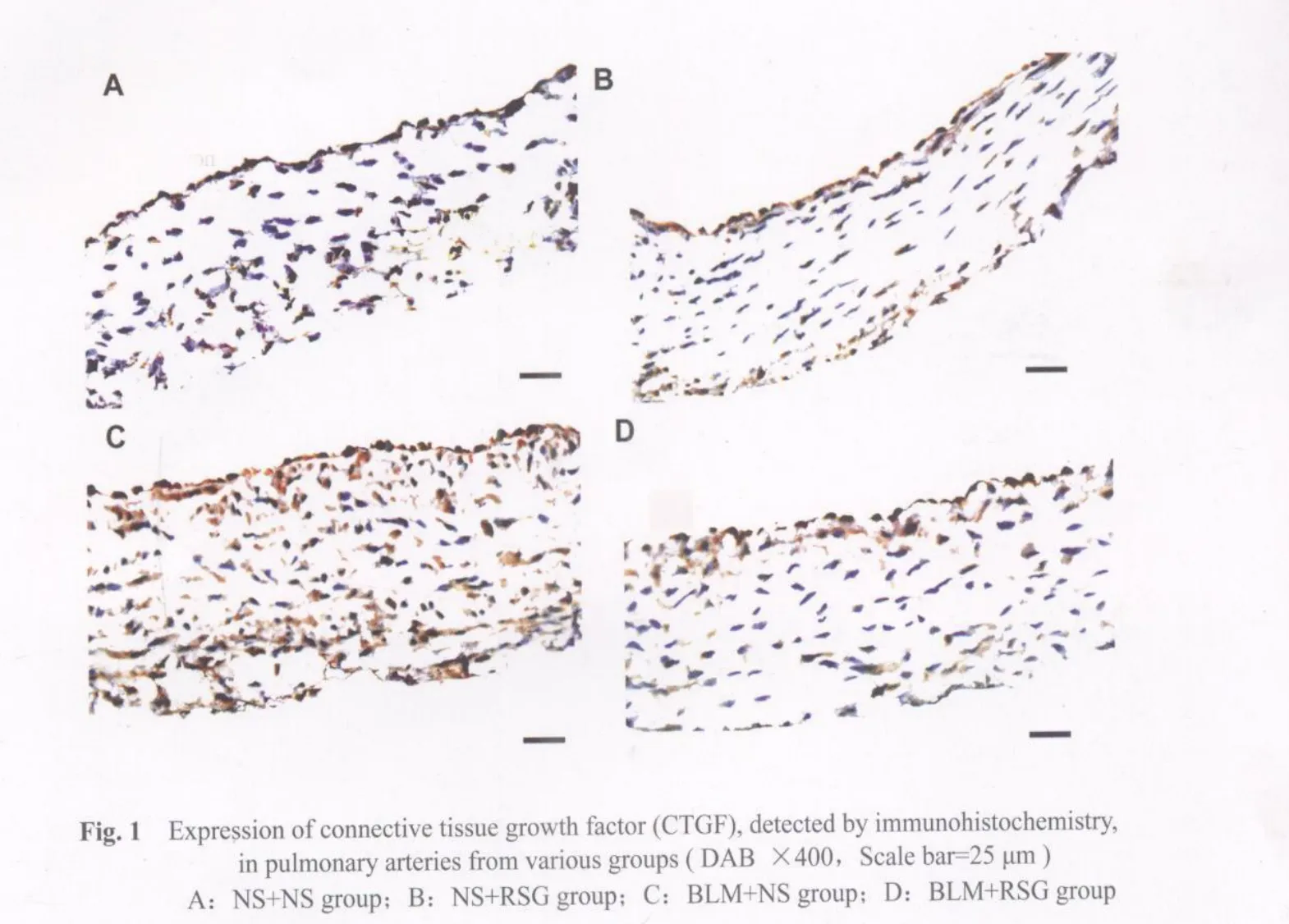
免疫组织化学染色显示:NS+NS组大鼠肺动脉壁各层均有少量CTGF免疫阳性表达的细胞。NS+RSG组大鼠肺动脉壁CTGF表达量与NS+NS组相比,其差异无统计学意义(P>0.05)。BLM+NS组大鼠肺动脉壁CTGF表达明显强于NS+NS组(阳性信号的平均光密度:(0.41±0.02)vs(0.32±0.03),P<0.05;阳性面积:8.8%±1.2%vs 1.4%±0.4%,P<0.01),提示肺纤维化模型大鼠肺动脉壁CTGF上调。与BLM+NS组比,BLM+RSG组大鼠肺动脉壁CTGF表达明显减弱(阳性信号的平均光密度:(0.33±0.04)vs(0.41±0.02),P<0.05;阳性面积:1.2%±0.5%vs 8.8%±1.2%,P<0.01),并与NS+RSG组之间的差异无统计学意义(P>0.05),提示RSG有阻止BLM模型大鼠肺动脉壁CTGF上调的作用(图1见彩图页Ⅳ)。
Western blot分析结果显示的各组肺动脉壁CTGF含量的变化规律与免疫组织化学染色结果一致(图2)。
2.2 整体水平RSG对模型大鼠肺动脉壁Ⅰ、Ⅲ型胶原含量的影响
苦味酸天狼星红染色是显示I型和III型胶原的特殊染色。在偏振光显微镜下可见:NS+NS组和NS+RSG组大鼠肺动脉平滑肌层有少量I型和III型胶原。此两组大鼠肺动脉壁平滑肌层I型、III型胶原含量及I型/III型胶原比值之间的差异均无统计学意义(P>0.05),这提示RSG对正常肺动脉壁I型和III型胶原含量无明显影响。与NS+NS组比,BLM+NS组肺动脉壁I型和III型胶原含量均明显增多(P<0.05),I型/III型胶原比值明显升高(P<0.05),这提示模型大鼠肺动脉壁I型和III型胶原增多,且以I型胶原增多为主。与BLM+NS组相比,BLM+RSG组肺动脉壁 I型、III型胶原含量和I型/III型胶原比值均减低(P<0.05),这提示RSG能有效地阻止肺纤维化模型大鼠肺动脉壁胶原的异常沉积(图3见下页)。
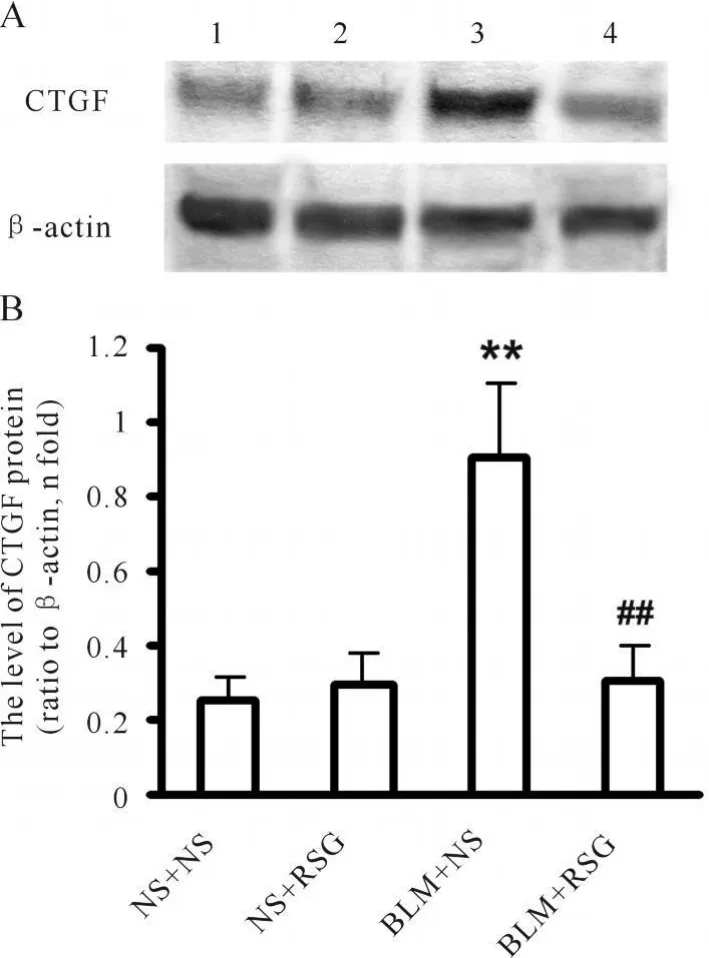
Fig.2 Changes of content of connective tissue growth factor(CTGF),detected by Western blot,in pulmonary arteries from various groups(n=3)
2.3 离体水平RSG对模型大鼠肺动脉壁CTGF含量的影响
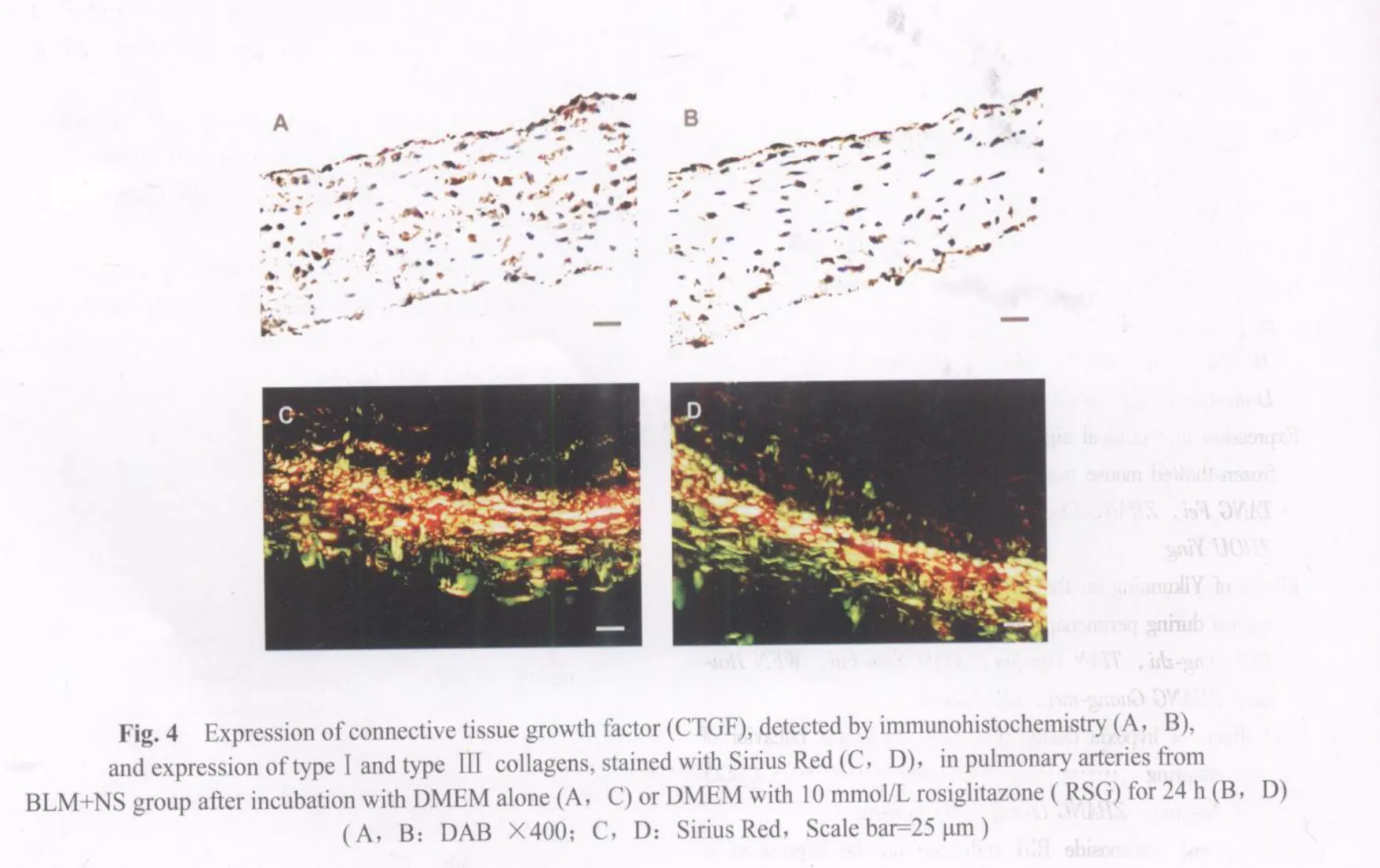
BLM+NS组大鼠肺动脉经RSG(DMEM培养液中含RSG 10μmmol/L)孵育24h后,其肺动脉壁CTGF免疫表达明显低于单纯DMEM培养液孵育的肺动脉壁(平均光密度:0.30±0.01 vs 0.36±0.02,P>0.05;阳性面积:1.78%±0.26%vs 5.16%±1.14%,P>0.05),提示RSG能直接作用于肺动脉壁阻止CTGF的上调(图4见彩图页Ⅳ)。
2.4 离体水平RSG对模型大鼠肺动脉壁Ⅰ、Ⅲ型胶原含量的影响
BLM+NS组大鼠肺动脉经RSG(DMEM培养液中含RSG 10μmmol/L)孵育24h后,其肺动脉壁I型和III型胶原含量(I型胶原染色面积7.4%±0.5%;III型胶原染色面积2.3%±0.3%)与单纯DMEM培养液孵育的肺动脉壁(I型胶原染色面积7.7%±1.8%;III型胶原染色面积2.1%±0.4%)之间的差异无统计学意义(图4见彩图页Ⅳ)。
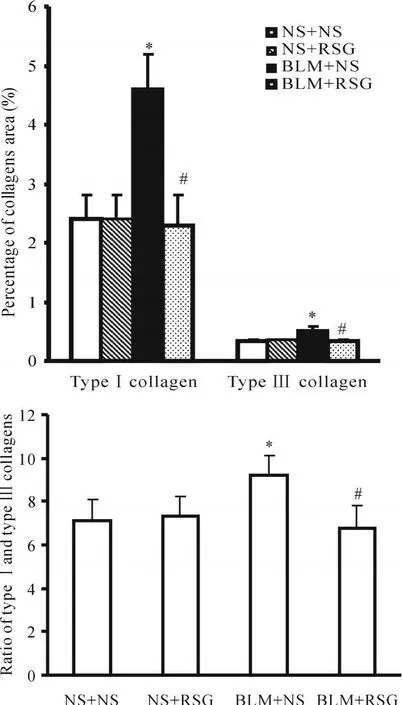
Fig.3 Effects of rosiglitazone(RSG)on the area of typeⅠcollagen and typeⅢcollagen(A)and the ratio of typeⅠcollagen and type Ⅲ collagen(B),detected by Sirius Red stain,in pulmonary arteries from various groups
3 讨论
本研究结果显示,PPAR-γ激动剂RSG能有效地阻止BLM诱导的肺纤维化初期大鼠肺动脉壁CTGF的异常增多以及肺动脉壁Ⅰ型、Ⅲ型胶原的沉积。此结果国内外尚未见报道。动脉壁胶原的沉积是动脉壁结构重塑的主要表现之一。因此,本研究结果预示,PPAR-γ激动剂RSG在防治肺纤维化初期肺动脉结构重塑方面有很好的应用前景。
已公认,动脉壁结构重塑时的胶原沉积主要表现为Ⅰ型和Ⅲ型胶原的增多以及Ⅰ型/Ⅲ型胶原比例的增加。Ⅰ型胶原纤维粗大,与血管壁的抗张性有关;Ⅲ型胶原纤细,与血管壁延伸性有关。Ⅰ型/Ⅲ型胶原比例的增加,预示动脉壁顺应性的降低。动脉壁的这种病理改变使动脉高压由可逆转向不可逆转的方向发展。本研究整体水平的结果显示,RSG能防止肺纤维化初期肺动脉壁Ⅰ型胶原和Ⅲ型胶原增多以及Ⅰ型/Ⅲ型胶原比值增高。这提示,RSG能通过防止肺纤维化初期肺动脉壁结构重塑,来阻止肺动脉壁僵硬度的增加,进而阻止肺动脉高压的发展。
CTGF是一种富含半胱氨酸的多肽。离体实验结果已显示,CTGF促进人胸主动脉平滑肌细胞合成和分泌Ⅰ型和Ⅲ型胶原纤维[6]。PPAR-γ是配体依赖性的核转录因子。RSG是PPAR-γ的激动剂(配体)。PPAR-γ被RSG激活后与视黄酸X受体形成异二聚体,并与靶基因启动子上的PPAR反应元件结合,调节靶基因的表达。已有文献报道,激活的PPAR-γ能阻止转化生长因子-β和血管紧张素Ⅱ诱导的血管平滑肌细胞CTGF的表达[4,5]。但激活的PPAR-γ对继发于肺纤维化的肺动脉平滑肌CTGF上调的影响,目前国内外尚未见报道。本研究结果发现,在整体和离体孵育的条件下,RSG都能有效地降低肺动脉壁CTGF的异常增多。虽然RSG阻止模型大鼠肺动脉壁CTGF上调的机制尚待进一步研究,但本研究结果足以提示,PPAR-γ的激动剂RSG能直接作用于肺动脉,阻止肺动脉壁CTGF的上调。由此认为,RSG阻止肺动脉壁CTGF的上调是其防治肺动脉结构重塑的机制之一。
Crossno JT等学者[7]的研究发现,RSG能阻止慢性缺氧大鼠肺动脉壁的增厚,微小动脉肌化以及胶原纤维的沉积。我们以往的研究已验证,在气管滴注BLM第14天,大鼠肺内主要呈现亚急性或慢性肺泡炎以及肺纤维化初期的病理表现[8,9]。严重的肺换气功能障碍可导致缺氧。本研究在整体水平观察到的RSG对肺纤维化初期肺动脉壁Ⅰ型、Ⅲ型胶原增多的防治作用,与RSG对上述慢性缺氧大鼠肺动脉壁的作用是一致的。值得一提的是,本研究结果显示,在离体孵育条件下RSG对肺动脉壁Ⅰ型、Ⅲ型胶原的异常增多无明显影响,而RSG能阻止肺动脉壁CTGF的上调。这提示,RSG可能通过抑制肺动脉壁CTGF的上调而间接阻止肺动脉壁胶原纤维沉积。上述研究结果完善了对PPAR-γ在肺纤维化形成初期肺动脉壁结构重塑中作用机制的认识,并为PPAR-γ激动剂RSG在防治继发于肺纤维化的肺动脉壁结构重塑方面的应用提供实验证据。
综上,PPAR-γ激活剂 RSG能直接作用于肺动脉壁,阻止肺纤维化大鼠肺动脉壁CTGF的上调,这可能是其减轻动脉壁结构重塑的机制之一。RSG在防治继发于肺纤维化的肺动脉结构重塑方面具有较好的临床应用前景。
[1]FanW H,PechM,Karnovsky M J.Connective tissue growth factor(CTGF)stimulates vascular smooth muscle cell growth andmigration in vitro[J].Eur J Cell Biol,2000,79(12):915-923.
[2]崔茂香,陈晓玲,霍春玲,等.结缔组织生长因子在肺纤维化初期肺动脉中的表达[J].生理学报,2008,60(4):535-540.
[3]Law R E,Goetze S,Xi X P,et al.Expression and function of PPAR-γin rat and human vascular smooth muscle cells[J].Circulation,2000,101(11):1311-1318.
[4]FuM,Zhang J,Zhu X,et al.Peroxisome proliferator-activated receptor gamma inhibits transforming growth factor betainduced connective tissue growth factor expression in human aortic smoothmuscle cells by interfering with Smad3[J].J Biol Chem,2001,276(49):45888-45894.
[5]Gao D F,Niu X L,Hao G H,et al.Rosiglitazone inhibitsangiotensin II-induced CTGF expression in vascular smooth muscle cells-role of PPAR-gamma in vascular fibrosis[J].Biochem Pharmacol,2007,73(2):185-197.
[6]Wang X,LeMaire S A,Chen L,et al.Increased collagen deposition and elevated expression of connective tissue growth factor in human thoracic aortic dissection[J].Circulation,2006,114(1Suppl):I200-205.
[7]Crossno J T Jr,Garat C V,Reusch J E,et al.Rosiglitazone attenuates hypoxia-induced pulmonary arterial remodeling[J].Am J Physiol Lung Cell Mol Physiol,2007,292(4):L885-897.
[8]Chen X L,Li W B,Zhou A M,et al.Role of endogenous peroxynitrite in pulmonary injury and fibrosis induced by bleomycin A5 in rats[J].Acta Pharmacol Sin,2003,24(7):697-702.
[9]Chen X L,Huang S S,Li W B,et al.Inhibitory effect of aminoguanidine on bleomycin-induced pulmonary toxicity in rat[J].Acta Pharmacol Sin,2001,22(8):711-715.

