低氧诱导因子-1α在低氧促成肌细胞增殖中的作用*
王 凡,朱玲玲,陈晓萍,刘国树,范 明△
(1.解放军总医院南楼心血管二科,北京 100853;2.军事医学科学院基础医学研究所,北京 100850)
骨骼肌成肌细胞(skeletal myoblasts,SkMs)具有自我更新和分化形成肌纤维的能力[1]。既往诱导SkMs体外增殖的研究多集中在细胞因子领域,如肝细胞生长因子、碱性成纤维生长因子、胰岛素样生长因子等。自2001年Csete等报道了6%O2可以促进SkMs体外增殖[2],物理因素对SkMs体外增殖的影响逐渐受到人们的关注。低氧诱导因子-1α(hypoxia inducing factor-1α,HIF-1α)是一个转录调节因子,活化的HIF-1α与其靶基因上的低氧反应元件结合,形成转录起始复合物,启动靶基因的转录,这些靶基因编码的蛋白质参与了细胞的代谢、增殖、凋亡等诸多功能。本工作观察了低氧(3、10%O2)对小鼠SkMs增殖的影响并探讨了HIF-1α在低氧促SkMs增殖中的作用。
1 材料与方法
1.1 试剂与仪器
胎牛血清(FBS):德国Biochem AG公司;Desmin抗体 、鼠抗HIF-1α抗体:美国 Chemicon 公司;羊抗 βactin内参抗体:美国SantnCruze公司;辣根过氧化物酶标记二抗、ECL显色试剂盒:美国Vector公司;Trizol试剂盒、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)原液:美国Gibico公司;氯仿、异丙醇、乙醇为北京北化精细化学品有限公司;MgCl2、M-MLV逆转录试剂盒:美国 Life Technologies公司;Taq聚合酶、RNasin、PCR Master:美国 Promega公司;DL-2000DNA Ladder:大连宝生物公司。琼脂糖凝胶:上海YITO公司;核胞浆蛋白提取试剂盒:普利莱基因技术有限公司;蛋白定量试剂盒:美国Sigma公司。
低氧温箱:美国Forma Scientific公司;流式细胞仪:FACSCalibur型,美国Becton Dickinson公司;PE-480PCR扩GC710图象分析仪增仪、凝胶电泳系统、电泳槽Mini-ProteanII、电泳转移仪Power-Pac 200:美国Bio-RAD公司;台式冷冻离心机:德国Hettich公司。
1.2 SkMs分离、培养与鉴定
取4~5周龄Wistar雄性大鼠麻醉,无菌切取后腿肌群,用D-Hank's液反复冲洗并充分剪碎后,用连续差速贴壁法分离培养SkMs[3]。将分离纯化的SkMs接种在培养皿中,用 SkMs特异性标记物-Desmin免疫细胞化学染色鉴定并在显微镜下观察、拍照。
1.3 低氧对SkMs增殖的影响
将分离纯化的SkMs按一定密度接种在培养皿中,分别在常氧、3%O2和10%O2的环境培养3 d后,用Desmin免疫细胞化学染色,在显微镜下观察并计数。
1.4 低氧对SkMs细胞周期的影响
将分离纯化的SkMs按一定密度接种在培养皿中,将细胞随机分为两组:常氧组(20%O2)和低氧组(10%O2),培养 12 h、24h、36 h 时 ,将两组细胞分别消化分散离心,用70%冰乙醇-20℃固定24h,洗涤温育后加入5 mg/100ml溴化乙锭染色,流式细胞仪检测并分析结果。
1.5 RT-PCR方法检测 SkMs HIF-1α mRNA表达
将分离纯化的SkMs按一定密度接种在培养皿中,将细胞随机分为两组:常氧组(20%O2)和低氧组(10%O2),培养 2 h 、4h 、8 h 、12 h 、16h 、24h 、36 h 、48 h、72 h时用Trizol试剂盒抽提低氧组和常氧对照组细胞总RNA;用反转录体系反转录为cDNA;在一定反应条件下用HIF-1α引物进行PCR扩增。HIF-1αcDNA引物由北京奥科生物技术有限责任公司合成。HIF-1α引物序列为:5-ATC AGC CAG CAA GTC CTT CT-3 ,5-TGC CTT AGC AGT GGT CGT T-3,扩增长度518 bp。以18s cDNA引物序列作为内参照,其序列为:5-TTA TGG TTC CTT TGG TCG CT-3;5-ATG TGG TAG CCG TTT CTC AG-3;扩增长度为355 bp。引物扩增条件为:94℃5 min,94℃45 s,61℃45 s,72℃45 s,25个循环,72℃延伸5 min。PCR 产物在1.2%琼脂糖凝胶上电泳,用UVP凝胶图像成像系统扫描定性并摄像电泳条带的灰度,以确定扩增物的相对量。
1.6 Western blot方法检测SkMs HIF-1α总蛋白水平
将分离纯化的SkMs按一定密度接种在培养皿中,将细胞随机分为两组:常氧组(20%O2)和低氧组(10%O2),培养2 h、4h、8 h 、12 h 、24h 、48 h 时用细胞刮刀收集低氧组和常氧组细胞,按核胞浆蛋白提取试剂盒提出细胞总蛋白,用Western-blot方法检测蛋白,特异性的反应条带通过ECL化学发光系统显色,X光胶片曝光、洗片、拍照。
1.7 Western blot方法检测SkMs胞浆和胞核HIF-1α蛋白水平
将分离纯化的SkMs按一定密度接种在培养皿中,将细胞随机分为两组:常氧组(20%O2)和低氧组(10%O2),培养48 h收集细胞,按核胞浆蛋白提取试剂盒方法分别提取SkMs胞浆和胞核蛋白,蛋白浓度测量和检测操作步骤同1.6。
1.8 统计学处理
采用SPSS 11.0统计软件分析,所有数据用均数±标准差()表示。两样本均数比较采用 t检验。
2 结果
2.1 低氧促大鼠SkMs体外增殖
在常氧(20%O2)和低氧(3%,10%O2)环境中培养3 d后,Desmin阳性的平均细胞数分别为416±10,633±32和 1043±67,经过 3%和 10%低氧处理,SkMs的数目分别是常氧组的1.5和2.5倍,该结果表明:低氧能够明显促进SkMs增殖(图1,P<0.05),10%的低氧环境更有利于SkMs的增殖。

Fig.1 Effect of hypoxia on the proliferation of skeletal myoblasts(SkMs)
2.2 低氧对大鼠SkMs周期的影响
为了明确低氧促进SkMs数量增加主要来源于细胞增殖,而不是凋亡细胞数目增加,我们用流式细胞仪测定了SkMs的周期分布,发现在12 h时低氧(10%O2)组细胞59.96%处于S期,而常氧(20%O2)组细胞有39.56%处于S期,其余处于G0/G1期,用增殖指数(proliferative index,PI)公式PI(%)=(S%+G2/M%)/(G0/G1%+S%+G2/M%)×100%计算出各组的增殖指数,结果表明12 h时低氧组细胞增殖指数高于常氧组(P<0.05),24h后两组细胞增殖指数无明显差异(表1)。流式结果还显示各组均没有明显细胞凋亡。细胞周期分析结果见表1。
Tab.1 Effect of hypoxia on cell cycle(,n=4)
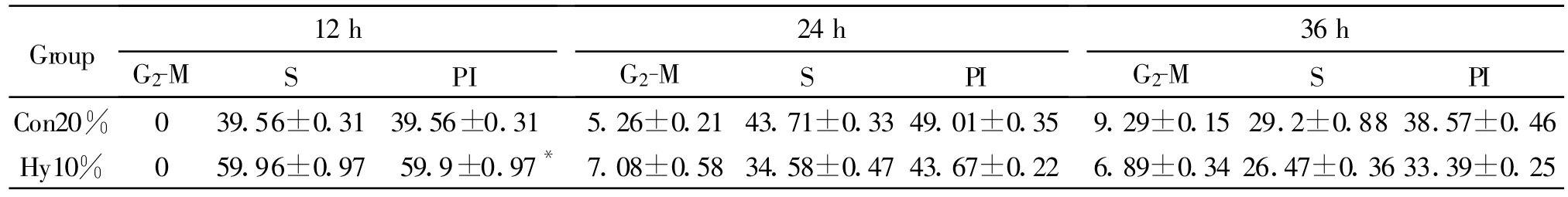
Tab.1 Effect of hypoxia on cell cycle(,n=4)
Con 20%:Normoxia group(20%O2);Hy 10%:Hypoxia group(10%O2);PI:Proliferation index.PI of SkMs in hypoxia is higher than that in normoxia at 12 h*P<0.05 vs normoxia group
Group 12 h G2-M S PI 24h G2-M S PI 36 h G2-M S PI Con20% 0 39.56±0.3139.56±0.31 5.26±0.2143.71±0.3349.01±0.35 9.29±0.1529.2±0.8838.57±0.46 Hy10% 0 59.96±0.97 59.9±0.97* 7.08±0.5834.58±0.4743.67±0.22 6.89±0.3426.47±0.3633.39±0.25
2.3 低氧对大鼠SkMs HIF-1α mRNA表达的影响
不同时间点收集常氧组和低氧组细胞用RTPCR的方法检测HIF-1α mRNA的表达。结果表明,常氧条件下C2C12细胞即有HIF-1αmRNA的持续表达,且常氧组和低氧组细胞在不同时间点HIF-1α mRNA的表达无明显差异(图2)。
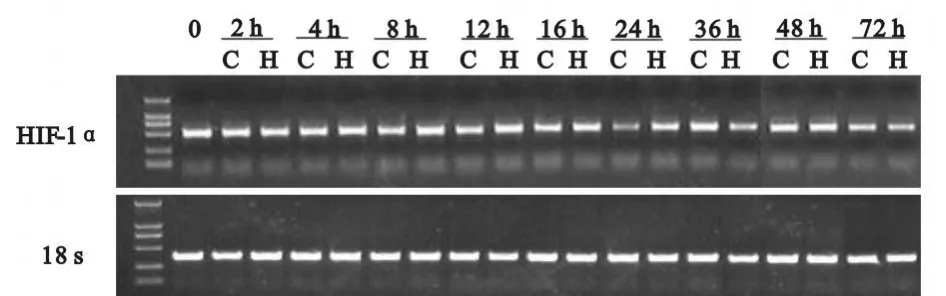
Fig.2 Effect of hypoxia on the expression of HIF-1αmRNA in SkMs
2.4 低氧对大鼠SkMs HIF-1α总蛋白水平的影响
研究表明大多数细胞HIF-1α的表达主要受蛋白水平的调控,本实验结果显示:常氧条件下C2C12细胞即有HIF-1α蛋白的表达,且常氧组和低氧组细胞在不同时间点HIF-1α蛋白的表达无明显变化(图3)。

Fig.3 Effect of hypoxia on the expression of HIF-1αproteinum in SkMs
2.5 低氧对大鼠SkMs胞浆和胞核HIF-1α蛋白水平的影响
我们分别检测了常氧和低氧条件下C2C12细胞胞浆和核HIF-1α蛋白水平。在常氧和低氧(10%O2)条件下培养细胞48 h后,按核胞浆蛋白提取试剂盒方法分别提取SkMs胞浆和胞核蛋白,结果表明:常氧条件下细胞胞浆HIF-1α蛋白水平高于核HIF-1α蛋白水平,而低氧条件下,结果恰好相反,核内HIF-1α蛋白水平高于胞浆HIF-1α蛋白水平(图4,左图为Western blot结果,右图数据的统计学分析是来自3次试验的结果)。

Fig.4 Expression of HIF-1αproteinum in endochylema and intranucelus under normoxia or hypoxia
3 讨论
早在1976年Kunze等人发现,安静状态下胫骨前肌肉的氧浓度为2.1%~5%,运动中氧浓度会更低。1997年Evers等人[4]用微电极测量方法得知,随电极摆放位置不同,人体骨骼肌氧浓度在1.8%~10.5%之间,即肌肉组织中生理性氧浓度低于目前体外细胞培养的氧浓度(20%O2)。由此人们设想低氧环境可能更有利于SkMs的增殖与分化,这一点被后来的实验所证实[5]。本研究进一步比较了不同氧浓度对大鼠SkMs增殖的影响,并初步探讨了HIF-1α在低氧促SkMs增殖中的作用。
从Desmin阳性细胞数计数的结果我们可以得出,低氧(3%、10%O2)可以促进大鼠SkMs体外增殖(P<0.05),不同氧浓度对SkMs增殖的效果不同,10%的低氧环境更有利于SkMs的增殖。从流式细胞仪的结果可知,低氧12~24h时低氧组细胞增殖指数明显高于常氧组,且细胞大多处于DNA合成期(S期),24h之后两组细胞的增殖指数无明显差异。可见,SkMs在低氧24h内增殖速度最快,延长低氧时间,细胞增殖减慢。通过本研究我们首次提出了10%O2可以促进SkMs体外增殖,并证实轻度低氧较中度低氧对SkMs的促增殖作用更加明显。
既往的研究表明,常氧下HIF-1α被脯氨酸羟化酶(PHD)羟化,进而被蛋白酶体降解,因此常氧下检测不到HIF-1α的表达;但在低氧环境中脯氨酸羟化酶的羟化作用被抑制,HIF-1α不能被降解而导致其在胞浆中聚集,从而进入核内,促进了下游靶基因的表达[6]。因此,HIF-1α在胞浆内的量的增多是调节下游靶基因的关键[7]。
然而本研究的结果显示,SkMs在常氧下即有HIF-1α mRNA和蛋白水平的表达,且与低氧下HIF-1α mRNA和蛋白水平无显著差异。这与我们研究过的神经干细胞及骨髓间充质干细胞十分不同,这些细胞常氧条件下均检测不到HIF-1α蛋白的表达。Stroka等人[8]曾经报道,HIF-1α蛋白在心、脑、肾、肝、肌肉等组织的表达不同,肌肉组织在常氧下即有HIF-1α蛋白的表达,其他组织在中重度低氧(≤6%O2)时才表达。由此,HIF-1α在肌肉组织或SkMs中表达的特殊性,提示着肌肉组织或SkMs中的HIF-1α受低氧调控的方式可能与其他组织和细胞不同。
我们进一步用Weston blot方法分别检测了常氧和低氧条件下SkMs胞浆和胞核中HIF-1α蛋白表达。结果显示,常氧条件下胞浆HIF-1α蛋白水平高于核HIF-1α蛋白水平,而低氧状态下,胞核中HIF-1α蛋白水平高于胞浆HIF-1α蛋白水平。由结果我们推测,SkMs中的HIF-1α受低氧调节的方式可能与众不同,HIF-1α的活化更可能是通过氧浓度特异性调节HIF-1α蛋白核转位增加,HIF-1α核转位的发生与胞浆中HIF-1α蛋白量的多少没有关系,只受到氧浓度的特异性调节。低氧条件下,SkMs胞浆中的HIF-1α进入细胞核中,在核中高度聚集,与 HIF-1β亚基结合活化启动靶基因的转录,调节下游与SkMs增殖相关的靶基因,促进SkMs增殖。本工作发现与Kubis等人[9]的报道一致,他们用免疫荧光的方法发现,常氧条件下HIF-1α分布在SkMs胞浆而低氧条件下HIF-1α聚集在SkMs核内。由此,低氧对SkMs增殖的调控或许并不是通过调节HIF-1α蛋白表达量的多少来实现,更有可能是通过调节HIF-1α核转位的过程。
综上所述,轻中度低氧促进了大鼠成肌细胞的增殖,为体外扩增成肌细胞提供了新的思路;HIF-1α可能是通过氧浓度调控的核转位的方式参与了低氧促进成肌细胞的增殖,确切的机制需要进一步的深入研究。
[1]Buckingham M,Montarras D.Skeletal muscle stem cells[J].Curr Opin Genet Dev,2008,18(4):330-336.
[2]Csete M,Walikonis J,Slawny N,et al.Oxygen-mediated regulation of skeletal muscle satellite cell proliferation and adipogenesis in culture[J].J Cell Physiol,2001,189(2):189-196.
[3]陈晓萍,刘 红,吴 燕,等.成人成肌细胞快速高效分离方法的建立[J].中华神经医学杂志,2003,2(6):404-406.
[4]Evers B,Odemis V,Gerngross H,et al.Intramuscular oxygen partial pressure in patients with chronic exertional compartment syndrome[J].Adv Exp Med Biol,1997,428(4):311-316.
[5]Kook S H,Son Y O,Lee K Y,et al.Hypoxia affects positively the proliferation of bovine satellite cells and their myogenic differentiation through up-regulationofMyoD[J].Cell Biol Int,2008,32(8):871-878.
[6]Jaakkola P,Mole D R,TianY M ,et al.Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation[J].Sci,2001,292(5516):468-472.
[7]Hieber S,Huhn R,Hollmann M W,et al.Hypoxia-inducible factor 1 and related gene products in anaesthetic-induced preconditioning[J].Eur J Anaesthesiol,2009,26(3):201-206.
[8]Stroka D M,Burkhardt T,Desbaillets I,et al.HIF-1 is expressed in normoxic tissue and displays an organic-specific regulation under systemic hypoxia[J].FASEB J,2001,15(13):2445-2453.
[9]Kubis HP,Hanke N,Scheibe R J,et al.Accumulation and nuclear import of HIF1 alpha during high and low oxygen concentration in skeletalmuscle cells in primary culture[J].Biochim BiophysActa,2005,1745(2):187-195.

