银杏叶提取物对2型糖尿病大鼠膈肌收缩能力的影响*
李旭升,傅永强,周 标,胡 野,陈国荣
(1.金华职业技术学院医学院,浙江 金华 321017;2.温州医学院病理学教研室,浙江 温州 325000)
骨骼肌是胰岛素刺激状态下葡萄糖摄取的主要部位,也是糖尿病损害的主要靶位。膈肌作为重要的呼吸肌,具有终身持续收缩特性,对于维持生物体的肺功能具有极其重要的作用[1]。我们前期的研究发现银杏叶提取物(ginkgo biloba extract,GbE)可减轻自由基和过量一氧化氮对1型糖尿病大鼠膈肌的损伤[2]。本研究旨在探讨GbE对2型糖尿病大鼠膈肌收缩能力和能量代谢酶活性的影响。
1 材料与方法
1.1 实验用药及试剂
GbE购自北京双鹤天然药物有限公司(舒血宁注射液,批号319163.0606),每支装 5 ml,折合GbE为17.5 mg(含总黄酮醇苷4.2 mg;含银杏内酯0.70mg)。链脲佐菌素(STZ)购自Sigma公司,临用前溶解于0.1 mmol/L枸椽酸缓冲液内,pH=4.0。细胞色素氧化酶(cytochrome oxidase,CCO)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒均购自南京建成生物工程研究所。
1.2 动物及实验方案
雄性清洁级SD大鼠40只,体重(180~250)g,由温州医学院实验动物中心提供。按随机数字表法分为正常对照组10只、造模组30只。正常组喂以普通饲料,造模组喂以高糖高脂饲料(饲料组成:10.0%猪油,20.0%蔗糖,2.5%胆固醇,1.0%胆酸盐,66.5%常规饲料),整个实验期间自由进食、进水。4周后,造模组在禁食16 h后按25 mg/kg腹腔注射链脲佐菌素,对照组腹腔注射等容积枸椽酸缓冲液。72 h后尾静脉采血用血糖仪(one TouchⅡ型,强生中国有限公司)测定尾静脉全血血糖,≥13.8 mmol/L为模型成功。随机选取造模成功大鼠20只平均分成2组:糖尿病组、GbE治疗组。GbE治疗组按8 mg/(kg◦d)剂量腹腔注射GbE,对照组及糖尿病组腹腔注射等容积生理盐水,每天1次,连续8周。
1.3 膈肌收缩能力测定
在戊巴比妥腹腔注射麻醉下,迅速剖开腹腔,取左侧肋膈肌(包括中心腱及部分肋骨),置于盛有Krebs氏液的平皿中,持续通入 95%O2和5%CO2的混合气体,依肌纤维走行方向修剪成宽约0.8 cm的肌条待用。参照Coombes和沈兴平等[3,4]的检测方法,将膈肌条垂直悬挂于盛满37℃Krebs氏液(95%O2,5%CO2)的麦氏浴槽中。肋骨端固定在浴槽底部,中心腱端连接于张力换能器(贝科监控仪器有限公司)。调节肌肉至最适初长度(L0),静置稳定20min,两个铂金丝电极置肌条两边,电子刺激器以超最大电压(约20V)刺激膈肌。张力换能器的输出信号由智能八道生理记录仪记录分析。测定下列参数:
(1)单收缩张力(Pt):每根肌条测定两次在L0时的Pt,每次刺激(强度20.00V,波宽2 ms)间隔2 min。以两次平均值作为测定值,用肌肉横截面积(cross-sectional area,CSA)校正(单位:kg/cm2)[4]。
(2)最大强直张力(P0):在单收缩刺激后静置10min ,肌条予 100Hz,20.00V ,波宽 2 ms,串长 400ms刺激,测定P0,其值由CSA校正(单位:kg/cm2)。
(3)疲劳指数(FI):予肌条20.00V,波宽2 ms,每分钟30串,每串5波,每波5 Hz,串间隔1 s,总刺激10min,致膈肌疲劳,2 min后测疲劳后张力,取2次平均值为测定值,将其与Pt之比作为FI值。
1.4 膈肌能量代谢酶活性测定
制备肌条同时取部分膈肌,秤重剪碎,以1∶10(质量比)比例加入生理盐水,匀浆,以400×g离心10min,取上清 200μl,稀释成 5倍体积浓度,测酶活性。采用考马斯亮蓝法分别测定蛋白含量。严格按试剂盒说明操作。
1.5 膈肌超微结构观察
取膈肌组织,制成1 mm3小块,置于2.5%戊二醛溶液中固定,常规PBS漂洗,丙酮梯度脱水,E-pon812包埋。LKB超薄切片机切片,日立H600A型透射电镜下观察。
1.6 数据统计
2 结果
2.1 各组大鼠膈肌收缩能力的比较
与对照组比较,糖尿病组大鼠膈肌Pt、P0、FI水平明显降低(P <0.01);GbE治疗组 Pt、P0、FI水平显著高于糖尿病组(P<0.05,表1)。
Tab.1 Comparison of contraction capacity in diaphragm among the three groups()

Tab.1 Comparison of contraction capacity in diaphragm among the three groups()
*P<0.05,**P<0.01 vs control;#P<0.05 vs diabetic
Group n Pt(kg/cm2)P0(kg/cm2) FI Control 100.73±0.11 1.96±0.17 0.46±0.10Diabetic 90.37±0.12**1.09±0.33**0.29±0.04**GbE treatment 100.52±0.16**#1.56±0.50*#0.40±0.13#
2.2 各组大鼠膈肌能量代谢酶的比较
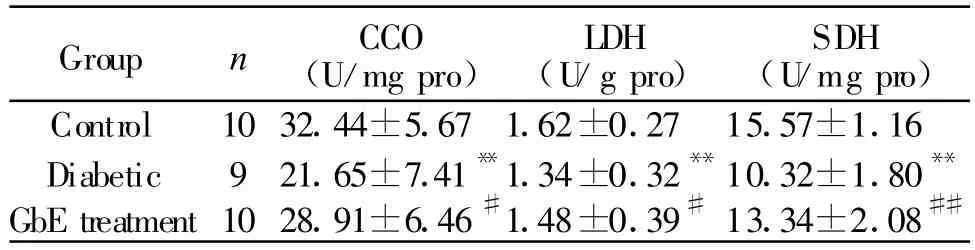
与对照组比较,糖尿病组大鼠膈肌CCO、LDH、SDH活性明显降低(P<0.01);GbE治疗组CCO、LDH、SDH活性显著高于糖尿病组(P<0.01,P<0.05,表 2)。
Tab.2 Comparison of the activities of energy metabolism enzymes in diaphragm among the three groups()
Tab.2 Comparison of the activities of energy metabolism enzymes in diaphragm among the three groups()
*P<0.05,**P<0.01 vs control;#P <0.05,##P <0.01 vs diabetic
Group n CCO(U/mg pro)LDH(U/g pro)SDH(U/mg pro)Control 1032.44±5.671.62±0.27 15.57±1.16 Diabetic 921.65±7.41**1.34±0.32**10.32±1.80**GbE treatment 1028.91±6.46#1.48±0.39#13.34±2.08##
2.3 膈肌超微结构观察
正常对照组大鼠膈肌线粒体呈圆形或椭圆形,无肿胀,线粒体膜完整,线粒体嵴呈同心圆或纵行排列,嵴密集清晰、排列规则;肌原纤维密集,排列整齐,肌节各带清晰(图1A)。糖尿病组大鼠膈肌线粒体肿胀,膜模糊不清,部分膜破裂,嵴排列紊乱,数量减少甚至消失形成空泡,肌原纤维排列紊乱(图1B)。GbE治疗组大鼠膈肌线粒体超微结构明显轻于糖尿病组,多数线粒体嵴排列较规则,少数嵴肿胀模糊及断裂或空泡现象;肌原纤维排列整齐,各带清晰(图1C)。
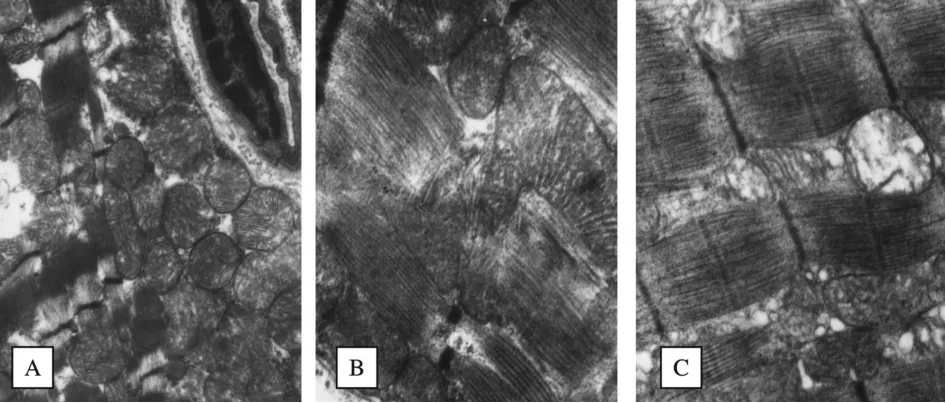
Fig.1 Ultrastructure of diaphragm from three groups(×20k)
3 讨论
糖尿病的高血糖状态具有普遍的毒性作用,骨骼肌也是糖尿病损伤的主要部位。糖尿病对膈肌结构、功能的损害,有别于其它骨骼肌[5]。膈肌除具有骨骼肌的一般生化、生理和结构功能外,尚具有终身持续收缩特性,对于维持正常的肺功能,具有极其重要的作用。应用高糖高脂饲料加低剂量链脲佐菌素造成大鼠空腹血糖、胰岛素水平明显升高,同时伴有高血脂,出现类2型糖尿病的特征[6]。本实验结果显示的大鼠模型膈肌收缩能力(Pt、P0)和抗疲劳能力(FI)下降和以往的研究结果类似[4]。电镜检查也证实了2型糖尿病大鼠膈肌损伤的存在。
酶是机体进行代谢活动所必须的重要物质。在呼吸肌,包括CCO、SDH在内的众多酶类的正常活性,是维持呼吸运动的一个极为重要的物质基础。CCO位于线粒体内膜,可以直接将电子传递给氧,使氧被激活成氧离子,是呼吸链中的最后一个递电子体。由于CCO是呼吸链的终端,其活性强度直接影响着呼吸链传递电子的效率,对于细胞能量的产生有非常重要的意义。LDH是糖酵解代谢途径中的关键酶,反映肌肉的无氧代谢水平。SDH结合在线粒体内膜上,是三羧酸循环中唯一与内膜结合的酶,其活性标志着三羧酸循环进程的快慢,反映对有氧代谢能力的影响。本实验结果显示糖尿病组大鼠膈肌CCO、LDH、SDH活性下降,可能提示2型糖尿病大鼠8周时膈肌呼吸链电子传递障碍,糖酵解和有氧氧化代谢能力下降,说明糖尿病时膈肌组织存在能量代谢障碍。电镜下糖尿病大鼠膈肌主要表现为线粒体扩张、嵴变短、空泡化,也进一步证实了这一点。但沈兴平等[7]报道1型糖尿病大鼠4周时膈肌SDH活性增强,认为糖尿病早期膈肌为适应机体代谢变化,以有氧氧化代谢提供肌肉收缩能量。随着病程延长,线粒体损伤的加剧,最终导致SDH活性下降。
GbE是从银杏科植物银杏的叶中分离纯化的提取物,其主要有效成分为黄酮苷类和萜烯内酯类,具有抗氧化、抗炎、降糖、降脂、改善胰岛素抵抗等作用[8]。研究表明GbE能显著提高骨骼肌的收缩能力,延缓疲劳的发生[9]。我们前期的研究证实GbE不仅对糖尿病大鼠多个脏器有保护作用,并减轻膈肌线粒体和心肌组织自由基损伤和抑制NO的产生,从而对其起到保护作用[2,10]。本研究结果提示,GbE能够增强2型糖尿病大鼠膈肌有氧氧化代谢和糖酵解能力,改善线粒体呼吸链的功能,加强膈肌能量供应,从而提高膈肌的收缩能力。
[1]McGuire M,MacDermott M.The influence of streptozotocininduced diabetes and the antihyperglycaemic agent metformin on the contractile characteristics and the membrane potential of the rat diaphragm[J].Exp Physiol,1998,83(4):481-487.
[2]李旭升,陈国荣,毛孙忠,等.银杏叶提取物对糖尿病大鼠膈肌的保护作用[J].中国病理生理杂志,2004,20(7):1234-1237.
[3]Coombes J S,Powers S K,Rowell B,et al.Effects of vitamin E andα-lipoic acid on skeletal muscle contractile properties[J].J Appl Physiol,2001,90(4):1424-1430.
[4]沈兴平,舒昌达,何 军.糖尿病大鼠膈肌功能和形态学变化[J].中国病理生理杂志,2002,18(8):970-973.
[5]Merino-Ramirez M A,Juan G,Ramon M,et al.Electrophysiologic evaluation of phrenic nerve and diaphragm function after coronary bypass surgery:prospective study of diabetes and other risk factors[J].J Thorac Cardiovasc Surg,2006,132(3):530-536.
[6]周 贞,蒋天康,陈海清,等.银杏叶提取物对2型糖尿病大鼠肝功能的影响[J].中药药理与临床,2008,24(4):44-46.
[7]沈兴平,舒昌达,李琼英,等.糖尿病大鼠膈肌酶组织化学研究[J].中国病理生理杂志,2002,18(10):1276-1279.
[8]Kudolo G B,Delaney D,Blodgett J.Short-term oral ingestion of Ginkgo biloba extract(EGb 761)reducesmalondialdehyde levels inwashedplatelets of type 2 diabetic subjects[J].DiabetesResClin Pract,2005,68(1):29-38.
[9]谢 伟,杨永亮,梁 莉,等.银杏黄酮对骨骼肌抗疲劳能力的影响[J].中国临床康复,2006,10(36):98-100.
[10]李旭升,陈国荣,李剑敏,等.银杏叶提取物对糖尿病大鼠心肌损伤的防护作用[J].中国应用生理学杂志,2005,21(2):176-178.

