适于AFLP分析的大麻干叶DNA快速提取方法研究
胡尊红 ,陈 璇 ,郭鸿彦 ,许艳萍 ,张庆滢 ,郭孟璧 ,伍菊仙 ,杨 明 *
(1.云南农业大学,昆明,650201;2.云南农业科学院经济作物研究所,昆明,650205;3.云南工业大麻股份有限公司,昆明,650217)
大麻(Cannabis sativa L.)是大麻科(Cannabinance)大麻属(Cannabbis)一年生草本植物,多为雌雄异株,雌雄比例为1:1[1]。我国大麻种质资料丰富,有着悠久的栽培利用历史。其经济利用价值涉及纺织、建材及造纸等各个方面[2]。
扩增片段长度多态性(Amplified Fragment Length Polymorphism,AFLP)是由荷兰Vos.P和Zabeau M(1995)创建发展的一种新的DNA分子标记技术[3]。AFLP技术是RFLP和RAPD技术相结合的产物,其多态性强,试验结果稳定,重复性好,被认为是一种较为理想的高效分子标记技术[4]。DNA提取是分子生物学试验研究的一项基础技术,而能否提取到高质量DNA是AFLP试验成功的关键。在以前的研究中大多数学者都是以大麻新鲜嫩叶片作为DNA提取的材料[5-9],用新鲜嫩叶提取DNA可以满足一般分子试验要求,但对于远距离采样或不具备超低温保存的条件下,新鲜嫩叶不宜长期保存,为了防止试验材料降解,特别是远距离采集珍贵野外材料,通常需对材料进行采用变性硅胶或烘干处理保存。同时,由于大麻毒品的贩卖形式常为制干的花叶部分,通过对其提取DNA进行鉴定,可以鉴定该样品的所属品种,从而初步推断出它的来源地。目前尚未有关于对大麻植物干燥花叶材料DNA提取方法研究的报道。据文献报道,王婷等[10](2008)采用改良CTAB法从变色硅胶干燥的忍冬叶片中提取的DNA质量与鲜叶无明显差异,完整性好,纯度高而且干燥叶片产率更高,能被EcoR I完全酶切。郝岗平等[11](2006)在传统CTAB法基础上以泰山白花丹参干叶片比较了4种DNA提取方法,获得了一种简便、快速分离高质量完整DNA的方法,所得的DNA可直接用于AFLP分析,另外还有从其他植物干材料提取高质量DNA的相关报道[12-16]。为了满足科研和禁毒工作的实际需求,减少工作量和材料保存成本,本研究利用大麻干叶快速提取基因组DNA并进行AFLP-PCR扩增,其操作简便,又节省时间和成本,具有良好的重复性,为大麻AFLP遗传分析研究奠定了基础。
1 材料和方法
1.1 试验材料
本研究所用大麻材料(Cannabis sativa L.)均由云南省农业科学院经济作物研究所提供,避光保存时间两年以上的大麻干叶材料为Ym8 Ym39 Ym81 Ym102 Ym265等共23份。
主要试剂:CTAB、EDTA、PVP-40、β-巯基乙醇、抗坏血酸、RNaseA酶、琼脂糖等试剂购自昆明森格玛公司;EcoRI、MseI、T4 ligase、Taq 酶、dNTP、MgCl2 等购自 Fermentas公司。
主要仪器:DNA扩增仪(Bio-Rad 9700,美国),紫外凝胶成像仪(Bio-Rad UVP GDS-8000,美国),高速冷冻离心机(Hermle Labortechnlk,德国),多用电泳仪电源(DYY-12C,北京),测序电泳仪(JUNYI,北京),纯水仪(Aquapro,重庆),紫外分光光度计(UV-7504,上海)。
1.2 试验方法
1.2.1 大麻干叶DNA提取
本研究在传统的植物基因组提取CTAB法基础上做如下4种改进处理,目的是高效防止DNA褐化,并去除多糖、酚类化合物。

具体方法如下:
称取约0.5g大麻干叶样放入研钵中,并加入少量石英沙,用液氮迅速研磨成粉末,越细越好,将粉末转至1.5mL离心管,再加入800μL 65℃预热的CTAB提取液(2%CTAB,1.4MNaCl,100mM Tris-HCl pH 8.0,20mMEDTA pH 8.0,各处理组分),65℃水浴1h,每隔10分钟摇动一次;4℃12000rpm下离心15min,取上清液加入等体积苯酚-氯仿-异戊醇(25:24:1)颠倒充分混匀,静置约5min;4℃12000rpm下离心10min,取上清液加入等体积氯仿-异戊醇(24:1),轻摇混匀,静置3-5min;4℃12000rpm下离心10min,取上清液加入2/3体积的冰冻异丙醇(-20℃),轻摇混匀,-20℃下沉淀DNA30-60 min;4℃10000rpm下离心10min,弃上清液(或用枪头挑起沉淀),用预冷的70%乙醇浸洗沉淀2次,每次30min,离心后在超净工作台上充分风干,加入200μL 1xTE(pH8.0)溶解 DNA。
1.2.2 大麻干叶DNA纯化
溶解好的基因组DNA,加入2μL10mg/mLRNase,37℃水浴1h,消化RNA;再加入等体积的氯仿-异戊醇(24:1),轻摇混匀后,12000rpm下离心10min;取上清液,加入1/10倍体积的3MNaAc(PH 5.4)及预冷的2倍体积无水乙醇,轻摇混匀后,-20℃静置约30min,沉淀DNA;用预冷的70%乙醇浸洗沉淀2次,无水乙醇浸洗1次,每次20min,离心后在超净工作台上充分风干,加100μL 1xTE(pH8.0)溶解。取适量DNA测定其浓度和纯度,其余样品在-20℃下保存备用。
1.2.3 DNA纯度、浓度检测
(1)紫外吸收检测:
四个方法提取的DNA样品各取2μL,用ddH2O稀释50倍,用ddH2O为空白对照,在紫外分分光光度计上测定OD260、OD280值及OD260/OD280的比值,并用OD260/OD280比值估算DNA的纯度,DNA浓度(ug/mL)=OD260×50×稀释倍数。
(2)琼脂糖凝胶电泳检测:
取5μLDNA样品在O.8%琼脂糖凝胶上电泳(0.5×TBE),QuantityOne凝胶成像仪观察并照相,比较不同方法提取大麻干叶的DNA的带型,并通过和λDNA的亮度对比来估计基因组DNA浓度。
1.2.4 AFLP-PCR扩增及聚丙烯酰胺凝胶电泳
参照Vos等[3](1995)的方法,略有改动。
首先在37下用限制性内切酶EcoRI和MseI对DNA进行双酶切,经检测完全酶切的产物加入T4连接酶在16-22℃过夜连接;连接产物稀释10倍后进行PCR预扩增,预扩增产物稀释20倍进行选择性扩增。选择性扩增产物经6%聚丙烯酰胺凝胶电泳分离后用银染法检测。
2 .结果与分析
2.1 大麻干叶DNA提取方法比较
DNA的质量是AFLP成功与否的关键,通过对常用的3个抗氧化剂:巯基乙醇、PVP及抗坏血酸进行组合形成了四个处理,利用这四个处理提取同一批大麻干叶DNA,并进行琼脂糖电泳(图1)。可以看出,METHOD3处理提取的DNA电泳条带清晰不拖尾,无蛋白质、多糖等杂质残留胶孔,说明其完整性好、纯度较高。METHOD1处理提取的DNA条带淡,胶孔发亮,说明DNA产率低,还残留蛋白质及多糖等杂质;METHOD2处理条带清晰但暗淡,说明完整性好但产率太低。METHOD4处理和METHOD3处理效果类似,提取的DNA条带清晰,无明显降解,但METHOD4处理点样孔有杂质滞留,说明在METHOD3处理的基础上添加100mmol/L抗坏血酸反而不能很好去除蛋白质、多糖等杂质。四个处理提取的DNA在紫外分光光度计上测定其纯度及浓度(表1),同样说明了用METHOD3处理来提取大麻基因组DNA效果最佳。鉴于以上结果,采用METHOD3处理提取了五个大麻品种干叶DNA(图2),呈现出DNA条带清晰无拖尾,完整性好,纯度高等特点。
2.2 AFLP分析
将METHOD3处理提取到的大麻DNA样品经酶切、连接、预扩增及选择性扩增后,用6%的聚丙烯酰胺凝胶电泳,银染法检测并拍照。
DNA能否充分酶切是AFLP指纹图谱真实与否的关键,不完全酶切的产物会导致后期扩增带型不稳定,不能充分反映扩增DNA片段真实的多态性,而高质量的DNA又是高效酶切的前提和保证。把METHOD3处理提取得到的DNA经EcoR I/Mse I双酶切,并进行1.2%琼脂糖电泳(图3)。电泳检测结果可知,酶切后的DNA片段呈弥散(smear)状,看不见大分子的DNA,且片段小于1000bp,多集中在500bp以下,说明基因组DNA已被EcoR I/Mse I完全酶切,可以用来进行AFLP的后续工作。

图1 不同处理方法提取的大麻干叶基因组DNA的琼脂糖电泳图谱Figure 1.The pattern ofgenomic DNAextracted fromdried hemp leaves bydifferent methods

表1 不同处理方法提取的大麻DNA样品纯度及浓度检测Table 1 DNApurityand yield detected byUV-Spectrometer

图2 METHOD3处理提取不同大麻干叶基因组DNA电泳图谱Figure 2.The pattern ofgenomic DNAfromdifferent dried hemp leaves byMETHOD3
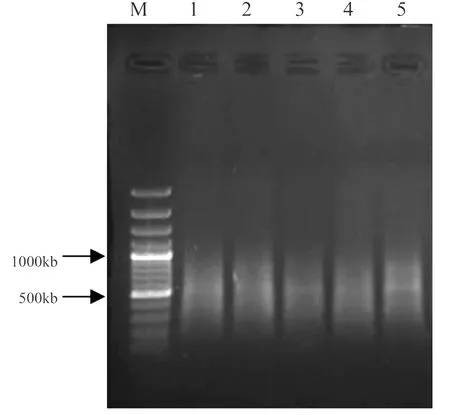
图3 METHOD3法提取DNA的酶切鉴定Figure 3.Enzyme digestion identification of genomic DNA extracted byMETHOD3

图4 预扩增产物琼脂糖凝胶电泳图谱Figure 4.Electrophoretic pattern ofpre-amplification

图5 选择性扩增聚炳烯酰胺图谱Figure 5.Electrophoretic pattern ofselective amplification
AFLP扩增体系包括预扩增和选择性扩增两个环节,预扩增产物的质量直接关系下一步的选扩。预扩增产物用1.2%的琼脂糖凝胶进行电泳检测(图4),扩增片段小于1000bp,且多集中在500bp以下,条带亮,符合预扩增标准。在AFLP选择性扩增中,使用E33/M49引物组合进行选择性扩增,产物经变性后在6%的变性聚丙烯酰胺凝胶上电泳,银染、显色后条带清晰、多态性丰富(图5)
3 讨 论
DNA质量是AFLP成功的关键,其中影响AFLP主要的物质是酚类物质、多糖、单宁等,这些物质的存在不仅影响酶切的效果而且还影响后续PCR反应中Polymerase的活性[10,11]。在不同植物材料或相同材料不同部位中这些物质的含量都不一样,大麻花叶中含这化合物较多,尤其是酚类化合物,目前报道的已有61种[1],酚类物质在DNA提取过程中极易被氧化,而使提取的大麻DNA呈黄色或褐色,而且含有杂质。针对这种情况,本试验在传统CTAB法上进行了改良,添加不同的抗酚类氧化褐变物质,以筛选出适宜AFLP分析的大麻基因组DNA提取的有效方法。本试验证明,在CTAB提取液中添加了2%β-巯基乙醇(V/V)和3%PVP-40(V/V),能够有效的防止酚类化合物的氧化,同时DNA得率也较高。β-巯基乙醇作为还原剂,可以防止酚类物质的氧化;PVP作为螯合剂能够结合多酚化合物,增加DNA提取物的溶解性,并在离心过程中可被直接除去。在试验过程中METHOD1和METHOD2中都加有抗坏血酸,然而提取的DNA质量和浓度并不理想,甚至还有杂质残留;另外,用METHOD4处理(基本提取液+2%β-巯基乙醇(V/V)+3%PVP-40(M/V)+100mmol/L抗坏血酸)提取的DNA虽然有着较高的得率,但是仍然有蛋白质及多糖等杂质残留胶孔,究其原因可能是由于抗坏血酸的加入改变了提取液中离子条件,又或者是其本身和其它物质相互作用而导致提取液在离心过程中去除蛋白、多糖的能力下降。
DNA提取固然重要,但是DNA的纯化也直接影响着DNA的质量,本试验在添加RNase消化RNA后,加入等体积的氯仿-异戊醇(24:1)来去除溶液中残留的蛋白质,离心后加入1/10倍体积的3MNaAc(PH 5.4)及预冷的2倍体积无水乙醇来沉淀基因组DNA,这样就保证了溶液中多糖、金属离子及其它杂质被乙醇充分溶解,从而保证了DNA的纯度。
完全酶切是AFLP成功基础,也是保证试验结果可靠的前提,在该步骤中本试验采取了分次加限制性内切酶的方法,这样就保证了酶的活性,让基因组DNA在最短的时间内得到了充分的酶切。
4 结 论
本研究对如何从大麻干叶中提取高质量的适合AFLP试验的基因组DNA进行了探讨,结果表明,在CTAB提取液中添加2%β-巯基乙醇(V/V)和3%PVP-40(M/V)能够提取到高质量的基因组DNA,经过AFLP的试验验证,该方法完全适合提取大麻干叶中基因组DNA来进行AFLP分析。
[1] 陈其本,余立惠,杨明,许薇.大麻栽培利用及发展对策[M],电子科技大学出版社,1993.
[2] 郭鸿彦,杨明,谢晓慧,高运红,袁华.云南工业大麻产业化发展前景广阔[J].中国麻作,2002,24(4)46-49.
[3]Vos P,Hogers R,Bleeker M,et al.AFLP:a newtechnique for DNAfingerprinting[J].Nucleic Acids Res,1995,23:4407-4414.
[4]Ulrich G,et al.AFLP genotypingand fingerprinting[J].REVIEWS,1999,14(3):389-394.
[5] Shujuan S,Clarke R C,et al.An Effective Procedure for the RAPD Analysis of Hemp Cannabis sativa L [J].Journal of Forensic Sciences,2001,10(2):67-69.
[6] Forapani S,Carboni A,et al.Comparison of Hemp Varieties Using Random Amplified Polymorphic DNA Markers[J].Crop Sciences,2002,41:1682-1689.
[7] Kojoma M,lida O,et al.DNA Fingerprinting of Cannabis sativa Using inter-Simple Sequence Repeat(ISSR)Amplification[J].Plant Med,2002:60-63.
[8] 陈其军,韩玉珍,傅永福,赵德刚,国凤利,孟繁静,刘卫平.大麻性别的RAPD和SCAR分子标记[J].植物生理学报,2001,27(2):173-178.
[9] 苏友波,朱颖,林春,杨明.大麻RAPD分子标记的引物筛选[J].中国麻业,2002,24(5):12-16.
[10] 王婷,周凤琴,李佳,张永清,郭庆梅,夏阳,李艳艳,燕丽萍.忍冬干叶基因组DNA提取方法的研究[J].中华中医药学刊,2008 26(3):496-498.
[11] 郝岗平,边高鹏,张媛英.泰山白花丹参干叶片高质量DNA的提取[J].中草药,2006,37(6):111-114.
[12] 王化坤,陶建敏,薛华柏,章镇,娄晓呜,俞文生.一种简便的果树夏秋梢硅胶干燥叶DNA提取方法[J].江苏农业科学,2006,5:75-77.
[13] 李学营,彭建营,彭士琪.部分枣属植物硅胶干燥叶片DNA提取方法的比较[J].河北农业大学学报,2006,29(1):38-40.
[14] 朱苏文,刘伟.石斛干品基因组DNA的提取与RAPD分析[J].2005,14(3):224-227.
[15] 顾蔚,魏南玉,代立娟,王枯之.华中五昧子干燥材料DNA提取方法的研究[J].生物技术,2007,17(6):25-27.
[16] 张大明,陈新露,邓峥嵘.木根麦冬(Ophiopogon xylorrhizus)干叶提取DNA用于RAPD分析[J],生物多样性,1996,4(2):219-122.

