KISS-1基因对人食管鳞癌细胞 EC-9706的MMP-2表达影响
李晟磊,赵志华,陈奎生,张 岚,高冬玲,张云汉,张 蕾(郑州大学第一附属医院,郑州 450052)
KISS-1是一种肿瘤转移抑制基因[1],其表达缺失或降低与肿瘤的浸润、转移及血管生成有关,但其具体机制尚不完全清楚。我们前期研究发现,在食管鳞癌组织中存在 KISS-1表达缺失,且 KISS-1和MMP-2的表达呈负相关。2008年 4~7月,我们将携带 KISS-1基因的真核表达载体转染人食管鳞癌细胞 EC-9706细胞,观察其对 MMP-2表达的影响。
1 材料与方法
1.1 材料 pcDNA 3.1-KISS-1质粒,EC-9706,RTPCR一步法试剂盒,凯基全蛋白提取试剂盒(KGP-2-50),SP免疫组化检测试剂盒,LipofectamineTM2000,KISS-1兔抗人多克隆抗体,MMP-2羊抗人多克隆抗体,KISS-1、MMP-2引物由北京赛百盛生物工程公司合成。
1.2 方法
1.2.1 细胞培养与基因转染 EC-9706细胞在含10%胎牛血清、100 U/ml青霉素和 100μg/ml链霉素的完全培养基中,37℃、5%CO2培养,以 1×105~2×105/孔接种于 24孔板上,待细胞长至 80%~90%融合时分为 A、B、C组。A、B组按试剂盒要求分别加入 pcDNA3.1-KISS-1质粒、pcDNA3.1空质粒混匀,置 37℃孵箱培养,转染 4~6 h换液,加入完全培养液终止转染。于转染后 48 h加入终浓度为600 μg/ml的 G418,连用 2周。挑取肉眼可辨的单克隆细胞,以 G418终浓度为 400μg/ml继续培养,以获得稳定转染细胞。C组不处理。
1.2.2 KISS-1、MMP-2蛋白检测方法 采用 Western blot法。按总蛋白提取试剂盒说明书提取总蛋白,Bradford法检测蛋白质含量。蛋白经 SDS-PAGE电泳后转移至硝酸纤维素膜,用含 1%脱脂奶粉的TBST封闭 30 min。一抗于 4℃孵育过夜,TBST洗涤3次 ×10 min;辣根过氧化物酶标记的二抗于室温孵育 2 h,TBST洗涤 3次 ×10 min。膜与化学发光底物孵育 5 min,经 X线片曝光、显影、定影。显色结果用Total Lab2.0软件进行灰度分析,以 KISS-1、MMP-2与 β-actin的灰度比值表示其蛋白表达量。
1.2.3 KISS-1、MMP-2 mRNA检测方法 采用 RTPCR一步法。RNA提取过程按 Trizol RNA提取试剂盒说明书进行,预期扩增片段大小分别为 191、318、480 bp。 RT-PCR反应条件:50℃ 30 min,94℃2 min,94℃ 40 s,KISS-1为 48℃ 30 s(MMP-2为 60℃30 s),72℃ 1 min,共 30个循环;72℃延伸 10 min。取 5μl用 1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像并进行灰度分析。以 KISS-1、MMP-2 mRNA与 β-actin的灰度比值表示其 mRNA表达量。
1.2.4 统计学方法 采用 SPSS13.0软件。各组间比较采用 F分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组 KISS-1、MMP-2蛋白表达比较 见表1。
表1 各组 KISS-1、MM P-2蛋白表达比较(±s)
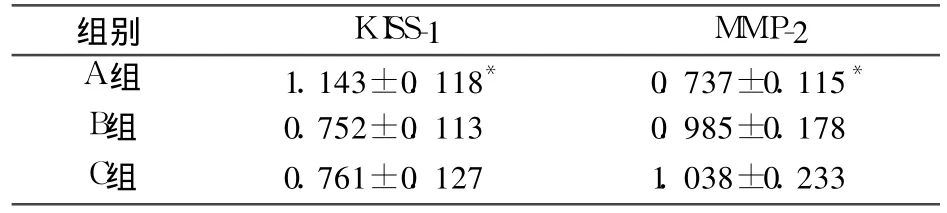
表1 各组 KISS-1、MM P-2蛋白表达比较(±s)
注:与 B、C组比较,*P均 <0.05
组别 KISS-1 MMP-2 A组 1.143±0.118* 0.737±0.115*B组 0.752±0.113 0.985±0.178 C组 0.761±0.127 1.038±0.233
2.2 各组 KISS-1、MMP-2 mRNA的表达比较 见表2。
表2 各组 KISS-1、MMP-2 mRNA表达比较(±s)
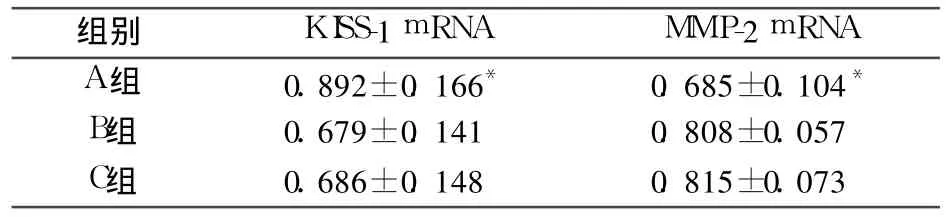
表2 各组 KISS-1、MMP-2 mRNA表达比较(±s)
注:与 B、C组比较,*P均 <0.05
组别 KISS-1 mRNA MMP-2 mRNA A组 0.892±0.166* 0.685±0.104*B组 0.679±0.141 0.808±0.057 C组 0.686±0.148 0.815±0.073
3 讨论
KISS基因定位于染色体 1q32q41区,可以编码由 145个氨基酸组成亲水性蛋白。其羧基末端(61~121)的 54个氨基酸是人孤儿 G蛋白偶联受体(hOT7T175)的配体,被命名为转移抑素,与其受体结合可在人类多种肿瘤中发挥抑制肿瘤转移的作用[2,3],但具体机制尚不明确。
肿瘤细胞需产生和诱导某些蛋白酶类,降解细胞外基质(ECM)及基底膜成分,破坏基底膜的完整性,才能穿越组织屏障向周围浸润和转移[4]。其MMP-2是一种能降解Ⅳ型胶原等多种 ECM成分的蛋白水解酶,其以酶原的形式分泌到细胞外,经活化才有活性。MMP-2表达水平与肿瘤恶性度密切相关,故在肿瘤浸润和转移中发挥重要作用[5]。
食管癌患者早期出现侵袭和转移的生物学特性严重影响了患者的生存率。目前,有关 KISS-1基因在食管癌中表达情况的研究较少,且局限于组织水平[6]。本研究在前期实验的基础上,构建 KISS-1真核表达载体,并将其转染 EC-9706,采用 Western blot、RT-PCR技术首先验证 KISS-1基因转染成功,并检测了 MMP-2蛋白及 mRNA的表达情况。结果显示,转染 KISS-1后 EC-9706细胞中 KISS-1蛋白及mRNA的表达显著增加(P均 <0.05),而 MMP-2蛋白及 mRNA的表达水平却明显降低(P均 <0.05),提示 KISS-1通过降低 MMP-2的表达可能是其抑制食管癌转移的机制之一。有资料报道,KISS-1还可能通过 MAPK信号转导途径、Rac/Cdc42途径及PKC/PLC、Ca2+途径调节肿瘤细胞的增殖、凋亡及抑制肿瘤细胞的转移。因此,需对 KISS-1基因进行深入、广泛的研究。
[1]Lee JH,Miele ME,Hicks DJ,et al.KISS-1,a novel human malignant melanoma metastasis suppressor gene[J].Natl Cancer Inst,1996,88(23):1731-1737.
[2]Zheng HC,Yu AM,Xin Y.Aberrant expression of Kiss-1 and matrix metalloproteinase-9 are closely linked to lymph node metastasis of gastric cancer[J].Chin Med Sci J,2008,23(1):63-64.
[3]Katagiri F,Nagai K,Kida A,et al.Clinical significance of plasma metastin level in pancreatic cancer patients[J].Oncol Rep,2009,21(3):815-819.
[4]Poincloux R,Lizárraga F,Chavrier P.Matrix invasion by tumour cells:a focus on MT1-MMP trafficking to invadopodia[J].J Cell Sci,2009,122(Pt17):3015-3024.
[5]Kenny HA,Lengyel E.MMP-2 functions as an early response protein in ovarian cancer metastasis[J].Cell Cycle,2009,8(5):683-688.
[6]Ikeguchi M,Yamaguchi K,Kaibara N.Clinical significance of the loss of KISS-1 and orphan G-protein-coupled receptor(hOT7T175)gene expression in esophageal squamous cell carcinoma[J].Clin Cancer Res,2004,10(4):1379-1383.

