毛萼乙素抑制人正常及肝癌血管生成的作用研究
班立丽,张慧,罗敏,杨兵兵,韩宏升,潘敏,李玛琳#
(1.昆明医学院第二附属医院药剂科,昆明市 650101;2.昆明医学院省天然药物药理重点实验室,昆明市 650031)
血管生成是指从已存在的微血管上长出新毛细血管的过程。研究表明,血管生成在肿瘤的转移、弥散发展过程中发挥着决定性的重要作用[1]。抗肿瘤血管生成已成为近年来抗肿瘤药研究的新策略。毛萼乙素(ER-B)是从毛萼香茶菜属分离鉴定出来的一种二萜类化合物,已证实具有抑制多种肿瘤细胞株的增殖[2]和抑制正常血管生成的作用。本研究应用人肝癌细胞诱导的鸡胚绒毛尿囊膜血管生成模型以及原代培养的人脐静脉内皮细胞(HUVEC),探讨毛萼乙素对肿瘤诱导的血管生成以及对HUVEC增殖的影响,以进一步证实毛萼乙素对血管生成的抑制作用,为将其开发成抗肿瘤药提供理论依据。
1 材料
1.1 仪器
CO2培养箱(德国Heraeus公司);SW-CJ-IF型净化工作台(苏州安泰空气技术有限公司);电热恒温培养箱(上海沪南科学仪器联营厂);HP-SCANJET4570C型扫描仪(美国惠普公司)。
1.2 试药
毛萼乙素(由中国科学院昆明植物所孙汉董院士提供);反应停(江苏常州制药厂,批号:0501311);灭菌超级无支原体新生牛血清(杭州四季青生物工程材料研究所,批号:040603);胎牛血清(美国Hyclone公司,批号:AJC9872);内皮细胞生长因子(美国Upstate公司,批号:02-102);MTT(美国Sigma公司,批号:1672B45)。
1.3 动物及细胞株
鸡胚,德国海兰鸡种,购自昆明实验养鸡场(动物许可证号:2004C)。
细胞株:HUVEC(原代培养获得,经免疫组化抗-TM标记FITC法鉴定证实);人肝癌SMMC-7721细胞株(购自中国科学院上海生命研究所细胞库)。
2 方法
2.1 试剂的制备
2.1.1 毛萼乙素溶液的制备:称取适量毛萼乙素,用100%的DMSO溶液制备成10 mg·mL-1的溶液(母液),再用无菌生理盐水倍比稀释,用于体外内皮细胞增殖实验;另配制20、10、5µg·mL-1的溶液,用于毛萼乙素作用下的HUVEC生长曲线的测定;另配制10、5、2.5 mg·mL-1的溶液,用于鸡胚尿囊膜实验。
2.1.2 反应停溶液的制备:用无菌的DMSO溶液将适量的反应停配制成12.5 mg·mL-1的贮备液。应用时用RPMI-1640液稀释至所需浓度。
2.2 HUVEC的原代、传代培养及鉴定
HUVEC的原代培养按照Beecken等[3]报告的方法进行。传代培养按常规方法进行,传至3代时备用。最后进行血管内皮细胞鉴定[4]:(1)倒置显微镜观察细胞的形态特点;(2)免疫组化FITC法鉴定内皮细胞。
2.3 毛萼乙素对HUVEC增殖的影响
采用改良MTT法:取对数生长期HUVEC,消化后以每孔4×104个细胞接种于96孔板,每孔90 μL,继续培养24 h,然后加入不同浓度的毛萼乙素,使其终浓度达30、10、3、1、0.3、0.1µg·mL-1。分别设30%、10%、3%、1%、0.3%、0.1%毛萼乙素组,DMSO溶剂对照组和0.9%生理盐水阴性对照组。连续培养2 d后加入MTT溶液,继续培养4 h,加入三联液后12~16 h内以自动酶标仪测量570 nm波长处吸光度(OD)值,计算细胞生长抑制率。抑制率计算公式如下:细胞存活率(%)=加药孔的实际OD值/阴性对照孔的OD值;细胞抑制率(%)=100%-细胞存活率。用GWBA-SIC软件计算其IC50值及95%可信区间。
2.4 毛萼乙素对HUVEC生长的影响
采用文献[5]方法并适当改进。取对数生长期HUVEC,消化后以每孔1×104个细胞浓度接种,其中含20%胎牛血清在培养箱培养。于第1、2、3、4、5、6天各取3孔细胞,用改良MTT法测量570 nm波长处OD,以平均值绘制生长曲线,观察HUVEC生长的情况。
2.5 毛萼乙素对鸡胚尿囊膜(CAM)人肝癌血管生成的影响
首先复制CAM人肝癌血管生成模型[6]。实验分为5组,即阴性对照、反应停(50µg·egg-1)及毛萼乙素高、中、低剂量(100、50、25 µg·egg-1)组。选择已接种肝癌细胞的成瘤鸡胚,在成瘤处放置明胶海绵,按组各加10µL试液于明胶海绵上,孵育到第5天。取出鸡胚,观察各组存活鸡胚移植瘤生长的情况,以肿瘤直径2 mm为成瘤阳性,分别记录结果。然后以丙酮固定CAM,剪下平铺于平皿中,用扫描仪扫描,Imagetool软件处理图像,计算所选区域血管面积、血管数目。按下式计算血管生成抑制率:抑制率(%)=(对照组血管定量的数值-受试组血管定量的数值)/对照组血管定量的数值×100%。
2.6 统计学方法
3 结果
3.1 HUVEC的原代培养、传代及鉴定
3.1.1 HUVEC的原代培养与传代:HUVEC接种后,大部分细胞呈贴壁生长。早期细胞较小,呈多角形、纺锤状。48~72 h后生长加快,逐渐生长成梭形,呈鱼贯状相连,间有漩涡状排列。7~10 d后细胞长满,相互嵌合为单层铺路石状。传代培养后细胞4 h内贴壁生长,生长迅速。HUVEC在光镜下的形态见图1。
3.1.2 HUVEC的鉴定:采用免疫组化FITC法对HUVEC进行鉴定。未经抗体标记的阴性对照中,偶见细胞上绿色斑点散发的荧光,细胞轮廓不完整。经抗TM免疫荧光标记的内皮细胞胞浆中有黄绿色的荧光,荧光染色强阳性,胞核呈蓝色,细胞轮廓较完整。HUVEC经FITC标记后在荧光显微镜下的形态见图2。

图2 HUVEC经FITC标记后在荧光显微镜下的形态(×400)A.阴性对照组;B.经FITC标记后的HUVECFig 2 Morphology of HUVEC stained by FITC under fluorescence microscope(×400)A.negative control group;B.HUVEC stained by FITC
3.2 毛萼乙素对HUVEC增殖的影响
用MTT试验检测6个浓度毛萼乙素对HUVEC增殖的影响,结果见表1。

表1 毛萼乙素对人脐静脉内皮细胞增殖的影响Tab 1 Effect of eriocalyxin B on the proliferation of HUVEC
从表1中可看出,毛萼乙素对HUVEC增殖有明显的抑制作用,IC50=7.27 μg·mL-1,在所测试的范围内呈现出量效依赖关系。
3.3 毛萼乙素对HUVEC生长影响的时效关系
毛萼乙素对第3代HUVEC作用0、24、48、72、96、120 h,观察HUVEC的增殖情况。5µg·mL-1的毛萼乙素要作用4 d后才对HUVEC生长有抑制作用(P<0.05),抑制率为30.3%。随着浓度的提高,毛萼乙素起效的时间提前。毛萼乙素20µg·mL-1时,在作用24 h后抑制率达45.9%(P<0.05);在10 µg·mL-1时,作用24 h后抑制率达25%,48 h后达43.9%(P<0.05)。
3.4 毛萼乙素对人肝癌移植瘤诱导的CAM血管生成的影响
在人肝癌CAM血管生成模型上,观察不同浓度毛萼乙素对人肝癌移植瘤诱导的肿瘤血管生成的影响。结果,明胶海绵阴性对照组周围血管良好,呈树枝状分布,分枝适中;加有毛萼乙素100µg·egg-1的明胶海绵周围血管数目显著少于阴性对照组,且血管变细,血管形态异常,尤其是小血管数目显著减少,而且肿瘤组织周围可见部分白色无血管区。经剂量分别为100、50、25 µg·egg-1的毛萼乙素处理后,CAM人肝癌移植瘤诱导的血管生成受到了不同程度的抑制,抑制效应呈剂量依赖性(r=-0.945,P<0.01);阳性对照反应停在50 µg·egg-1时对肝癌细胞诱导的血管生成也有显著的抑制作用(P<0.05),抑制率为41.41%;在低剂量时,毛萼乙素对血管生成的抑制作用低于反应停(P<0.05);剂量在100 µg·egg-1时,毛萼乙素对血管生成的抑制作用优于反应停(P<0.05)。不同浓度毛萼乙素对人肝癌移植瘤诱导的CAM血管生成的影响见表2。
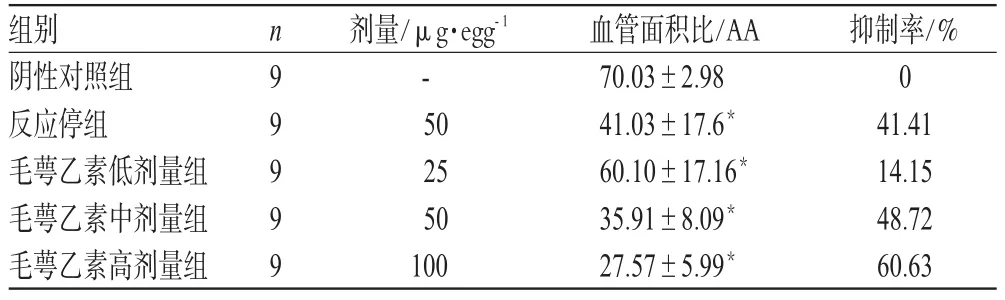
表2 不同浓度毛萼乙素对人肝癌移植瘤诱导的CAM血管生成的影响Tab 2 Inhibitory effect of eriocalyxin B at different concentrations on chicken chorioallantoic membrane angiogenesis induced by human hepatocellular carcinoma
4 讨论
有研究表明[7],在肿瘤组织中,一个血管内皮细胞可支持50~100个肿瘤细胞的生长,并且肿瘤细胞的数目与内皮细胞的数目密切相关。因此,在筛选有效的肿瘤血管生成抑制剂时,监测药物对内皮细胞增殖的作用尤为重要。目前,抑制新生血管生长的大多数药物主要以血管内皮细胞为靶点。
内皮细胞的选择对筛选血管生成抑制剂也是十分重要的。相对而言,直接从脐带中分离、培养HUVEC来源充足、取材及操作方便,研究结果更真实地反映人正常血管生成的情况,因而许多学者都选择原代培养的HUVEC来研究血管生成。本研究以第3代HUVEC为对象,观察毛萼乙素对HUVEC增殖的影响。研究中观察到毛萼乙素在0.1~30 μg·mL-1范围内,对HUVEC增殖的抑制作用随剂量的增加逐步增强,呈现良好的量效关系和时效关系。有报道雷公藤甲素在0.05 μg·mL-1时就明显抑制HUVEC的增殖,是HUVEC增殖的强抑制剂[5]鱼软骨多糖在62.93 mg·mL-1时对HUVEC的增殖有抑制作用[8];本课题组前期的研究发现Endostatin的一个有效片段Kringle5在11.85 μg·mL-1时明显抑制内皮细胞的增殖,抑制率达50%。比较而言,毛萼乙素的抑制强度大致为中等水平。
CAM是血管生成的经典实验模型之一,由于具有方法简便、易观察、价廉等优点,是目前常用的在体模型。该模型能较好的模拟体内肿瘤诱导的血管生成过程,用于筛选血管生成抑制剂时能更真实地反映药物对肿瘤血管生成的抑制作用。
本研究分别选取体内、体外2种典型的血管生成实验方法,探讨了毛萼乙素对血管生成的影响。结果证实,毛萼乙素在体外可抑制HUVEC的增殖,在体内可抑制人肝癌鸡胚移植瘤诱导的血管生成,其作用机制可能是通过抑制血管内皮细胞的增殖影响肿瘤血管的生长。然而,毛萼乙素除了直接通过抑制内皮细胞的生长来抑制肿瘤诱导的血管生成以外,是否可能还通过其他途径发挥其抑制血管生成的作用?其次,毛萼乙素在抑制血管生成的过程中是否会影响正常组织?这些问题将是今后研究的方向。
[1]Agnantis NJ,Goussia AC,Batistatou A,et al.Tumor marker in cancer patients:an update of their prognostic significance PartⅡ[J].In Vivo,2004,18(4):481.
[2]孙汉董,许云龙,姜 北,等.香茶菜属植物二萜化合物[M].第1版.北京:科学出版社,2001:103.
[3]Beecken WD,Engl T,Judith H,et al.Clinical relevance of serum angiogenic activity in patients with transitional cell carcinoma of the bladder[J].J Cell Mol Med,2005,9(3):655.
[4]Chen H,Wu L,Liu X.Effect of laminar shear stress on IL-8 mRNA expression in endothelial cells[J].Biorheology,2003,40(6):53.
[5]丁 怡,张 杰,赵庆亮,等.雷公藤甲素对血管内皮细胞尿激酶型纤溶酶原激活物表达的影响[J].癌症,2005,24:801.
[6]Walter JM,Mark LK,Angela P,et al.A novel technique for quantifying changes in vascular density,endothelial cell proliferation and protein expression in response to modulators of angiogenesis using the chick chorioallantoic membrane(CAM)assay[J].Journal of Clayton Ranslational Medicine,2004,2(1):4.
[7]Douglas BC,Elanor SP.Endothalial cells in physiology and in the pathophysiology of vascular disorders[J].Blood,1998,91(10):3527.

