基于分子印迹聚合膜的胆固醇丝网印刷生物传感芯片
薛茜男 边 超 任振兴 孙楫舟 卞贺明 韩泾鸿 夏善红(中国科学院电子学研究所传感技术联合国家重点实验室北方基地 北京 100190 )(中国科学院研究生院 北京 100039)
1 引言
分子印迹聚合物膜(Molecular Imprint Polymers,MIPs)是一种可以对目标分子特异性识别的仿生生物膜。以目标分子为模板,与功能单体接触并通过诱发聚合反应,围绕模板形成聚合物,其内部分布有大量模板分子的印迹空穴,这些空穴与模板分子在空间结构、结合位点等方面高度匹配。该仿生膜制作简单,高稳定性,且适于批量生产[1-3]。自1987年Tabushi首次用MIPs物作为敏感材料,对维生素进行检测以来,以 MIPs作为识别元件的仿生生物传感器引起了人们的关注[4-8]。与生物传感器相比,MIPs仿生生物传感器具有高稳定性、高特异性、价格低廉的优势,将在医学检测领域发挥重要的作用。
生物传感芯片按照换能方式分类主要有光学型[9,10]、热敏型[11]、压电型[12]、电化学型[13]等。其中电化学型具有灵敏度高、制备简便、成本低、易于微型化、适合现场检测的特点,成为生物传感器研究的热门方向。以 MIPs作为识别元件研制新一代电化学传感器的报道始于1993年[14,15],并呈现逐年递增的趋势。然而相对于MIPs的研究而言,MIPs电化学传感器的研究进展还比较缓慢。探索合适的印迹基质和印迹方法以满足电化学传感器对识别元件的要求,是研究的核心内容。
丝网印刷工艺在电子、信息等产品的生产过程中已经得到了非常广泛的应用。诸如产品外壳的装饰、电路、厚膜集成电路、太阳能电池、电阻、电容、压电元件、光敏元件、热敏元件、液晶显示元件等的印刷,在生产过程中都不同程度地采用了丝网印刷工艺。在生物传感芯片制备方面,丝网印刷工艺也有很多应用,特别是采用丝网印刷技术制作电化学生物传感电极[16,17]。电极的大小可以改变,可以微型化和集成化,因此,属于生物芯片制作技术之一。微电极阵列制备技术中,人们采用厚膜网版印刷技术,使电极小型化,随着多种先进的成膜技术的出现并使其与光刻技术相结合,金属薄膜微电极有了很快的发展。
本文以丝网印刷工艺制备的金电极作为工作电极基底,十二烷基硫醇为印迹基质,以胆固醇为模板分子,采用自组装单层膜技术制备分子印迹膜,研制 MIPs仿生电化学生物传感芯片。文中对该MIPs仿生电化学传感芯片的制备方法、检测方法以及性能等进行了介绍。
2 实验
2.1 试剂与仪器
胆固醇、十二烷基硫醇、铁氰化钾、乙醇、丙酮购自北京化学试剂公司。丝网印刷电极委托深圳市兴森快捷电路科技股份有限公司加工。工作电极修饰过程中的电化学特性以及传感芯片对不同浓度胆固醇响应的计时电流特性由美国 Gamry reference 600电化学工作站检测。
2.2 MIPs电化学传感芯片的制备
2.2.1 电化学传感芯片的电极系统 采用丝网印刷技术在柔性聚酰亚胺基底上制备厚度为(300 nm)金厚膜电极作为工作电极。所采用的金浆材料粒径在50 nm以下,电极敏感表面面积4 mm2。以溅射方法制备铂平面电极作为对电极。金电极与铂电极面对面平行放置并固定二者的位置。参比电极选用饱和甘汞电极。上述三电极系统形成电化学传感芯片。
2.2.2 金电极表面胆固醇分子印迹膜的制备 将胆固醇与十二烷基硫醇溶于乙醇中配置成混合溶液,其中胆固醇含量1%和十二烷基硫醇浓度100 μM,待用。将金电极表面用丙酮、乙醇和去离子水依次超声清洗,并用氮气吹干。再将表面清洁的金电极置于配好的胆固醇和十二烷基硫醇的混合溶液中静置 12小时。12小时后用乙醇对金电极进行清洗脱膜处理,去除分子印迹膜中的胆固醇,完成胆固醇分子印迹膜在金电极表面的制备。清洗脱膜处理的具体方法为:首先用乙醇清洗金电极,之后将电极在乙醇中浸泡45 min,这一过程交替进行三次。
3 结果与讨论
3.1 胆固醇MIPs电化学传感芯片性能及测试结果
3.1.1 胆固醇MIPs电化学传感芯片电极表面形貌
用扫描电子显微镜(SEM)对比溅射制备的金电极和丝网印刷制备的金厚膜电极的表面微观形貌。从图1(a)和图1(b)中可以看出,溅射工艺制备的金电极表面更为致密,而丝网印刷技术制备的金电极表面相对粗糙,表现出分布均匀的纳米尺度的凸凹结构,直径在50 nm左右。丝网印刷技术制备的金电极表面所呈现出的有规律的参差结构,将增加平面电极的比表面积,使得在同样区域的电极表面上具有更多有效的反应表面,从而有利于胆固醇分子印迹膜的修饰,增强传感芯片的反应信号。
对分子印迹自组装膜修饰的丝网印刷金电极表面进行微观形貌分析,如图2所示,胆固醇分子印迹膜呈现出分布均匀的多孔状结构,使得传感器表面信号进一步放大。分析原因认为这种结构是由丝网印刷金厚膜电极表面所表现出的纳米尺度的凸凹结构所引起。 且丝网印刷技术制备的纯金电极表面修饰的胆固醇分子印迹膜分布均匀,有较好的一致性。

图1 不同工艺制备金电极表面SEM图

图2 胆固醇分子印迹膜修饰后的丝网印刷电极表面SEM图
3.1.2 胆固醇分子印迹膜制备过程的电化学性能表征 采用循环伏安法对金电极修饰过程中不同电极表面的电化学特性进行表征,测试溶液为铁氰化钾溶液(浓度 5 mM),电压扫描范围-300 mV~+500 mV,扫描速率50 mV/s。测试结果如图3所示。从图3可看出,裸金电极表面呈现出相对较高的氧化还原峰电流,如曲线(a)所示。经胆固醇和十二烷基硫醇混合溶液浸泡的金电极,氧化还原峰消失,如曲线(b)所示,说明胆固醇和十二烷基硫醇单分子层组装在了金电极的表面,阻碍了铁氰化钾离子探针到电极表面的反应。当电极经乙醇脱膜后,如曲线(c)所示,电极的循环伏安曲线又呈现出氧化还原峰,说明胆固醇从分子印迹膜中脱出,暴露出印迹空穴位置,从而使铁氰化钾离子探针能够到达电极表面发生反应。将脱膜电极在含有50 nM胆固醇的乙醇溶液中浸泡十分钟之后,再对其循环伏安特性进行考察,如曲线(d)所示。与脱膜后的电极相比,电极的氧化还原峰降低,说明胆固醇占据了部分印迹空穴位置,阻碍了电极表面电子的传递。以上测试结果验证了采用自组装的方法在金电极表面进行胆固醇分子印迹膜制备的有效性。
3.1.3 胆固醇 MIPs电化学传感芯片对胆固醇溶液的浓度响应及时间响应特性 将脱膜后的电极置于铁氰化钾溶液中,采用计时电流法记录其电流响应。之后将电极依次在含有50 nM~700 nM不同浓度胆固醇的乙醇溶液中浸泡10 min,并采用计时电流法记录每次浸泡后电极的电流响应。可以看出,电极在不同浓度的胆固醇溶液里的电流响应呈一定的梯度变化(图4)。
观察脱膜后的胆固醇传感芯片对不同浓度胆固醇溶液的响应时间。图4表明传感芯片在很短时间内即达到了稳态,在60 s之内即获得了稳定的电流响应。
记录传感芯片在检测时间为 200 s时的电流值作为其电流响应值。如图 5所示,传感芯片在 50 nM-700 nM 浓度区间电流响应差值与胆固醇溶液浓度(C)的对数值呈现出较好的线性关系。在50nM~700 nM 浓度范围内,灵敏度为-4.94µA /[log(C)],线性相关系数为0.994。
3.1.4 胆固醇 MIPs电化学传感芯片的准确性和一致性 用相同方法两个批次制备6支胆固醇传感芯片,每批次3支,测试300 nM胆固醇的电流响应。从表 1中可以看出,传感芯片测试准确度分别为99.56%和94.48%,并且相对标准偏差保持在6.15%以下的较低水平。
3.2 结果分析及应用价值
3.2.1 纳米颗粒的表面效应 球形颗粒的比表面积(表面积/体积)与直径成反比。随着颗粒直径变小,比表面积将会显著增大,这就是表面效应。当颗粒的直径达到纳米水平,这种表面效应会非常显著。该传感芯片电极表面由丝网印刷工艺制备,扫描电镜图显示出其表面比起溅射工艺制备金电极表面有明显的纳米级的凸凹结构,且具有很好的均匀一致性。
以十二烷基硫醇为印迹基质,以胆固醇为模板分子,采用自组装单层膜技术制备分子印迹膜,在平面电极上只形成2维结构。当在电极表面纳米级凸凹的3维微结构之上自组装分子印迹膜,形成均匀一致的多孔球状分布,使得纳米级表面效应放大,金厚膜电极表面的反应位点呈指数倍增多。这是传感芯片增强响应信号,显示出高灵敏度和稳定性的关键原因。
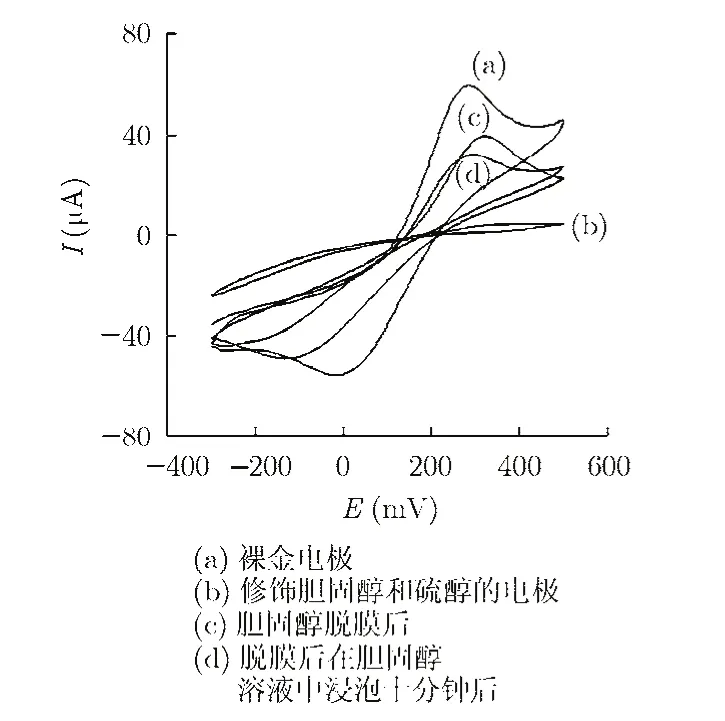
图3 金电极表面修饰过程中电极的循环伏安曲线图
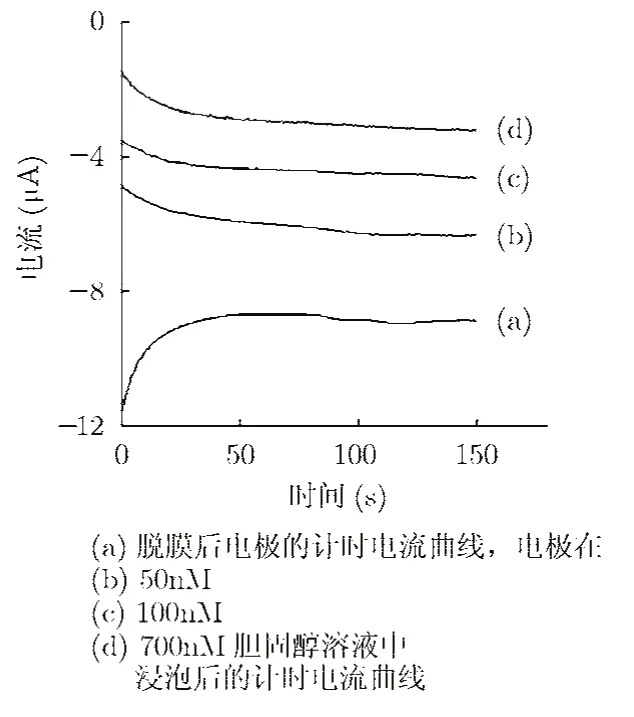
图4 胆固醇MIPs电化学传感芯片对不同浓度胆固醇检测的计时电流曲线
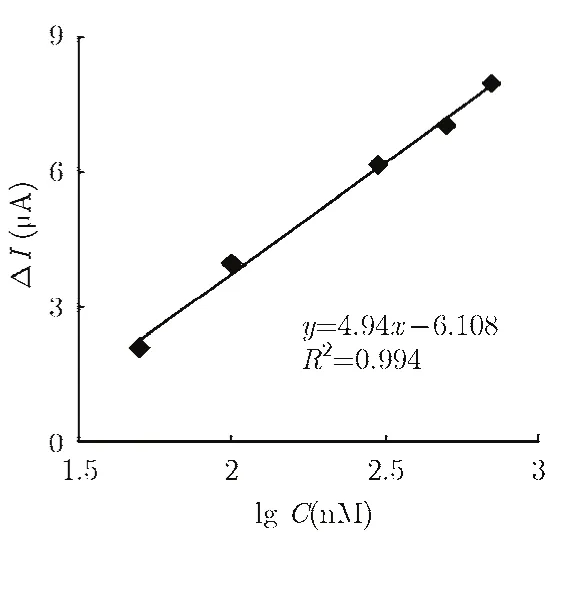
图5 胆固醇MIPs电化学 传感芯片浓度响应曲线
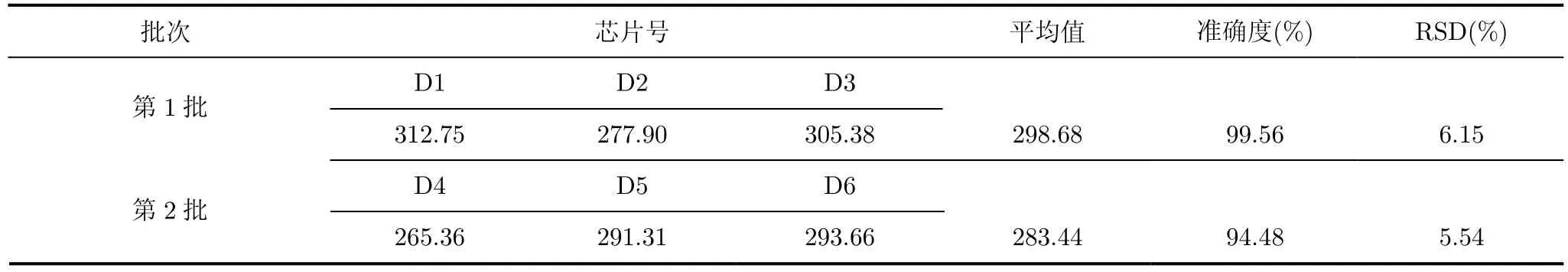
表1 胆固醇传感芯片的准确度和标准偏差(标准浓度 300 nM)
3.2.2 电流响应与浓度关系 分析传感芯片的电流响应随浓度的增加而减小的原因认为,脱膜后的自组装单分子硫醇分子印迹膜暴露的印迹空穴位点最多,有利于铁氰化钾离子在电极表面的反应,因此电流响应值最高。当电极在胆固醇溶液中浸泡后,由于胆固醇与分子印迹膜相结合,填补了分子印迹膜中的空穴位置,阻碍了铁氰化钾离子到电极表面的反应,因而电流响应有所降低。随着胆固醇浓度的增加,分子印迹膜结合的胆固醇的数量增加,印迹空穴的数量减少,进一步阻碍了铁氰化钾离子到电极表面的反应,因此电流响应随着胆固醇浓度的增加而降低。
4 结束语
MIPs电化学传感芯片在环境监测、食品检验、医疗以及国防等领域都具有很好的应用前景。丝网印刷工艺制备的金厚膜电极,工艺简便成本低廉,同时由于其表面的均匀空隙,响应表面比率增大,使传感芯片获得了更好的信号响应,以此为基底研制传感器,在产业化中具有较强的优势。本文以丝网印刷技术制备的金厚膜电极作为工作电极,采用自组装技术,以十二烷基硫醇作为印迹基质,研制对胆固醇进行检测的分子印迹膜以及电化学仿生生物传感芯片。本文对电极表面分子印迹膜表面形貌、制备过程的电化学特性、传感芯片时间响应特性以及该传感芯片对胆固醇的浓度响应特性进行了测试和分析,并且初步测试了传感芯片对胆固醇浓度检测的准确性和标准偏差。研究证明了金厚膜电极为基底进行自组装分子印迹的可行性。该胆固醇传感芯片性能优良,具有较好的准确性和稳定性,在胆固醇的批量检测方面将具有非常好的应用潜能。
[1] Hsieh R Y, Tsai H A, and Syu M J. Designing a molecularly imprinted polymer as an artificial receptor for the specific recognition of creatinine in serums.Biomaterials, 2006, 27(9):2083-2089.
[2] Shinkai S and Takeuchi M. Molecular design of synthetic receptors with dynamic, imprinting, and allosteric functions.Biosensor&Bioelectronics, 2004, 20(6): 1250-1259.
[3] Hou Chang-jun, Liu Xiao-juan, and Huo Dan-qun,et al..Application of molecular imprinting technique in field of organophosphorus pesticide detection.Transducer and Microsystem Technologies, 2009, 28(4): 5-8.
[4] Tabushi I, Kurihara K, and Naka K,et al.. Supramolecular sensor based on SnO2electrode modified with octadecylsilyl mono1ayer having molecular binding sites.Tetrahedron Letter, 1987, 28(37): 4299-4302.
[5] Dickert F L, Lieberzeit P, and Tortschanoff M. Molecular imprints as artificial antibodies-a new generation of chemical sensors.Sensors and Actuators B:Chemical, 2000, 65(1-3):186-189.
[6] Turnera N W, Wrighta B E, Hladya V, and Brittb D W.Formation of protein molecular imprints within Langmuir monolayers: a quartz crystal microbalance study.Journal of Colloid and Interface Science, 2007, 38(1): 71-80.
[7] Vallano P T and Remcho V T. Highly selective separations by capillary electrochromatography: molecular imprint polymer sorbents.Journal of Chromatography A, 2000, 87(1-2):125-135.
[8] Matsushita T, Nishikawa T, Yamashita H, Kishimoto J, and Okuno Y. Development of new single-mode waveguide surface plasmon resonance sensor using a polymer imprint process for high-throughput fabrication and improved design flexibility.Sensors and Actuators B:Chemical, 2008, 129(2):881-887.
[9] Baldini F, Carloni A, Giannetti A, Porro G, and Trono C. An optical PMMA biochip based on fluorescence anisotropy:Application to C-reactive protein assay.Sensors and Actuators B:Chemical, 2009, 139(1): 64-68.
[10] Suárez-Rodríguez J L and Díaz-García M E. Flavonol fluorescent flow-through sensing based on a molecular imprinted polymer.Analytica Chimica Acta, 2000, 405(1-2):67-76.
[11] Harborn U, Xie B, Venkatesh R, and Danielsson B.Evaluation of a miniaturized thermal biosensor for the determination of glucose in whole blood.Clinica Chimica Acta, 1997, 267(2): 225-237.
[12] Alava T, Berthet-Duroure N, and Ayela C,et al.. Parallel acoustic detection of biological warfare agents surrogates by means of piezoelectric immunochips.Sensors and Actuators B:Chemical, 2009, 138(2): 532-538.
[13] Rodrigues P N, Sakai Y, and Fujii T. Cell-based microfluidic biochip for the electrochemical real-time monitoring of glucose and oxygen.Sensors and Actuators B:Chemical, 2008,132(2): 608-613.
[14] Hedborg E, Winquist F, Lundström I, Andersson L I, and Mosbach K. Some studies of molecularly-imprintedpolymer membranes in combination with field-effect devices. Sensors and actuators A:Physical, 1993, 37-38(6-8): 796-799.
[15] Dickert F L and Hayden O. Molecular imprinting in chemical sensing.TrAC Trends in Analytical Chemistry, 1999, 18(3):192-199.
[16] Gilmartin M A T, Hart J P, and Patton D T. Prototype,solid-phase, glucose biosensor.Analyst, 1995, 120(7):1973-1981.
[17] Palchetti I, Cagnini A, Carlo M D, Coppi C, Mascini M, and Turner A P F. Determination of anticholinesterase pesticides in real samples using a disposable biosensor.Analytica Chimica Acta, 1997, 337(3): 315-321.

