半夏内生菌的分离培养与鉴定
黄筱钧,唐由凯,杜银香,袁 杰,胡如华,尹文仲
1.湖北民族学院医学院(湖北 恩施 445000)
半夏Pinelliaternate(Thunb.) Breit为天南星科半夏属植物,其干燥块茎含有多种有效成分,其中包括生物碱、谷甾酸、多糖、氨基酸、挥发油、半夏蛋白及无机元素等,药用历史悠久,首载于《神农本草经》,具有降逆止呕、燥湿化痰、消痞散结等功效,是中国的传统中药[1~3]。湖北恩施有华中药库之称,盛产半夏。近年来随着半夏的应用越来越广泛和人们对其野生资源的过度开采,以及化肥、农药及化学杀菌(虫)剂的广泛使用,严重破坏了半夏生长的内外微生态环境,根腐病的发生十分严重,使得半夏的产量下降,品质降低。虽然,一些半夏种植基地采用杀菌、轮作等方法,但实际效果并不十分理想,必须寻找新的解决方法[4]。近年来,由于微生态学的兴起,人们试图应用生态学原理去研究生物的生存环境(宏观和微观环境)及其相互影响[5]。植物微生态学就是其中的一个重要分支,它是研究植物内生菌与植株相互关系的科学[6]。本文从半夏植株内分离培养出内生菌,通过革兰氏染色镜检和生化反应实验证明其符合地衣芽胞杆菌的特征,对研究、制备半夏益生菌制剂将有着重要意义。
1 材料与方法
1.1样本采集植物来源:半夏植株采自湖北省建始县红岩寺镇半夏种植和研究基地。样本采集方法:选择半夏种植地生长好、无倒伏植株,并进行编号、登记。
1.2仪器设备和试剂超净工作台、光学显微镜、高压蒸气灭菌锅、水浴锅、振荡器、培养箱、革兰氏染色液一套。
1.3培养基配方:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂25 g、蒸馏水1000 ml。培养基制备方法:将琼脂加热化开,加牛肉膏和蛋白胨,再加热溶解调pH值至7.4,分装试管置高压灭菌锅内在0.1 Mpa压力下灭菌30 min,冷却后制成固体培养基和液体培养基(去琼脂)备用。
1.4 方法
1.4.1 样品前处理及接种 分别取新鲜半夏的块茎、株芽、茎三类标本先用自来水冲洗24 h,后进行表面消毒处理:无菌水冲洗3遍,0.5%的漂白粉液表面消毒5 min,再用无菌水冲洗4次。取组织10 g无菌操作剪碎,加入40 ml无菌水和装有10粒灭菌玻璃珠的三角烧瓶中,经300r/min转振荡10 min,静置30 s,用灭菌吸管取5 ml上清液注入灭菌试管中备用,80℃水浴锅内恒温处理20 min,用接种环取一环上清液接种至牛肉膏蛋白胨固体培养基和液体培养基,35℃下培养24~72 h后观察结果。
1.4.2 内生菌的分离 经24~72 h培养后,挑选不同类型的菌落涂片,革兰氏染色,油镜观察,初步确定目的菌,再纯化培养。
1.4.3 生化反应 对分离子的内生菌进行生化反应实验。
2 结果
2.1培养特性半夏的块茎、株芽、茎分别经前处理后再各自接种于牛肉膏蛋白胨固体培养基和液体培养基中,经培养后三类标本在固体培养基上培养特征如下:菌落呈圆形灰白色光滑,直径3~4 mm,中央凹陷,边缘隆起,呈肚脐状(见图1);在液体培养基中呈混浊状,培养24 h后形成沉淀,沉于管底,上液澄清。在血平板上生长24 h无溶血环。
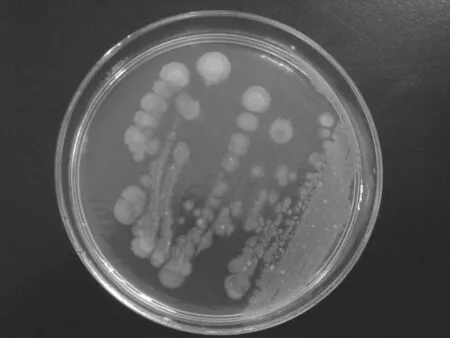
图1 菌落形态特征的照片图
2.2涂片染色镜检三类标本分别进行涂片、染色和镜检。
2.2.1 涂片染色 三类标本分别进行涂片,方法如下,用灭菌接种环在菌落边缘蘸取少许菌体,置盛有10 ml无菌生理盐水的试管内振荡,制成细菌悬浮液,再用无菌小吸管取细菌悬液2滴,加在洁净玻片上,使菌液自然干燥后,火焰固定。三张标本片分别进行革兰氏染色。
2.2.2 光学显微镜检查 三张标本片油镜检查结果相同。菌体呈直杆状,成链状排列,菌体长5~10 μm,宽1~2 μm,革兰氏染色阳性呈紫色,细菌培养24 h后染色镜检无芽胞形成,培养48 h后才可见芽胞形成,芽胞呈柱状,中生,无荚膜。
2.3生化反应结果对分离出的内生菌进行较详细的生化反应实验,结果见表1。

表1 内生菌生化反应实验结果
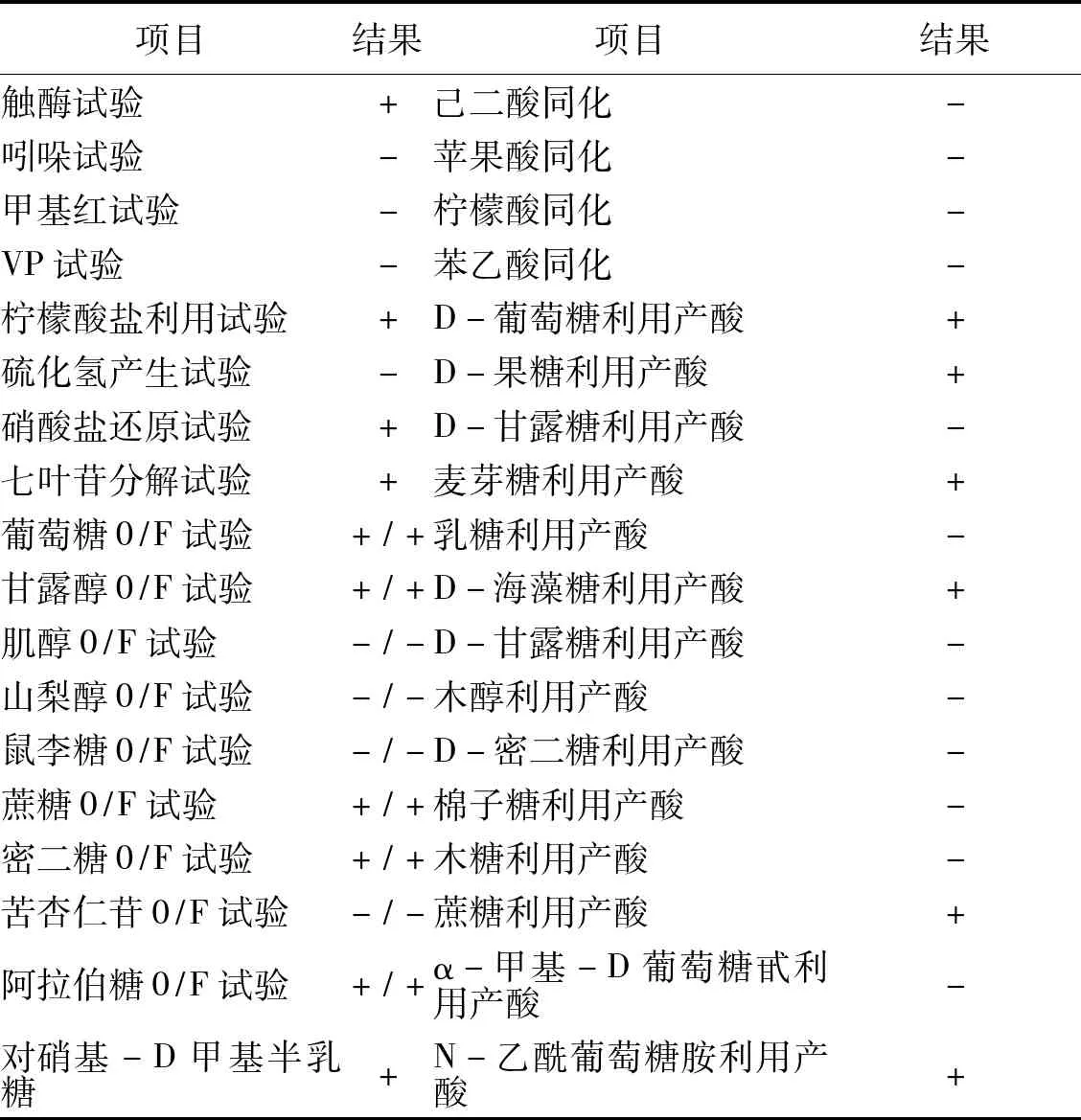
续表1
2.4鉴定根据以上试验结果,所分离出的半夏内生菌菌株符合地衣芽胞杆菌的特征。
3 讨论
3.1本研究的理论基础近年来微生态学研究发展十分迅速,植物微生态学是其中重要分支,它是研究植物内生菌与植物相互关系的一门学科[4]。植物内生菌是指其生活史的一定阶段或整个阶段都生活在健康植物各种组织器官内部或细胞间隙的微生物。目前,从广义上来讲,植物内生菌泛指所有生活在植物内部的微生物[7]。目前发现内生菌的种类主要有:内生真菌、内生细菌和内生放线菌[8]。其中芽胞杆菌就是植物体内的重要内生菌,它们不仅可存在于植物内部,也常见于土壤中[6]。
3.2菌株符合地衣芽胞杆菌特征本试验所分离的半夏内生菌菌株符合地衣芽胞杆菌的特征,依据如下:半夏植株样品经自来水冲洗,漂白粉表面消毒,80℃水浴锅内恒温处理20 min后绝大部分无芽胞菌均被杀死,剩下的是耐热的芽胞菌;在固体培养基上,菌落呈圆形,灰白色,光滑,直径3~4 mm,边缘隆起,中央凹陷,呈肚脐状,在液体培养基中,培养24 h后形成沉淀,沉于管底,上液澄清;培养物涂片再经革兰氏染色后油镜观察:菌体呈直杆状,成链状排列,菌体长5~10 μm,宽1~2 μm,革兰氏染色呈阳性,菌体紫色,细菌经48 h培养后可见芽胞形成,位于菌体中央(中生)芽胞呈柱状。依据文献确定该菌株为地衣芽胞杆菌[6]。
3.3半夏有益内生菌研究的意义自从半夏从野生转家生之后,由于化肥、农药及化学杀菌(虫)剂的使用,严重破坏了半夏生长的内外微生态环境,使半夏易患根腐病、抗性下降等,半夏亩产量下降,品质降低。究其原因,是半夏微生态平衡失调所造成,虽然国内外许多学者从事植物(主要是农作物)微生态学的研究,但目前为止,还未见半夏微生态学研究的报道。因此,应用微生态学原理和方法来研究半夏的微生态平衡及微生态失调,并且利用从半夏植株体内分离出来的有益内生菌制成半夏益生菌制剂,再将半夏益生菌回归原生境,对半夏进行微生态防护,以达到对半夏防病治病和植物保健的功效,从而提高半夏的产量和品质[9]。下一步将进行半夏菌株的安全试验、生物拮抗试验、菌液的制备、室内生物测定和田间生物测定等,使半夏益生菌早日问世,为建立半夏的优质高产种植技术奠定基础。
[参考文献]
[1] 肖培根.新编中药志(第1卷)[M].北京:化学工业出版社,2002:372.
[2] 冉懋雄.名贵中药材绿色栽培技术[M].北京:科学技术文献出版社,2002:12.
[3] 国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2005:78.
[4] 胡琴.半夏研究和开发最新进展及其思考[J].西南科技大学报,2005,20(1):63.
[5] 康白.微生态学原理[M].大连:大连出版社,2002:38.
[6] 康白.微生态学[M].大连:大连出版社,1998:41.
[7] 李强.植物内生菌的开发与研究进展[J].生物技术通报,2006,3:33.
[8] 文才艺.植物内生菌研究进展及其存在的问题[J].生态学杂志,2004,23(2):86.
[9] 孙力军,陆兆新.植物内生菌抗菌活性物质研究进展[J].食品与发酵工业,2005,31(2):78.

