用于筛选组蛋白去乙酰化酶抑制剂细胞模型的验证
杜芝燕,王 妍,徐元基,于晓妉
(军事医学科学院基础医学研究所病理生物学实验室,北京 100850)
组蛋白是构成人体染色质基本成分 核小体的重要组成部分,由DNA双链缠绕组蛋白异八聚体构成核小体。研究表明,在组蛋白的赖氨酸尾部存在着多种修饰,包括磷酸化、甲基化、乙酰化及泛素化等,这些修饰对于基因的转录和表达具有重要的调控作用[1]。已知细胞内存在的2种酶类参与了组蛋白乙酰化的调节,即可以增强乙酰化的组蛋白乙酰转移酶及可以抑制乙酰化的组蛋白去乙酰化酶(histone deacetylase,HDAC)。在正常情况下,这2种酶活性之间的动态平衡保证了组蛋白的乙酰化和去乙酰化状态的调节。当组蛋白呈高乙酰化状态时,核小体的空间构象较为开放,利于各种转录因子接近DNA,促进基因转录。而组蛋白的去乙酰化则使DNA与组蛋白之间呈紧密结合状态,不利于基因转录,导致一些基因的表达关闭[2]。目前的研究表明,肿瘤组织中组蛋白呈去乙酰化状态,这种状态介导基因转录抑制,促进肿瘤的发生。而采用HDAC抑制剂增强组蛋白的乙酰化,则可以活化相应基因的表达,抑制肿瘤增殖,阻断细胞周期,促进细胞分化或凋亡[3]。已经证实,HDAC抑制剂在多种肿瘤细胞系及动物移植瘤模型中均具有良好的肿瘤杀伤和抑制肿瘤转移的活性,且对正常细胞毒性较低,这种高效低毒的作用特点使其成为颇为理想的抗肿瘤新药[4]。目前数种HDAC抑制剂,如缩酯环肽(depsipeptide)FK228、N-辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)和 MS275等在美国已经进入Ⅱ期临床试验。该类化合物种类较多,大多由植物及微生物代谢物中提取,从已有的单体化合物库或已知中草药有效成分中寻找新型HDAC抑制剂需要快速的筛选体系。本研究旨在验证由本实验室建立的药物筛选细胞模型[5]的可靠性及适用性。
1 材料与方法
1.1 药物和试剂
FK228和曲古抑菌素A(trichostatin A,TSA)由美国国立卫生研究院癌症研究所David SCHRUMP博士提供,SAHA由英国阿斯利康(AstraZeneca)公司提供。抗肿瘤药5-氮杂-2'-去氧胞苷(5-aza-2'-deoxycytidine,DAC)、紫杉醇(paclitaxel)、维 A 酸(tretinoin)、姜黄素(curcumin)、槲皮素(quercetin)、白藜芦醇(resveratrol)、大黄素(emodin)、芹菜素(apigenin)、染料木素(genistein)等分别购自Sigma公司;LipofectamineTM2000阳离子脂质体购自Invitrogen公司;荧光素酶检测试剂盒(Luciferase Assay System)购自Promega公司;TD20/20光度计由美国Turner Designs公司生产;非洲绿猴肾成纤维细胞COS-7细胞由本实验室保存。
1.2 转染细胞模型的制备
前期工作发现了2种可以被HDAC抑制剂特异性活化的启动子序列,通过采用分子克隆的方法构建了含有该启动子序列及荧光素酶报道基因的真核表达载体,将其命名为pTA1及pTA2[5]。将COS-7细胞按1×105接种于24孔培养板,将扩增纯化的pTA1和pTA2载体以脂质体介导的方法转染COS-7细胞,经G418 1 g·L-1加压筛选21 d后,获得2种稳定表达外源基因的细胞抗性克隆。将该抗性细胞分别命名为COS-pTA1及COS-pTA2细胞,并作为细胞模型用于后续药物筛选。
1.3 细胞处理及荧光素酶活性测定
分别取2种转染细胞5×104接种24孔板,次日将细胞分为药物处理和二甲亚砜(DMSO)对照组,每组设2个复孔。细胞经药物处理特定时间后,按照荧光素检测试剂盒说明书进行细胞裂解,采用单管法用TD20/20光度计进行酶活性测定。药物活性以相对荧光素酶单位(relative luciferase unit,RLU)表示,RLU=药物处理组荧光素酶活性/对照组荧光素酶活性,对照组相对荧光素酶活性为1。RLU>1说明具有活化作用。
1.3.1 组蛋白去乙酰化酶抑制剂影响COS-pTA1细胞诱导荧光素酶表达的时间效应
将 COS-pTA1 细胞分别用FK228 46.2 nmol·L-1,SAHA 5 μmol·L-1和 TSA 300 μmol·L-1作用 1,3,6,12和24 h,检测荧光素酶活性。
1.3.2 组蛋白去乙酰化酶抑制剂影响COS-pTA1细胞诱导荧光素酶表达的浓度反应
COS-pTA1 细胞分别用 FK228 0,23.1,46.2,92.4 和 184.8 nmol·L-1;SAHA 0,2.5,5,10 和 20 μmol·L-1;TSA 0,150,300,600 和 900 μmol·L-1处理24 h,检测荧光素酶活性。
1.3.3 模型细胞荧光素酶活化的敏感性检测
2 种模型细胞分别用 FK228 0,23.1,46.2,92.4和 184.8 nmol·L-1;TSA 0,150,300,600 和 900 μmol·L-1处理24 h,检测荧光素酶活性。
1.3.4 模型细胞荧光素酶活化的特异性检测
依据临床常用有效剂量确定 FK228 92.51 nmol·L-1,DAC 5 μmol·L-1,维A 酸5 μmol·L-1和紫杉醇5 nmol·L-1与模型细胞作用24 h,检测荧光素酶活性。
1.4 采用具有抗肿瘤活性药物验证细胞模型
将获得的2种转染模型细胞以5×104密度接种于24孔培养板,次日采用6种已知具有抗肿瘤活性中药提取物分别处理细胞24 h:姜黄素20 μmol·L-1,大黄素 50 μmol·L-1,槲皮素 100 μmol·L-1,染料木素 20 μmol·L-1,芹菜素 370 μmol·L-1及白藜芦醇20 μmol·L-1,检测荧光素酶活性。
1.5 统计学分析
2 结果
2.1 FK228,SAHA和TSA对TA1启动子元件活化的时间效应
图1结果显示,FK228,SAHA和TSA在3,6,12和24 h荧光素酶活性与0 h相比均明显升高(P<0.01),而处理1 h与0 h相比无显著差异。用药24 h后,诱导的荧光素酶活性相对较高,因此,后续药物筛选实验处理时间定为24 h。

图1FK228,N-辛二酰苯胺异羟肟酸(SAHA)和曲古抑菌素A(TSA)对转染含有组蛋白去乙酰化酶(HDAC)启动子序列及荧光素酶报道基因表达载体(pTA)1的COS-7细胞(COS-pTA1)荧光素酶活性的时间效应影响.RLU:相对荧光素酶单位.RLU=药物处理组荧光素酶活性/对照组荧光素酶活性,对照组相对荧光素酶活性为1.±s,n=4.**P<0.01,与0 h组比较.Fig.1 Time-dependent effect of FK228,suberoylanilide hydroxamie acid(SAHA)and trichostatin A(TSA)on luciferase activity in COS-pTA1 cells.
2.2 FK228,SAHA和TSA对TA1启动子元件活化的浓度效应
图2结果显示,FK228,SAHA和TSA可以呈浓度依赖性地增强COS-pTA1细胞荧光素酶活性,用药后荧光素酶活性增强3~12倍,其最低有效浓度分别是 FK228 23.1 nmol·L-1,SAHA 2.5 μmol·L-1及 TSA 150 μmol·L-1,这些浓度均低于药物杀伤细胞的浓度,显示该细胞模型对HDAC抑制剂的反应具有高敏感性及浓度依赖性,FK228相关系数为0.7236,SAHA相关系数为0.7997,TSA 相关系数为 0.9815(P <0.01)。

图2 FK228,SAHA和TSA对TA1启动子元件活化的浓度效应.细胞分别用3种药物的4个浓度处理24 h,对应浓度1~浓度4 的具体药物浓度为 FK228 23.1,46.2,92.4 和 184.8 nmol·L-1;SAHA 2.5,5,10 和 20 μmol·L -1;TSA 150,300,600 和 900 μmol·L -1.±s,n=3.**P<0.01,与对照组比较.Fig.2 Concentration-effect of FK228,SAHA and TSA on TA1 promotor activiation.
2.3 FK228和TSA对TA1和TA2启动子活化敏感性的影响

图3 FK228和TSA对TA1和TA2启动子活化敏感性的影响.两种模型细胞分别用FK228和TSA处理24 h.±s,n=3.**P <0.01,与 COS-pTA2细胞模型组比.Fig.3 Effect of FK228 and TSA on activation sensitivity of TA1 and TA2 promotors.
图3结果表明,FK228及TSA对COS-pTA1细胞的荧光素酶激活活性均高于COS-pTA2细胞,在较高的药物浓度下,其活化程度相差近1倍(P<0.01)。提示2种启动子序列对HDAC抑制剂的活化敏感性不同。
2.4 FK228及抗肿瘤药物对TA1和TA2启动子活化的影响
表1结果显示,阳性对照药物FK228在COS-pTA1和COS-pTA2模型细胞RLU分别达到6和3以上,呈现出较高的相对荧光素酶活性。在敏感的COS-pTA1细胞中,虽然 DAC及紫杉醇处理组RLU>1,表现出微弱的活化荧光素酶作用,但仍显著低于FK228对特异性启动子TA1的活化水平(P<0.01)。而COS-pTA1细胞维A酸处理组以及COS-pTA2细胞3种抗肿瘤药物处理组的RLU均<1,提示上述药物处理对启动子TA1或TA2都不具有活化作用。同时,从这2种模型细胞对3种抗肿瘤药物的反应性来看,COS-pTA2比COS-pTA1具有较低的背景,仅对HDAC抑制剂产生特异性的活化作用,可以有助于排除药物筛选过程中假阳性的干扰。
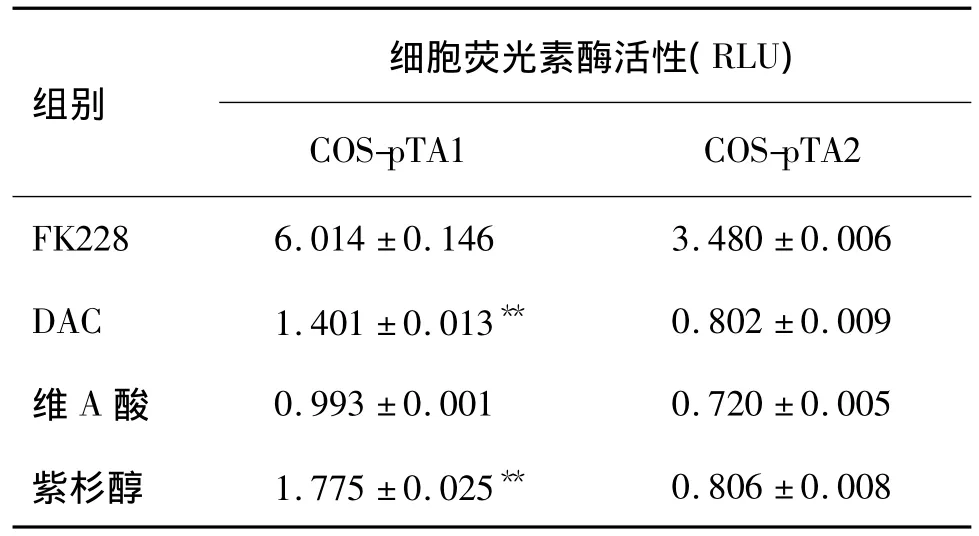
表1 FK228,5-氮杂-2-去氧胞苷(DAC),维A酸和紫杉醇对COS-pTA1和COS-pTA2模型细胞荧光素酶的活化作用Tab.1 Effect of FK228,5-aza-2'-deoxycytidine(DAC),tretinoin and paclitaxel on luciferase activity in COS-pTA1 and Cos-pTA2 cells
2.5 采用COS-pTA1细胞模型筛选已知具有抗肿瘤活性的药物
图4结果显示,在所筛选的6种样品中,以RLU增加大于2为阳性结果的判定标准时,姜黄素和白藜芦醇均显示出具有一定的荧光素酶激活活性,而其他4种中药提取物对荧光素酶的激活作用不显著。上述结果提示该细胞模型用于筛选具有抑制HDAC活性的天然抗肿瘤活性药物有一定应用价值。
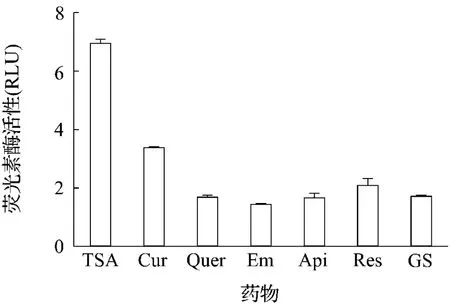
图4 COS-pTA1细胞模型筛选具有抑制HDAC作用药物.细胞分别用 TSA 600 nmol·L -1,姜黄素(Cur)20 μmol·L-1,槲皮素(Quer)100 μmol·L -1,大黄素(Em)50 μmol·L -1,芹菜素(Api)370 μmol·L -1,白藜芦醇(Res)20 μmol·L -1及染料木素(GS)20 μmol·L-1作用24 h.±s,n=3.以RLU≥2为具有活性判定标准.Fig.4 Screening of drugs with HDAC inhibition effect by COS-pTA1 cell model.
3 讨论
前期研究表明,HDAC抑制剂通过促进组蛋白的乙酰化修饰,使核小体的空间构象更加开放,从而有利于各种转录因子接近DNA,促进基因转录[3]。因此,笔者利用HDAC抑制剂对启动子可能的活化作用,筛选获得了适宜的启动子,并在此基础上构建了稳定转染相关荧光素酶报道基因的细胞模型。当采用HDAC抑制剂处理模型细胞时,细胞模型中的外源启动子会得到活化而增强荧光素酶的表达,通过荧光素和荧光素酶生物发光体系测定,可以极其灵敏、高效地检测出细胞在药物处理前后荧光素酶活性的变化,借此判断药物是否具有HDAC抑制活性。快速筛选结果表明,COS-pTA1细胞对于HDAC抑制剂具有较高的灵敏度,表现为细胞荧光素酶活性可以呈时间和浓度依赖性地增强。与COS-pTA1细胞相比,COS-pTA2细胞在相同的药物剂量下反应强度较低。DAC和维A酸可通过去甲基化及调控基因转录而促进细胞基因表达[6-7],紫杉醇则可通过增强微管的稳定性而影响HDAC6的活性[8]。细胞模型特异性结果显示,在较为敏感的COS-pTA1细胞模型中,DAC和紫杉醇的确表现出高于本底的荧光素酶活性,但其反应强度低于2倍,且不具有浓度依赖性,经COS-pTA2细胞进一步验证,也未能获得重复的结果。证实 TA1和 TA2启动子仅对HDAC抑制剂有较特异的活化反应。采用COS-pTA1筛选6种具有抗肿瘤生物学活性的植物提取物是否具有HDAC抑制剂作用结果显示,姜黄素和白藜芦醇被检出具有微弱的活性。已经有文献证实,姜黄素具有 HDAC抑制活性[9],白藜芦醇对HDAC的生物学效应目前正在进一步检测之中。
综上所述,笔者所建立的用于快速筛选具有HDAC抑制活性先导化合物的细胞模型中,COS-pTA1的作用特点是灵敏度高,可以有效避免因样品活性低而出现漏检。COS-pTA2的特点是检测背景低,特异性强,可以有效排除假阳性的筛选标本。通过这两种细胞模型的联合筛选药物,可以有效筛选具有HDAC抑制活性的化合物。该细胞模型为发现新型HDAC抑制剂的先导化合物及后续药物研发提供了重要的技术平台,具有一定的应用价值。
[1] Felsenfeld G,Groudine M.Controlling the double helix[J].Nature,2003,421(6921):448-453.
[2] Grunstein M.Histone acetylation in chromatin structure and transcription[J].Nature,1997,389(6649):349-352.
[3] Struhl K.Histone acetylation and transcriptional regulatory mechanisms[J].Genes Dev,1998,12(5):599-606.
[4] Johnstone RW. Histone-deacetylaseinhibitors:novel drugs for the treatment of cancer[J].Nat Rev Drug Discov,2002,1(4):287-299.
[5] 中国人民解放军军事医学科学院基础医学研究所.用于快速筛选组蛋白去乙酰化酶抑制剂的细胞模型:中国,200610011272.7[P].2010-04-07.
[6] Bird AP,Wolffe AP.Methylation-induced repressionbelts,braces,and chromatin[J].Cell,1999,99(5):451-454.
[7] Wolf G. Retinoic acid as cause of cell proliferation or cell growth inhibition depending on activation of one of two different nuclear receptors[J].Nutr Rev,2008,66(1):55-59.
[8] Marcus AI, Zhou J, O'Brate A, Hamel E,Wong J,Nivens M,et al.The synergistic combination of the farnesyl transferase inhibitor lonafarnib and paclitaxel enhances tubulin acetylation and requires a functional tubulin deacetylase[J].Cancer Res,2005,65(9):3883-3893.
[9] Liu HL, Chen Y, Cui GH, Zhou JF.Curcumin,a potent anti-tumor reagent,is a novel histone deacetylase inhibitor regulating B-NHL cell line Raji proliferation[J].Acta Pharmacol Sin,2005,26(5):603-609.

