猪苓多糖通过Toll样受体4对小鼠腹腔巨噬细胞的活化作用
许 文,李心群
(温州医学院1.微生物学与免疫学教研室,2.附属第一医院急诊科,浙江温州 325035)
猪苓为多孔菌科真菌猪苓〔Polyporus umbellatus(Pers.)Fries〕的干燥菌核,具有利尿和抗肿瘤活性[1-2]。猪苓多糖(polyporus polysaccharides,PPS)是从猪苓中提取的多糖类物质,具有抗癌瘤、增强免疫功能、保护肝脏和修复肝组织损伤等作用,PPS注射液已用于肝炎及肿瘤的辅助治疗[2-4]。目前对PPS的作用机制尚未阐明。为探讨其作用机制,本研究观察了PPS对小鼠腹腔巨噬细胞产生一氧化氮(nitric oxide,NO)、白细胞介素 1β(interleukin-1β,IL-1β)及肿瘤坏死因子α(tumor necrosis factorα,TNF-α)的影响,并制备了荧光胺(fluoresceinamine,Flu)标记的PPS(Flu-PPS),以尝试确定PPS所识别的靶分子,为进一步研究其药理作用打下基础。
1 材料与方法
1.1 动物、试剂和仪器
Toll样受体4(Toll-like receptor 4,TLR4)基因野生型、对脂多糖(lipopolysaccharides,LPS)敏感的小鼠C3H/HeN和TLR4基因突变、对LPS不敏感的C3H/HeJ小鼠,雌性,6~8周,购自中国科学院上海实验动物中心,动物生产许可证号:SCXK(沪)2007-0005。胎牛血清(fetal bovine serum,FCS)和 RPMI 1640培养基为 Hyclone产品;小鼠 IL-1β和 TNF-α ELISA试剂盒为R&D公司产品;LPS鲎试剂及NO检测试剂盒购自Sigma公司;抗小鼠TLR4和TLR2单抗及抗补体受体CR3单抗CD11b购自eBiosciences公司,上述抗体在用于细胞培养之前均用磷酸盐缓冲液(PBS)透析以去除其中的叠氮钠;RPMI 1640完全培养基:以RPMI 1640培养基为基础,加入10%的灭活 FCS,青霉素62.5 mg·L-1及链霉素100 g·L-1;阴性对照多糖——葡聚糖(dextran),相对分子质量70 000,购自Sigma公司;硫代羟基乙酸钠(thioglycollate,TG)为北京生物制品研究所产品。流式细胞仪,FACScan,美国B&D公司;Bio-Rad Model 550酶标仪,美国伯乐公司;激光共聚焦显微镜,Leica TCS SP2,德国Leica公司。
1.2 PPS 的制备
采用水浸提-乙醇沉淀提取法提取 PPS[5]。粉碎的猪苓用热水浸提,索氏提取器抽滤。滤液经浓缩后用乙醇沉淀,沉淀物依次经乙醇、丙酮和乙醚洗涤后,用Sevage法去除蛋白质。所得粗多糖用水透析,冻干保存。苯酚-硫酸法检测多糖含量>95%。刘小平等[5]用紫外与红外光谱分析发现,PPS表现出β-D-葡萄吡喃糖的特征吸收;气相色谱分析表明,其主要由D-葡萄糖和少量的D-半乳糖和D-甘露糖组成,经尺寸排除色谱和激光光散射联用仪测得PPS平均相对分子质量为1.6×105,分子质量分布(重均分子质量/数均分子质量)为2.914。经鲎试剂法检测,PPS 中 LPS 含量 <0.4 μg·g-1。
1.3 PPS及葡聚糖的荧光标记
Flu-PPS及Flu-葡聚糖采用溴化氰活化的方法制备[6],即0.2 ml溴化氰 50 g·L-1加于 1 ml PPS或葡聚糖 (20 g·L-1),用 NaOH 0.2 mol·L-1调 pH至 11.0,反应15 min,然后以 pH 8.0 硼酸盐缓冲液透析20 h。活化的PPS或葡聚糖与2 mg Flu反应10 h后,葡聚糖凝胶(Sephadex G-50)柱层析分离标记多糖,得到 Flu-PPS和 Flu-葡聚糖。PPS,Flu-PPS,葡聚糖和Flu-葡聚糖均溶于RPMI 1640完全培养基,并经0.22 μm滤器过滤除菌,4℃保存。
1.4 脾细胞增殖反应的测定
颈椎脱臼处死2种小鼠,无菌条件下分别取脾脏,制成脾细胞悬液,裂解红细胞,用RPMI 1640调整细胞密度为4 ×109L-1,于96 孔板每孔加入100 μl,分别与不同浓度的葡聚糖、PPS或Flu-PPS于37℃,5%CO2条件下培养72 h,于终止培养前8 h,每孔加入5.4 Bq[3H]TdR,收集细胞于玻璃纤维滤纸,β-粒子计数器测定放射活性(cpm),每样品3个复孔。
1.5 小鼠腹腔巨噬细胞的制备
小鼠腹腔注射3%TG溶液,每只2 ml,72 h后脱颈椎处死,收集腹腔洗液,贴壁2 h,去除非贴壁细胞,即为所需腹腔巨噬细胞。调细胞密度为2×106L-1,锥虫蓝染色法检查细胞存活率>95%。
1.6 Griess法检测C3H/HeN小鼠腹腔巨细胞培养上清一氧化氮浓度
C3H/HeN小鼠腹腔巨细胞与PPS(终浓度为12.5,25,50 和 100 mg·L-1),LPS 1 mg·L-1或葡聚糖50 mg·L-1作用24 h后,检测上清中亚硝酸盐含量。
1.7 ELISA法检测C3H/HeN和C3H/HeJ小鼠腹腔巨细胞培养上清IL-1β及TNF-α含量
分别取C3H/HeN和C3H/HeJ小鼠腹腔巨噬细胞2×106加于 24孔板内,分别与葡聚糖 50 mg·L-1,LPS 1 mg·L-1或不同浓度 PPS(终浓度为12.5,25,50 和100 mg·L-1)于37℃,5%CO2条件下培养24 h,收集培养上清,按照试剂盒说明书操作,检测上清中IL-1β及TNF-α含量。
1.8 抗体中和实验
取C3H/HeN小鼠腹腔巨噬细胞先分别与抗TLR4,TLR2 及 CR3 单抗 20 mg·L-1作用 1 h,再加入 PPS 50 mg·L-1,继续培养 24 h 后,检测上清中IL-1β和TNF-α含量。
1.9 流式细胞仪及激光共聚焦显微镜分析C3H/HeN小鼠腹腔巨噬细胞表面PPS识别靶分子
收集C3H/HeN小鼠腹腔巨细胞,用PBS调整细胞密度为1×109L-1,加入Eppendorf管离心,于细胞沉淀中加入50 μl Flu-PPS或 Flu-葡聚糖 1 mg·L-1,4℃冰箱中避光反应30 min,用 PBS 洗2次,激光共聚焦显微镜及流式细胞仪检测细胞表型(CellQuest软件分析)。竟争抑制实验时,腹腔巨噬细胞先与未标记的 PPS 100 mg·L-1或抗 TLR4,TLR2 或 CR3 单抗 200 mg·L-1反应 30 min,再与Flu-PPS或Flu-葡聚糖反应。
1.10 统计学分析
2 结果
2.1 PPS对C3H/HeN小鼠脾细胞增殖反应的影响
如图1所示,与RPMI 1640对照组相比,PPS具有促进C3H/HeN小鼠脾细胞增殖的作用,[3H]TdR掺入值明显增高,在 12.5 ~50 mg·L-1浓度范围内具有浓度依赖效应(r=0.999,P<0.01);葡聚糖对脾细胞增殖反应无促进作用。经鲎试剂法检测,PPS 中 LPS 含量 <0.4 μg·g-1,排除了这种作用是由于PPS样品受到LPS的污染所致。
另外,为了检测经荧光标记后,PPS的活性是否发生了改变,同时观察了Flu-PPS对C3H/HeN小鼠脾细胞增殖反应的影响。结果表明,Flu-PPS对小鼠脾细胞增殖反应的促进作用与PPS相近(图1),在12.5 ~ 50 mg·L-1浓度范围内具有浓度依赖效应(r=0.999,P <0.01),表明 Flu 标记对 PPS 的免疫活性无明显影响,可用于后续实验。
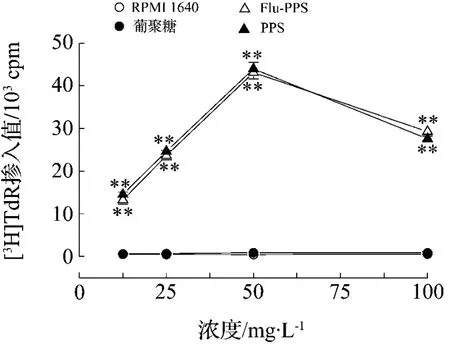
图1 猪苓多糖(PPS)和荧光胺(Flu)标记的PPS(Flu-PPS)对C3H/HeN小鼠脾细胞增殖反应的影响.C3H/HeN小鼠脾细胞分别与不同浓度的PPS,Flu-PPS或葡聚糖孵育,对照组以等体积的RPMI 1640培养基代替受试药物,孵育72 h后用[3H]TdR掺入法测定放射活性.±s,n=3.**P<0.01,与RPMI 1640组比较.Fig.1 Effects of polyporus polysaccharides(PPS)and fluoresceinamine(Flu)labeledPPS(Flu-PPS)on splenocyte proliferation of C3H/HeN mice.
2.2 PPS对C3H/HeN小鼠腹腔巨噬细胞NO,IL-1β和TNF-α产生的影响
PPS 12.5,25,50 及 100 mg·L-1与 C3H/HeN 小鼠腹腔巨噬细胞孵育24 h后,细胞培养上清中NO,IL-1β和TNF-α浓度与RPMI 1640组比较明显增加(表 1),具有浓度依赖效应 (NO:r=0.858,P <0.01;IL-1β:r=0.936,P < 0.01;TNF-α:r=0.903,P <0.01),表明 PPS 具有活化巨噬细胞的作用。由于这3种活性物质与巨噬细胞的细胞毒活性相关,因此推测PPS可能通过激活巨噬细胞产生NO,IL-1β和TNF-α等细胞因子发挥抗肿瘤及免疫调节作用。
2.3 抗TLR4单抗对PPS促进C3H/HeN小鼠腹腔巨噬细胞产生IL-1β和TNF-α的抑制作用
在加入PPS 50 mg·L-1前,加入抗TLR4单抗20 mg·L-1作用1 h,C3H/HeN 小鼠腹腔巨噬细胞培养上清中 IL-1β 和TNF-α 浓度与 PPS 50 mg·L-1单用组比较明显降低,降幅达 52.6% 和 58.6%(P<0.01);而同型抗体(IgG1)、抗 TLR2及 CR3单抗分别与腹腔巨噬细胞预孵育,培养上清中IL-1β和TNF-α浓度与PPS 50 mg·L-1单用组比较无明显差异;提示PPS可能经TLR4促进腹腔巨噬细胞产生 IL-1β 和 TNF-α(表2)。
2.4 PPS对C3H/HeN和 C3H/HeJ小鼠脾细胞增殖反应和腹腔巨噬细胞产生IL-1β和TNF-α的影响
由表3~表5所示,为了探讨PPS促进脾细胞增殖反应和活化巨噬细胞的作用是否通过TLR4发挥作用,比较了PPS对C3H/HeN和C3H/HeJ脾细胞增殖反应和腹腔巨噬细胞产生IL-1β及TNF-α的影响。结果表明,PPS 12.5,25,50 及 100 mg·L-1对C3H/HeN和C3H/HeJ小鼠脾细胞增殖反应均具促进作用(P<0.01),并促进腹腔巨噬细胞产生IL-1β及TNF-α。PPS对C3H/HeN小鼠的促进作用明显强于 C3H/HeJ小鼠是 PPS 12.5 ~100 mg·L-1组,脾细胞增殖反应增加了 2.4,1.7,1.5 和 22.2倍,IL-1P 产生分别增加了 0.9,1.3,1.2 和 1.1倍,TNF-α 产生分别增加了 1.3,0.9,0.6 和 0.6倍。由于C3H/HeJ小鼠属于TLR4受体缺陷小鼠,不能通过TLR4传导信号,故本结果进一步提示PPS可能是通过TLR4发挥对脾细胞和巨噬细胞的活化作用。

表1 PPS对C3H/HeN小鼠腹腔巨噬细胞产生一氧化氮(NO),白细胞介素1β(IL-1β)及肿瘤坏死因子α(TNF-α)的影响Tab.1 Effect of PPS on production of nitric oxide(NO),interleukin-1β(IL-1β)and tumor neceosis factor-α (TNF-α)by peritoneal macrophages of C3H/HeN mice
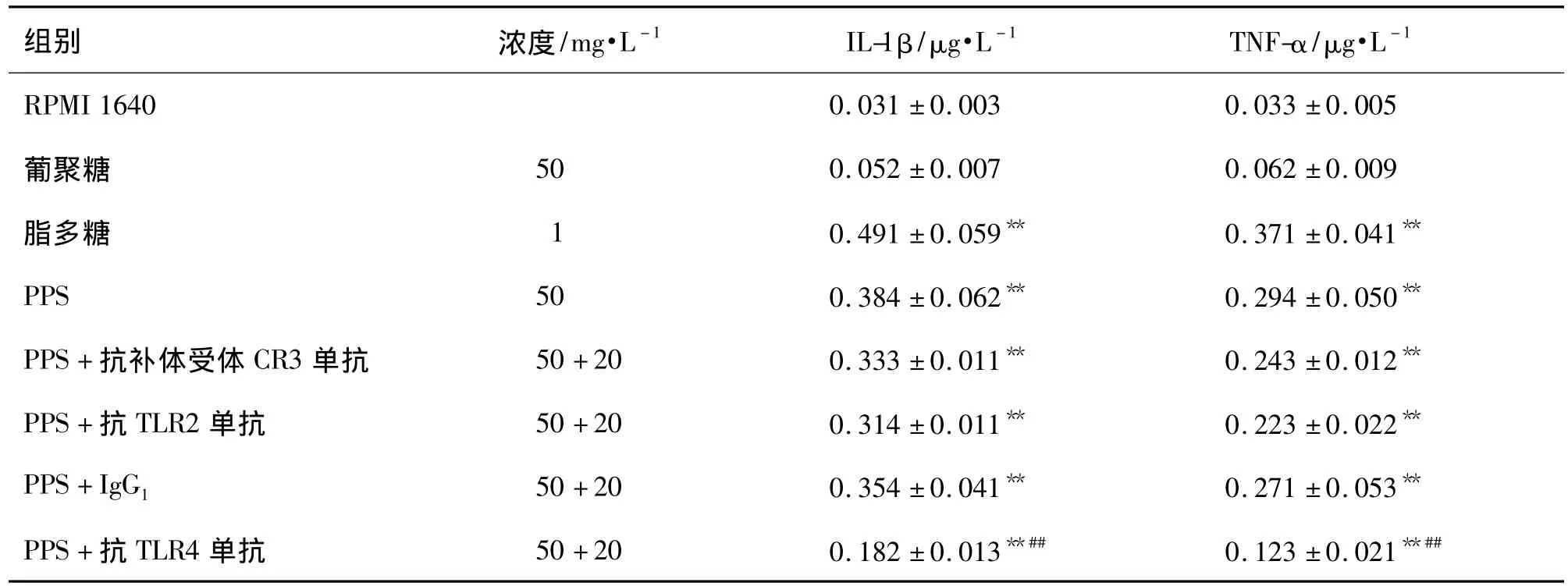
表2 抗Toll样受体4(TLR4)单抗对PPS刺激C3H/HeN小鼠腹腔巨噬细胞产生IL-1β及TNF-α的影响Tab.2 Effect of anti-Toll like receptor 4(TLR4)monoclonal antibody on promotion of PPS on IL-1β and TNF-α production of peritoneal macrophages of C3H/HeN mice
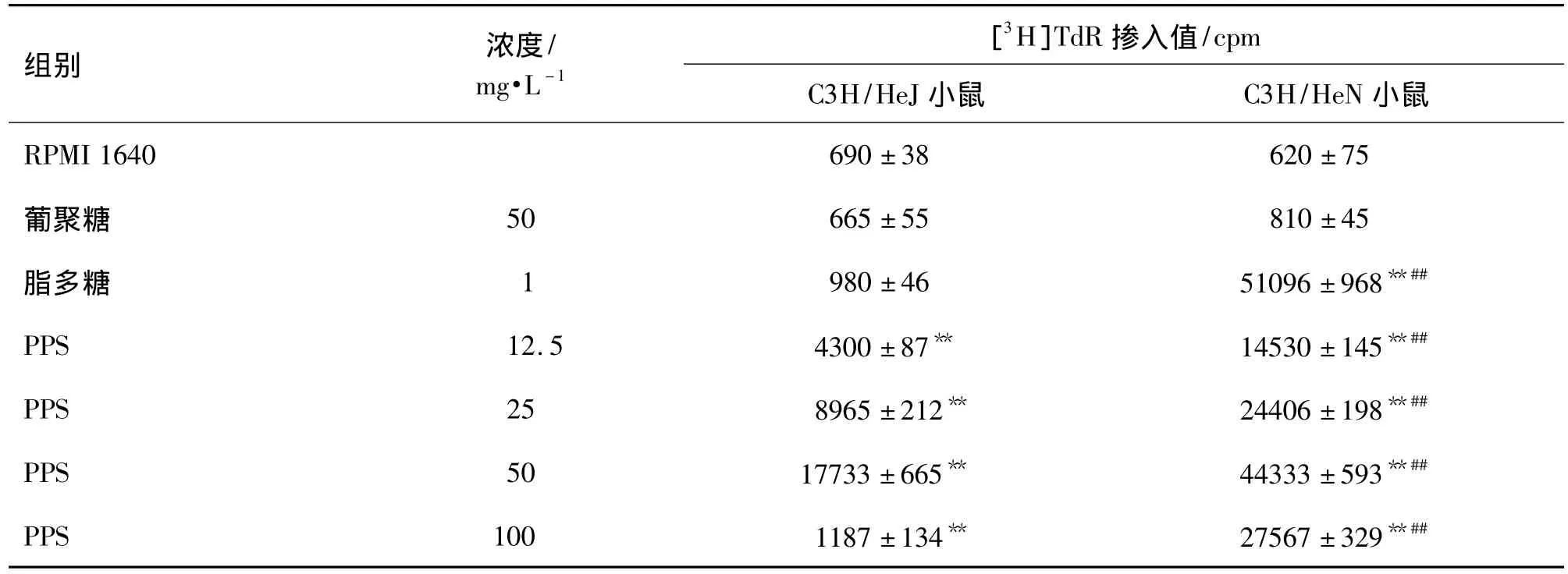
表3 PPS对C3H/HeN和C3H/HeJ小鼠脾细胞增殖反应的影响Tab.3 Effects of PPS on splenocyte proliferation of C3H/HeN and C3H/HeJ mice
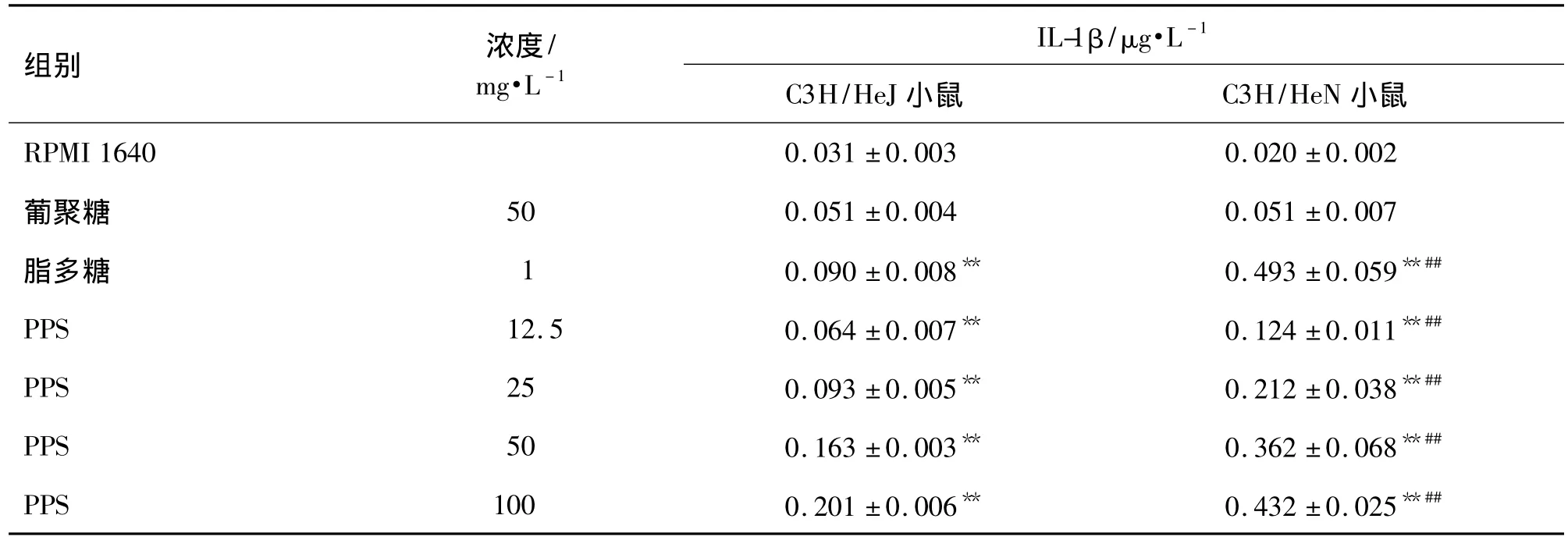
表4 PPS对C3H/HeN和C3H/HeJ小鼠腹腔巨噬细胞产生IL-1β的影响Tab.4 Effects of PPS on IL-1β production of peritoneal macrophages of C3H/HeN and C3H/HeJ mice

表5 PPS对C3H/HeN和C3H/HeJ小鼠腹腔巨噬细胞产生TNF-α的影响Tab.5 Effects of PPS on TNF-α production of peritoneal macrophages of C3H/HeN and C3H/HeJ mice
2.5 PPS在C3H/HeN小鼠腹腔巨噬细胞表面识别的靶分子
为进一步证实小鼠腹腔巨噬细胞表面具有PPS识别的靶分子,观察了Flu-PPS与巨噬细胞的结合。Flu-PPS和Flu-葡聚糖分别与C3H/HeN小鼠腹腔巨噬细胞孵育30 min。流式细胞仪检测结果表明,Flu-PPS 1 mg·L-1与巨噬细胞结合的平均荧光强度明显强于 Flu-葡聚糖组,且 Flu-PPS 5 mg·L-1时荧光强度并未明显增加(图2),表明PPS与腹腔巨噬细胞的结合具有饱和性,提示巨噬细胞表面具有PPS识别的靶分子。激光共聚焦显微镜分析亦发现,Flu-PPS与巨噬细胞孵育后在巨噬细胞表面形成了绿色的荧光环(图3)。
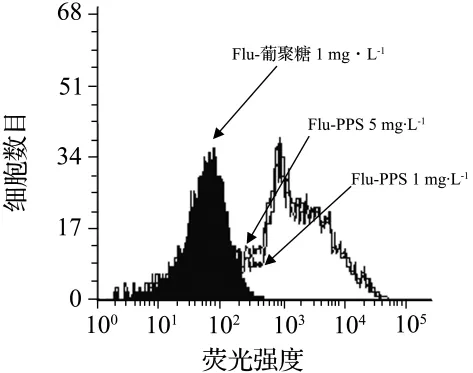
图2 Flu-PPS与C3H/HeN小鼠腹腔巨噬细胞表面特异结合.小鼠腹腔巨噬细胞分别与Flu-PPS或Flu-葡聚糖4℃避光反应30 min后,流式细胞仪分析与巨噬细胞结合的荧光强度.Fig.2 Specific binding of Flu-PPS to peritoneal macrophages of C3H/HeN mice.

图3 激光共聚焦显微镜检测Flu-PPS与Flu-葡聚糖与C3H/HeN小鼠腹腔巨噬细胞结合.A:Flu-PPS;B:Flu葡聚糖.Fig.3 Binding of Flu-PPS or Flu-dextran with peritoneal macrophages of C3H/HeN mice observed using confocal laser-scanning microscope.
为证实Flu-PPS与巨噬细胞膜表面分子作用的特异性,本研究进行了一系列的阻断实验。结果显示,过量的未标记的PPS 100 mg·L-1可抑制Flu-PPS 1 mg·L-1与巨噬细胞的结合(图4A);另外,抗TLR4单抗可显著抑制Flu-PPS与巨噬细胞的结合(图4B),而抗TLR2及补体受体CR3单抗则无明显的抑制作用(图4C)。结合2.3及2.4结果可以表明,巨噬细胞表面存在PPS结合的靶分子,TLR4可能是其主要的靶分子。由于与未标记的PPS的抑制作用比较,抗TLR4抗体的阻断作用相对较弱,表明巨噬细胞表面可能还存在其他的靶分子。

图4 PPS与抗TLR4单抗抑制Flu-PPS与C3H/HeN小鼠腹腔巨噬细胞的结合.小鼠腹腔巨噬细胞与PPS 100 mg·L-1及抗TLR4,TLR2或补体受体CR3单抗200 mg·L-14℃孵育1 h,PBS洗涤后加入Flu-PPS 1 mg·L-1,继续反应30 min后,流式细胞仪分析显示未标记的PPS(A)及抗TLR4单抗(B)可显著抑制Flu-PPS与巨噬细胞的结合,而抗TLR2及CR3单抗则无明显抑制作用(C).Flu-葡聚糖组只加入Flu-葡聚糖 1 mg·L -1,反应 30 min 后检测.Fig.4 Inhibition of Flu-PPS binding to peritoneal macrophages of C3H/HeN mice by unlabeled PPS and anti-mouse TLR4 monoclonal antibody.
3 讨论
PPS是从猪苓中提取出的水溶性多糖,具有广泛的生物学活性。动物实验研究结果表明,PPS可使小鼠腹腔巨噬细胞的吞噬功能增强,增强T细胞增殖,促进B淋巴细胞转化为浆细胞,并具有抑制肿瘤生长和增强免疫功能的作用[2,4]。本研究结果表明,PPS具有促进小鼠脾细胞增殖及腹腔巨噬细胞产生NO,IL-1β及TNF-α的活性,且这种活性与TLR4有关。
由于LPS具有很强的活化巨噬细胞的作用,亦能够促进巨噬细胞产生NO及各种细胞因子。为了排除样本中可能的LPS污染,本研究采用鲎试剂法检测了PPS中LPS的含量,发现样本中LPS含量远低于活化巨噬细胞所需的浓度,并不足以干扰实验结果。
中药多糖生物活性的发挥可能有赖于与细胞上相应受体的相互作用,而巨噬细胞在固有免疫及获得性免疫反应中均发挥重要作用。因此,发现并研究巨噬细胞表面中药多糖受体和细胞内信号传导途径,对揭示中药多糖免疫调节和抗肿瘤作用机制具有重要的理论及实际应用价值。
已有研究表明,巨噬细胞功能的发挥与其表面所谓的模式识别受体(pattern recognition receptor)如TLR4,TLR2,CR3,甘露糖受体及dectin-1等有关。TLR4可结合多种病原相关分子模式(pathogen associated molecular patterns)而活化。TLR活化后,可以促进机体抗感染和抗癌活性,如促进巨噬细胞NO的释放,并且可以通过诱导IL-1β和TNF-α等细胞因子调节特异性免疫应答。
近年来研究发现,天然来源的多糖可以通过TLR4介导多种免疫细胞激活细胞内信号通路,活化转录,促进细胞因子的释放,从而发挥免疫调节作用。如红花多糖[8]和刺五加多糖[9]等可通过TLR4活化腹腔巨噬细胞导致NO和TNF-α的产生,且与 NF-κB 的活化有关。Hsu 等[10-11]研究表明,灵芝多糖亦可通过TLR4活化小鼠腹腔巨噬细胞及诱导树突状细胞表型与功能成熟。因此,天然来源的多糖作为TLR的候选配体在治疗感染性疾病和癌症方面具有广阔的前景。
基于以上发现与研究,笔者推测PPS也可通过与TLR4作用来发挥免疫调节作用。为确定此假设,本研究比较了PPS对C3H/HeN小鼠和TLR4基因缺陷的C3H/HeJ小鼠脾细胞增殖反应和腹腔巨噬细胞产生NO,IL-1β及TNF-α的影响。结果表明,PPS 12.5,25,50 及 100 mg·L-1能显著刺激C3H/HeN小鼠脾细胞增殖,并促进其腹腔巨噬细胞产生NO,IL-1β 及 TNF-α;对 C3H/HeJ小鼠脾细胞增殖及腹腔巨噬细胞细胞因子的分泌具有一定的促进作用,但明显弱于对C3H/HeN小鼠的促进作用;由此提示,PPS活性与TLR4有关。用抗TLR4抗体封闭后,PPS刺激腹腔巨噬细胞产生IL-1β及TNF-α的作用下降达52.6%和58.6%,进一步表明PPS的活性与TLR4有关。
另外,流式细胞仪分析结果表明,Flu-PPS 1 mg·L-1与巨噬细胞结合的荧光强度明显高于Flu-葡聚糖,增加Flu-PPS的浓度荧光强度并未相应地增强,表明PPS与靶分子的结合具有饱和性;并且未标记的PPS 100 mg·L-1能阻断Flu-PPS与巨噬细胞的结合,表明巨噬细胞上具有PPS结合的靶分子,与激光共聚焦显微镜检测结果一致。进一步研究发现,抗TLR4抗体能够阻断Flu-PPS与巨噬细胞的结合,表明TLR4可能是PPS结合的靶分子。因此推测,PPS可能通过TLR4激活小鼠腹腔巨噬细胞以发挥免疫调节作用。
PPS对C3H/HeJ小鼠腹腔巨噬细胞产生NO及细胞因子并非完全没有影响,抗TLR4抗体也未能完全阻断Flu-PPS与巨噬细胞的结合,提示除了TLR4之外,巨噬细胞表面可能还存在其他的PPS结合的靶分子,这一推测尚待进一步研究。另外,本研究是用溴化氰活化的方法对PPS进行了荧光标记,虽然Flu-PPS与PPS比较其免疫活性未发生明显变化,但该标记方法主要是活化多糖上的羟基,没有选择性,多糖荧光标记后是否会改变多糖的活性位点,是否会使多糖的活性结构发生变化,亦尚待进一步研究。
[1] Zhao YY,Xie RM,Chao X,Zhang Y,Lin RC,Sun WJ. Bioactivity-directed isolation, identification of diuretic compounds from Polyporus umbellatus[J].J Ethnopharmacol,2009,126(1):184-187.
[2] 杨丽娟,王润田,刘京生,佟 慧,邓郁青,李全海.猪苓多糖对S180细胞培养上清免疫抑制作用影响的研究[J].细胞与分子免疫学杂志,2004,20(2):234-237.
[3] Liu J,McIntosh H,Lin H.Chinese medicinal herbs for chronic hepatitis B:a systematic review[J].Liver,2001,21(4):280-286.
[4] Liu JP,McIntosh H,Lin H.Chinese medicinal herbs for chronic hepatitis B[J].Cochrane Database Syst Rev,2001(1):CD001940.
[5] 刘小平,徐述明.猪苓多糖的提取及硫酸酯化研究[J].中药材,2007,30(2):160-163.
[6] Glabe CG, Harty PK, Rosen SD. Preparation and properties of fluorescent polysaccharides[J].Anal Biochem,1983,130(2):287-294.
[7] Ando I,Tsukumo Y,Wakabayashi T,Akashi S,Miyake K,Kataoka T,et al.Safflower polysaccharides activate the transcription factor NF-kappa B via Toll-like receptor 4 and induce cytokine production by macrophages[J].Int Immunopharmacol,2002,2(8):1155-1162.
[8] Han SB,Yoon YD,Ahn HJ,Lee HS,Lee CW,Yoon WK,et al.Toll-like receptor-mediated activation of B cells and macrophages by polysaccharide isolated from cell culture of Acanthopanax senticosus[J].Int Immunopharmacol,2003,3(9):1301-1312.
[9] Lin KI,Kao YY,Kuo HK,Yang WB,Chou A,Lin HH,et al.Reishipolysaccharidesinduce immunoglobulin production through the TLR4/TLR2-mediated induction of transcription factor Blimp-1[J].J Biol Chem,2006,281(34):24111-24123.
[10] Hsu HY,Hua KF,Lin CC,Lin CH,Hsu J,Wong CH.Extract of Reishi polysaccharides induces cytokine expression via TLR4-modulated protein kinase signaling pathways[J].J Immunol,2004,173(10):5989-5999.
[11] Hsu TL,Cheng SC,Yang WB,Chin SW,Chen BH,Huang MT, etal. Profiling carbohydrate-receptor interaction with recombinant innate immunity receptor-Fc fusion proteins[J].J Biol Chem,2009,284(50):34479-34489.

