酒精性肝损伤大鼠细胞色素P450 CYP2E1和细胞色素P450 CYP3A的代谢活性
康晓琳,薛永志,武润生,刘和莉
(1.包头医学院药理学教研室,内蒙古包头 014060;2.内蒙古北方重工集团有限公司医院,内蒙古包头 014030)
酒精性肝损伤是常见的致肝硬化原因,由酒精性肝损伤引起的酒精性肝病的发病率有迅速增加趋势,成为仅次于病毒性肝炎的第二大肝病。细胞色素P450 CYP2E1(cytochrome P-450 CYP2E1,CYP2E1)和细胞色素 P450 CYP3A(cytochrome P-450 CYP3A,CYP3A)是主要在肝脏表达的细胞色素P450重要的亚型[1],病毒侵袭和免疫刺激等因素都会使其蛋白表达和代谢活力发生变化[2-3]。国内对酒精性肝损伤的研究主要集中在氧化损伤等方面,而参与氧化代谢的重要代谢酶亚型CYP2E1和CYP3A在白酒致酒精性肝损伤中的变化及其作用环节尚未明确。氯唑沙宗(chlorzoxazone)主要经CYP2E1代谢,是常用的探针药物;咪达唑仑(midazolam)主要经CYP3A酶代谢,也常作为探针药物用于检测CYP3A。本研究采用大剂量白酒灌胃法制备大鼠急性酒精性肝损伤模型[4],观察经CYP2E1代谢的探针药物氯唑沙宗血药浓度经时变化及其镇痛效果的变化,观察经CYP3A代谢的探针药物咪达唑仑血药浓度经时变化,探讨肝损伤过程中CYP2E1和CYP3A代谢酶的变化,为深入揭示酒精性肝损伤机制提供实验依据。
1 材料与方法
1.1 动物、试剂和仪器
Wistar大鼠,清洁级,雄性,动物许可证号:SCXK(蒙)2002-0001,购自内蒙古大学实验动物中心,体重180~200 g,室温22~24℃,分笼饲养,自由饮水和进食,实验前,大鼠在实验室适应性饲养7 d。氯唑沙宗对照品、氯唑沙宗片剂,山东省医药工业研究所提供;咪达唑仑注射剂,徐州恩华集团药业有限责任公司生产,批号,20080604;乙腈,国药集团化学试剂有限公司,批号:20040527,色谱纯;甲醇,天津永大试剂厂生产,批号:20080421,色谱纯。高效液相色谱(HPLC)分析仪,美国Thermo Finnigon公司生产,500V/Vis紫外检测器,SeriesⅢ型泵,7725手动进样阀,C18色谱柱(250 mm×4.6 mm);Sartorius酸度计,北京塞多利斯仪器系统有限公司生产;LD4-2低速离心机,北京医用离心机厂生产;Sartorius分析天平,北京塞多利斯仪器系统有限公司生产;GM-0.33隔膜真空泵,天津市腾达过滤器件厂生产;OA-sys氮吹仪和C386OA超声波清洗脱气机,美国Organomation公司生产;RB-200智能热板仪,成都泰盟科技有限公司生产。
1.2 酒精性肝损伤大鼠模型的制备及鉴定
取雄性Wistar大鼠52只,体重180~200 g,随机分为2组,正常对照组和酒精性肝损伤模型组,大鼠ig给予56%(V/V)红星二锅头白酒2 ml,每日2次,间隔8 h,共2周。正常对照组大鼠ig给予等体积生理盐水。第14天断饲。第1天和第15天称量体重,观察体重变化情况,第15天随机抽取上述正常对照、酒精性肝损伤组大鼠各8只,经眶静脉丛采血4 ml,3000 ×g 离心10 min,血清置 -20℃冰箱冷冻待测。检测血清中谷丙转氨酶(glutamic pyruvic transaminase,GPT)和谷草转氨酶(glutamic oxaloacetic transaminase,GOT)活性。将上述已经采血的16只大鼠颈椎脱臼处死,迅速剖取肝脏,冲洗后称重。每组随机取其中的1只大鼠肝脏,在距肝脏边缘0.5 cm处取材,10%甲醛固定,常规HE染色,光镜下观察肝脏的组织形态。
1.3HPLC法测定大鼠ig给予氯唑沙宗后的血药浓度
于实验第15天另取正常对照、酒精性肝损伤模型组大鼠各5只,单次ig给予氯唑沙宗50 mg·kg-1,分别于给药前、给药后0.5,1,2,3,4 和 6 h 从眼内眦静脉丛采血 0.5 ml,2000 ×g离心 5 min,取血浆,-20℃保存。按照文献[3]报道的方法进行血样预处理并测定氯唑沙宗的血药浓度。应用药物代谢动力学3P87软件对血药浓度数据进行拟合,计算药代动力学参数。通过测定血浆中探针药物氯唑沙宗血药浓度-时间曲线及药代动力学参数的变化,反映CYP2E1代谢活性的变化。
1.4 热板法测定氯唑沙宗对酒精性肝损伤大鼠的镇痛效果
于第15天取上述正常对照组和酒精性肝损伤组大鼠各8只,单次ig给予氯唑沙宗80 mg·kg-1,1.5 h后,采用热板法[5]测定大鼠舔足反射潜伏期和5 min内舔足次数,根据氯唑沙宗镇痛作用效果差异间接评价CYP2E1代谢活性。
1.5 HPLC法测定大鼠ip给予咪达唑仑注射液后的血药浓度
于实验第15天取上述正常对照和酒精性肝损伤组大鼠各5只,均经ip给予咪达唑仑注射液10 mg·kg-1。给药后经眶静脉丛分别采集 15,30,45 min,1和2 h的血浆样品各0.5 ml,2000×g离心10 min,得血浆,-20℃保存待测。根据文献[6]进行血样的预处理和采用HPLC法测定血浆中CYP3A探针药物咪达唑仑的血药浓度。用药物代谢动力学软件3P87对血药浓度数据进行拟合,计算浓度-时间曲线下面积(area under the concentration-time curve,AUC)、半衰期 (half-life,t1/2)和清除率(clearance,Cl)等药代动力学参数。通过血浆中探针药物咪达唑仑血药浓度-时间曲线及药代动力学参数的变化,反映CYP3A代谢活性的变化。
1.6 统计学分析
2 结果
2.1 酒精性肝损伤大鼠肝脏病理组织学变化
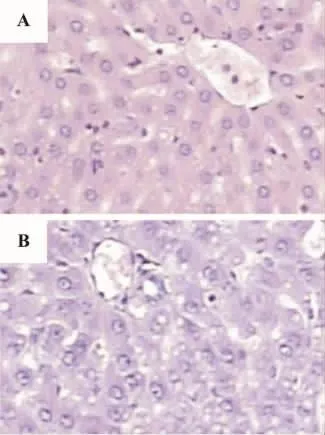
图1 乙醇对大鼠肝组织的影响 (HE×200).A:正常对照组,大鼠ig给予生理盐水2 ml,每天2次;B:酒精性肝损伤组,大鼠ig给予白酒(V/V,56%)2 ml,每日2次,间隔8 h,共14 d.第15天取肝组织观察大鼠肝脏病理组织学变化.Fig.1 Effect of alcohol on liver of rats(HE ×200).
各组大鼠肝脏切片HE染色光镜下观察显示,正常对照组大鼠肝小叶结构正常,肝索排列整齐,呈放射状。肝细胞大小一致,核呈圆形,核仁清楚,胞浆粉染,汇管区无炎症细胞浸润(图1A);酒精性肝损伤组大鼠可见明显的损伤性改变,肝小叶结构不清,肝索排列紊乱,肝细胞体积增大,呈弥漫性中度水变性,肝窦受压,大部分肝细胞胞浆内见大小不等的脂肪空泡,严重者融合成大的脂滴,将肝细胞核推挤至一侧,尤以小叶外周的肝细胞更为明显(图1B)。
2.2 酒精性肝损伤大鼠体重增加量、肝重系数和肝功能的变化
与正常对照组大鼠体重增加量(62±22)g相比,酒精性肝损伤组体重增加量(29±13)g,明显减少(n=8,P<0.01);肝重系数明显增加0.038±0.002 vs(0.054 ±0.006)g·g-1(n=8,P < 0.01);酒精性肝损伤组大鼠血清GPT和GOT活性分别增加了16.0%和20.0%(P <0.05,P <0.01)(表1)。
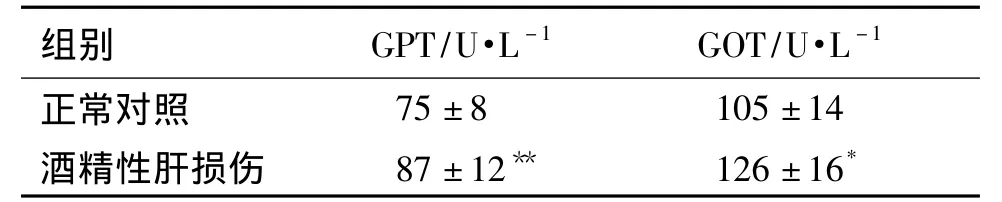
表1 乙醇对大鼠血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)水平的影响Tab.1 Effect of alcohol on glutamic pyruvic transaminase(GPT)and glutamic oxaloacetic transaminase(GOT)in rats
2.3 酒精性肝损伤对大鼠CYP2E1酶代谢活性的影响
分别给予正常大鼠和肝损伤模型大鼠单次ig给予CYP2E1特异性探针药物氯唑沙宗50 mg·kg-1,药代动力学结果(图2,表2)显示,与正常对照组大鼠相比,酒精性肝损伤组大鼠口服氯唑沙宗后,各时间点血药浓度均显著降低,其中酒精性肝损伤组大鼠cmax,AUC和t1/2较对照组分别减少了35%,38%和30.5%(P <0.05),而 tmax和 Cl没有显著性差异。提示酒精性肝损伤致使大鼠对探针药物氯唑沙宗的代谢活性增强。

图2 大鼠ig给予氯唑沙宗后的血药浓度-时间曲线.第15天取按图1说明分组的大鼠,单次ig给予氯唑沙宗50 mg·kg-1,分别于给药前、给药后0.5,1,2,3,4和6 h采血.±s,n=5.*P<0.05,与同一时间点正常对照组比较.Fig.2 Concentration-time curve of chlorzoxazone in plasma after rats were given ig chlorzoxazone 50 mg·kg -1.
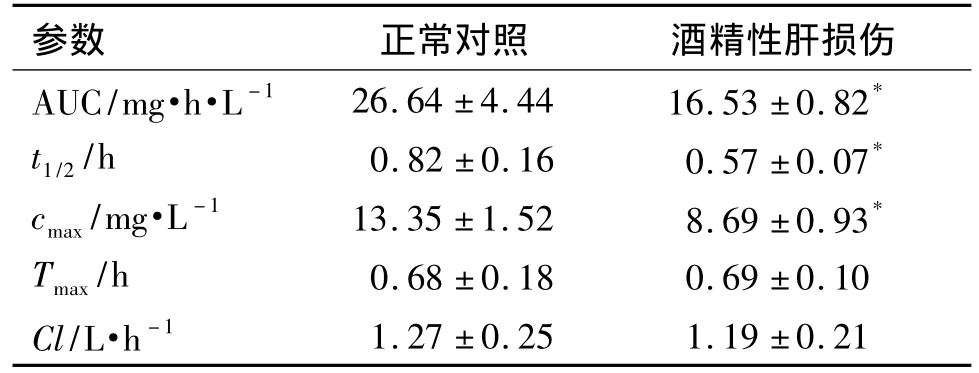
表2 大鼠单次ig给予氯唑沙宗后的药代动力学参数Tab.2 Pharmacokinetics parameteres of chlorzoxazone 50 mg·kg -1given ig in rats
2.4 酒精性肝损伤对氯唑沙宗镇痛效果的影响
表3结果显示,与正常对照组大鼠相比,酒精性肝损伤组大鼠ig给予CYP2E1特异性探针药物氯唑沙宗80 mg·kg-1后,舔足反应潜伏期明显缩短,舔足反射次数显著增多(P<0.01),说明 CYP2E1代谢活性增强。

表3 酒精性肝损伤对氯唑沙宗镇痛效果的影响Tab.3 Impact of alcohol-induced hepatic injury on analgesic effect of chlorzoxazone 80 mg·kg -1given ig in rats
2.5 酒精性肝损伤对大鼠CYP3A酶代谢活性的影响

图3 大鼠ip给予咪达唑仑后的血药浓度-时间曲线.第15天取图1中各组大鼠单次ip给予咪达唑仑10 mg·kg-1.±s,n=5.*P<0.05,与同一时间点正常对照组比较.Fig.3 Concentration-time curve of midazolam in plasma after rats were given ip midazolam 10 mg·kg -1.
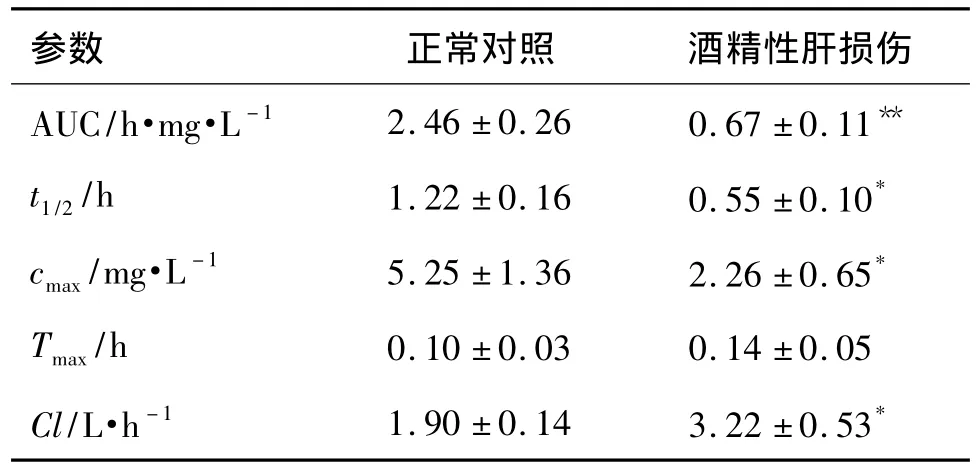
表4 大鼠ip给予咪达唑仑后的药代动力学参数Tab.4 Pharmacokinetic parameters of midazolam 10 mg·kg -1given ip in rats
正常大鼠和肝损伤模型大鼠ip给予CYP3A特异性探针药物咪达唑仑注射液10 mg·kg-1,药代动力学结果(图3和表4)显示,与正常对照组大鼠相比,酒精性肝损伤组大鼠各时间点血药浓度均显著降低(P <0.05),AUC,t1/2和 cmax较对照组分别减少了122.5%,54.9%和56.9%,Cl增大了 41.0%(P <0.01,P <0.05)。提示酒精性肝损伤致大鼠CYP3A的代谢活性增强。
3 讨论
本研究采用大剂量白酒灌胃法制备酒精性肝损伤模型,诱导2周后,转氨酶增加,肝功能受损,体重相对减轻,肝重增加,组织病理学可见,形成以肝细胞肿胀、脂肪变性为特征的急性酒精性肝损伤模型,与人类酒精性肝损伤病理学特征相似。
CYP2E1是主要在肝脏表达的药物代谢酶的重要亚型[3],CYP2E1在不同动物种属间较为保守,人与啮齿类动物如大鼠或小鼠的CYP2E1氨基酸序列可具有78%的同源性,其代谢底物和代谢活性亦极为相似,因此有关CYP2E1的药理学动物实验对临床具有重要的参考价值。本研究结果显示,酒精性肝损伤组在给予氯唑沙宗后各时间点血药浓度均较正常对照组显著降低,cmax减少,AUC减少,提示酒精性肝损伤可使CYP2E1酶蛋白在代谢活性水平明显增强。同时,热板实验结果提示,乙醇损伤组大鼠氯唑沙宗镇痛作用减弱,从药效学角度反映CYP2E1代谢活力增强。CYP2E1可催化乙醇产生过氧化物,引发脂质过氧化,在酒精性肝损伤发病机制中起重要作用[7]。乙醇及其代谢产物乙醛、脂肪酸等经肝CYP2E1系统代谢,酒精性肝损伤导致CYP2E1代谢能力的增强,可产生大量的活性氧基团,引发脂质过氧化反应,可损害各种细胞器和酶的结构功能,抑制蛋白酶体的活性,降低蛋白酶体对乙醛加合物蛋白的水解作用,导致肝细胞损伤[8]。
CYP3A是肝脏与小肠中含量最为丰富的CYP450药物代谢酶系,属于CYP3A基因家族的CYP450在肝脏CYP450酶总含量中约占25%,不仅在外源性药物与毒物的代谢中起着极为重要的作用,临床常用药物中亦约有50%经由CYP3A代谢。CYP3A也催化许多内源性激素的代谢,如睾酮及可的松的6-β-羟化代谢等,在维持动物生理功能和内环境稳定方面起重要作用,并且对一些细胞因子很敏感[9]。目前,关于酒精性肝损伤过程中CYP3A代谢活性是否增强不同实验室得出不同的结果。有报道,中度酒精性肝损伤CYP3A活性无变化,但是减少咪达唑仑口服生物利用度,可能是肠内CYP3A诱导的结果[9]。还有报道,中度酒精性肝损伤与CYP3A活性密切相关,明显增加其代谢活性,但CYP3A上调机制尚未明确,可能与核受体转录因子的调节有关[10]。本研究观察到急性乙醇刺激诱导CYP2E1,引起探针药物氯唑沙宗代谢增强的同时,也诱导了CYP3A的代谢活性,导致了探针药物咪达唑仑代谢增强,本研究结果与文献[10]报道一致。CYP3A、CYP2E1均属于膜结合蛋白,其代谢活性的上调导致其氧化能力的增强,导致膜脂质过氧化,进一步加重肝损伤,形成恶性循环,上述分析提示,急性酒精性肝损伤机制主要是氧化损伤,药物代谢酶的高诱导性可能参与损伤机制,有关酒精性肝损伤过程中代谢酶上调机制及其调控环节目前尚不清楚,需进一步研究。
[1] Schoedel KA,Tyndale RF.Induction of nicotine-metabolizing CYP2B1 by ethanol and ethanol-metabolizing CYP2E1 by nicotine:summary and implications[J].Biochim Biophys Acta,2003,1619(3):283-290.
[2] Silvestri L,Sonzogni L,De Silvestri A,Gritti C,Foti L,Zavaglia C,et al.CYP enzyme polymorphisms and susceptibility to HCV-related chronic liver disease and liver cancer[J].Int J Cancer,2003,104(3):310-317.
[3] 薛永志,章国良,步秀云,李 丹,王 昕.免疫性肝损伤中一氧化氮诱生对CYP2E1表达及代谢活性的影响[J].世界华人消化杂志,2004,12(8):1973-1976.
[4] 汪海慧,成 扬,胡义扬,陈高峰,彭景华,冯 琴,等.健脾活血方对大鼠急性酒精性肝损伤的干预作用[J].中西医结合肝病杂志,2009,19(4):221-223.
[5] 徐济良,黄金华,邵政一.复方氯唑沙宗片的药效学研究[J].交通医学,1996,10(4):25-26.
[6] Liu Y,Jiao J,Zhang C,Lou J.A simplified method to determine five cytochrome p450 probe drugs by HPLC in a single run[J].Biol Pharm Bull,2009,32(4):717-720.
[7] Wolf KK,Wood SG,Allard JL,Hunt JA,Gorman N,Walton-Strong BW,et al.Role of CYP3A and CYP2E1 in alcohol-mediated increases in acetaminophen hepatotoxicity:comparison of wild-type and Cyp2e1(-/-)mice[J].Drug Metab Dispos,2007,35(7):1223-1231.
[8] Lu Y,Cederbaum AI.CYP2E1 and oxidative liver injury by alcohol[J].Free Radic Biol Med,2008,44(5):723-738.
[9] Liangpunsakul S,Kolwankar D,Pinto A,Gorski JC,Hall SD,Chalasani N.Activity of CYP2E1 and CYP3A enzymes in adults with moderate alcohol consumption:a comparison with nonalcoholics[J].Hepatology,2005,41(5):1144-1150.
[10] He P,Court MH,Greenblatt DJ,von Moltke LL.Factors influencing midazolam hydroxylation activity in human liver microsomes[J].Drug Metab Dispos,2006,34(7):1198-1207.

