纳米铁锡钴复合氧化物的制备与电化学性能
刘 斌, 胡文胜,宋 彬,贾殿赠
(1.新疆大学,新疆乌鲁木齐 830046;2.新疆教育学院,新疆乌鲁木齐 830043)
锂离子二次电池负极材料经历了从金属锂到锂合金、碳素材料、过渡金属氧化物的研究过程。金属锂存在一定的安全隐患,碳素材料贮锂比容量虽然较高(理论贮锂比容量为372 mAh/g),但由于没有经过高温处理,碳材料中残留有缺陷结构,使容量随循环的进行而衰减。因此,在进一步改进碳材料的同时,寻找更可靠且贮锂容量更高的新型锂离子电池负极材料[1-2]成为人们的研究方向,自1997年Fuji公司研究人员发现无定形锡基复合氧化物(简称TCO)有较好的循环寿命和较高的可逆容量后,金属氧化物负极材料[3-5]引起了人们的广泛注意,成为目前研究的热点。
Fe2O3、SnO2、Co3O4是目前研究较多的金属氧化物负极材料。Fe2O3的主要缺点是循环性能欠佳[6],SnO2主要缺点是首次不可逆容量较高[7-11],Co3O4主要缺点是成本较高[12-14],这些缺点影响了金属氧化物负极材料的实际应用,而克服这些缺点是目前金属氧化物负极材料领域研究的重点。本研究采用沉淀法[15-16]制备纳米铁锡钴三元复合氧化物,并研究了它们的组成、结构以及电化学性能,以期改善上述负极材料性能。
1 实验
1.1 利用沉淀法制备纳米铁锡钴复合氧化物
将一定量的浓氨水滴加到100m L 0.25mol/L氯化铁、50 m L 0.25mol/L二氯化钴和50m L 0.25mol/L四氯化锡的混和溶液中,滴速为5滴/10 s。待沉淀完全后,继续搅拌6 h,并将此沉淀放置24 h后抽滤,洗涤至pH值为中性,然后置于烘箱中,于60℃下干燥24 h,冷却至室温后研磨,后置于马弗炉中在500℃下加热6 h,即得到深褐色粉状铁锡钴复合氧化物。
1.2 纳米铁锡钴复合氧化物的表征
采用丹东方圆仪器有限公司DX-1000型X-射线衍射仪测试,Cu Kα靶。颗粒大小由谢乐公式采用X-射线线宽法计算得到。采用日本日立公司的H-600型透射电子显微镜观察样品的形貌和颗粒分布。
1.3 纳米铁锡钴复合氧化物电化学性能测试
将活性物质铁锡钴复合氧化物粉末、乙炔黑和PVDF按质量比75∶20∶5在溶剂N-甲基吡咯烷酮中混合均匀,然后将其均匀涂布在集流体铜箔上,在120℃真空干燥6 h制成铁锡钴复合氧化物电极。以铁锡钴复合氧化物为正极,以美国产 Cellgard-2400型聚丙烯膜为隔膜,1.0 mol/L LiPF6的EC-DEC(体积比为1∶1)溶液为电解液,金属锂为负极,在充满氩气的手套箱中装配成扣式测试电池。在武汉金诺电子有限公司生产的Land CT 2001A型电池测试系统上进行充放电测试,充放电电压范围为0.3~1.8 V,充放电电流为0.2 mA/cm2。循环伏安测试在CHI660b上进行测试,扫描速度为0.2mV/s,扫描范围为0.3~2.5 V。
2 结果与讨论
2.1 纳米铁锡钴复合氧化物的物相和微结构
图1为铁锡钴复合氧化物样品的XRD图。可以看到,各特征衍射峰较宽。这些峰的位置与JCPDS标准卡片相符合,说明合成样品为铁锡钴复合氧化物。根据铁锡钴复合氧化物的最强衍射峰101峰,采用Scherrer公式可以计算铁锡钴复合氧化物平均颗粒尺寸为20 nm。可见,样品的尺寸在纳米级范围内。
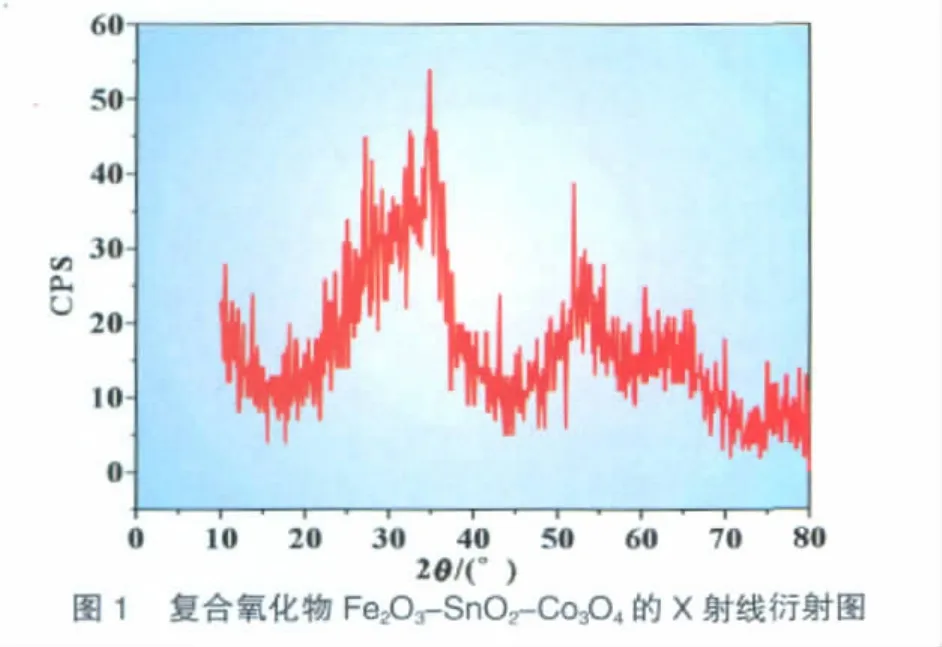
图2为铁锡钴复合氧化物样品的透射电镜图。从图中可以看出,铁锡钴复合氧化物由许多大小比较均匀的颗粒组成,颗粒之间存在较严重的团聚现象,这主要与氧化锡结晶后存在着较严重的团聚现象有关。从图上可以估计颗粒的平均粒径大约为20 nm,与XRD得到的结果相符。均匀的粒度分布、较小的颗粒尺寸使纳米铁锡钴复合氧化物负极具有较好的循环性能。

2.2 纳米铁锡钴复合氧化物的电化学性能

图3为铁锡钴复合氧化物的前3次循环伏安曲线。很明显,在首次循环放电过程中,在0.75~0.5 V之间出现了一个宽的还原峰,这对应着SnO2→Sn的还原、Co3O4→Co的还原、Fe2O3→FeO的还原、FeO→Fe的还原以及在铁锡钴复合氧化物电极上形成固体电解质界面膜(见式1、3~5)。在0.3 V附近出现了一个还原峰,这对应着形成了LixSn(x≤4.4)(见式2)。在第二次循环中,在1.3 V附近出现了一个宽的还原峰,对应着Co3O4→Co的还原、Fe2O3→FeO的还原,在0.7 V附近出现了一个宽的还原峰,对应着Fe2O3→FeO的还原,在0.3 V附近出现的还原峰,仍然对应着形成了LixSn(x≤4.4)。
在首次充电过程中,在1.7 V附近出现的宽氧化峰,对应着LixSn氧化为Sn和Li+(见式2),同时对应着Fe被氧化成FeO再氧化成Fe2O3、Co被氧化成Co3O4和Li2O变为Li+(见式3~5)。在第二次充电过程中,1.7 V附近的氧化峰强度变化不大,各次循环伏安曲线之间重合得比较好,说明纳米铁锡钴复合氧化物负极具有较好的循环性能。

图4为铁锡钴复合氧化物的前3次充放电曲线。从首次放电曲线可以看到,在0.75 V之间出现了一个长平台,这与循环伏安曲线中在0.75~0.5 V之间出现的还原峰相对应,对应着SnO2→Sn的还原、Co3O4→Co 的还原、Fe2O3→FeO的还原、FeO→Fe的还原以及在铁锡钴复合氧化物电极上形成固体电解质界面膜。

从图中可以看出,第二、三周放电平台相似,与第一周不同,主要是因为第一周在铁锡钴复合氧化物电极上形成固体电解质界面膜。同时放电容量依次减小,放电容量的下降主要是因为大量的Li+嵌入无法脱出,Wu X L[17]等人认为这部分Li+无法脱出主要是对氧化物结构起稳定作用。同时可能由于铁锡钴复合氧化物负极具有较大的比表面积,使电极表面上SEI膜的形成消耗了较多的金属锂的缘故[18-19]。三条充电曲线形状相似,说明发生化学反应相同(见式2~5),充电比容量依次减小。第1周放电比容量为1 472mAh/g,第2周放电比容量为879mAh/g,将第2周的放电比容量与第1周的放电比容量的比值表示为R2/1,则R2/1=60%,说明首次不可逆容量与氧化锡、四氧化三钴相比有所改善。
图5为铁锡钴复合氧化物与氧化铁的50周放电容量对比图。铁锡钴复合氧化物初始放电比容量为1 472mAh/g,第20周放电比容量为326mAh/g,第50周放电比容量为269 mAh/g;氧化铁的初次放电比容量为806mAh/g,第20周放电比容量为194mAh/g,第50周放电比容量为53mAh/g。可以看出铁锡钴复合氧化物的放电容量明显高于氧化铁。从30周到50周,铁锡钴复合氧化物放电比容量由292mAh/g衰减到269mAh/g,放电比容量保持率为92%,而氧化铁从30周到50周的放电比容量保持率仅为39%,铁锡钴复合氧化物放电容量的衰减明显低于氧化铁,从图中可以看出,放电图形基本为一平台,说明铁锡钴复合氧化物有较好的循环性能。

3 小结
(1)以四氯化锡、氯化铁、二氯化钴、氨水为原料,采用沉淀法首次制备了纳米铁锡钴复合氧化物粉末,并用X-射线衍射分析、透射电镜和多种电化学方法对其进行了表征。结果表明样品粒度分布较均匀、平均粒径在20 nm左右,但存在较严重的团聚现象。
(2)电化学研究表明,从30周到50周,纳米铁锡钴复合氧化物放电比容量由292mAh/g衰减到269mAh/g,放电比容量保持率为92%,从图中也可以看出,30周后放电图形基本为一平台,说明纳米铁锡钴复合氧化物有较高的放电容量和良好的循环性能。
(3)铁锡钴复合氧化物解决了单一氧化铁循环性能不佳的问题,同时有效降低了首次不可逆容量和生产成本,是一种有前途的锂离子电池负极材料。
[1] YU A S,ROGER F.Mesoporous tin oxides as lithium intercalation anodematerials[J].JPower Sources,2002,104:97-100.
[2]LEE JY,ZHANG R F,LIU Z L.Dispersion of Sn and SnO on carbon anodes[J].JPower Sources,2001,96:277-279.
[3]MOHAMEDIM,LEE S J,TAKAHASHID,etal.Amorphous tin oxide films:Preparation and characterization as an anode activematerial for lithium ion batteries[J].Electrochim ica Acta,2001,46:1161-1168.
[4] BELLIARD F,IRVINE J S.Electrochem ical performance of ballm illed ZnO-SnO2systems as anodes in lithium ion battery[J].J Power Sources,2001,97/98:219-222.
[5] BELLIARD F,CONNOR P A,IRVINE JS.Novel tin oxidebased anodes for Li-ion batteries[J].Solid State Ionics,2000,135:163-167.
[6] 梁霍秀,边玉珍.氧化铁的制备及电化学性能研究[J].南开大学学报,2006,39(3):43-46.
[7] YUAN L,GUO Z P,KONSTANTINOV K,et al.Nano-structured spherical porous SnO2anodes for lithium-ion batteries[J].JPower Sources,2006,15:345-348.
[8]JUTTUKONDA V,PADDOCK R L,RAYMOND JE,et al.Facile synthesis of tin oxide nanoparticles stabilized by dendritic polymers[J].JAm Chem Soc,2006,128:420-421.
[9]CHENG B,RUSSELL JM,SHIW S,etal.Large-scale solution-phase grow th of single-crystalline SnO2nanorods[J].J Am Chem Soc,2004,12:5972-5973.
[10] LOU XW,WANG Y,YUAN C,et al.Template-free synthesis of SnO2hollow nanostructuresw ith high lithium storage capacity[J].Adv Mater,2006,18:2325-2329.
[11]BA J,POLLEUX J,ANTONIETTIM,etal.Non-aqueous synthesis of tin oxide nanocrystals and their assembly into ordered porous mesostructures[J].Adv Mater,2005,17:2509-2512.
[12] KANG Y M,SONG M S,KIM JH.A study on the charge-dischargemechanism of Co3O4as an anode for the Li ion secondary battery[J].Electrochim ica Acta,2005,50:3667-3673.
[13] LIU Y,M IC,SU L,etal.Hydrothermal synthesisof Co3O4m icrospheres asanodematerial for lithium-ion batteries[J].Electrochim Acta,2008,53:2507-2513.
[14] LIW Y,XU L N,CHEN J.Co3O4nanomaterials in lithium-ion batteriesand gassensors[J].Adv FunctMater,2005,15(5):851-857.
[15] SONG K S,KANG Y.Preparation of high surface area tin oxide powders by a homogeneous precipitation method[J].Mater Lett,2000,42(5):283-289.
[16] YUAN Z Y,HUANG F,FENG CQ,etal.Synthesis and characterization of amorphous nanosized MnSnO3as a high capacity anode material for lithium ion battery[J].Journal of Materials Science Letters,2003,22:143-144.
[17] WU X L,KIM SB.Synthesis and electrode properties ofα-Fe2O3from iron phthalocyanine[J].Electrochem ical and Solid-State Letters,1999,2(4):184-186.
[18]NAM SC,YOON Y S,CHOW I,et al.Enhancementof thin film tin oxide negative electrodes for lithium batteries[J].Electrochem istry Communications,2001,3(1):6-10.
[19] H LI,X HUANG,L CHEN.Direct imaging of the passivating film and m icro-structure of nanometer-scale SnO anodes in lithium rechargeable batteries[J].Electrochem ical and Solid-State Letters,1998,1(6):241-243.

