β-连环蛋白与细胞周期蛋白 D1在宫颈鳞癌中的表达及意义
史慧星,陈 云,游庆朋,杨 磊,袁 红
宫颈癌是女性常见恶性肿瘤,宫颈癌的发生与发展是多因素多阶段演变的结果,多种癌基因及抑癌基因参与了癌变过程。今后的目标是在力争早期诊断的同时,在分子生物学基础上确定宫颈癌发生及发展的始动环节,采用针对性的靶向治疗。Wnt信号传导通路是一种对控制胚胎发育有重要作用、进化上保守的信号传导通路,其决定细胞的分化和增生。研究表明 Wnt信号传导通路不恰当的激活参与了多种人类肿瘤的发生和发展。Wnt通路致癌的关键是 β-连环蛋白 (β-catenin)降解障碍致使胞质内游离的 β-catenin聚集并与 Tcf/lef结合进入细胞核,激活下游靶基因细胞周期蛋白 D1(cyclinD1)的转录,导致肿瘤的发生。Wnt信号通路途径的改变在大肠癌发生中的作用已较明确,在其他恶性肿瘤中的改变也显示出重要意义,深入了解该途径的特点及其在宫颈癌中的变化对于宫颈癌的早期诊断、预后判断及靶向治疗研究具有重要的意义。本研究应用免疫组织化学方法检测正常宫颈鳞状上皮组织、宫颈上皮内瘤样病变 (cervical intraepithelial neoplasia,CIN)、宫颈鳞癌组织中 β-catenin与 cyclinD1的表达情况,分析其表达率的变化,探讨其在 Wnt信号通路中对宫颈鳞癌发生、发展的作用。
1 对象与方法
1.1 研究对象 标本来源于 2007年 4月—2008年 12月河北省邢台市人民医院及邢台矿业集团总医院病理科宫颈癌手术和活检的存档蜡块。患者术前均未行放疗或化疗。宫颈鳞状细胞癌 42例 (宫颈癌组),按组织学分级:Ⅰ级 8例;Ⅱ级 22例;Ⅲ级 12例。其中有淋巴结转移者 10例,无淋巴结转移者 32例。患者年龄 31~68岁,平均 48.9岁。CIN 20例 (CIN组,其中 CINⅡ级 9例,CINⅢ级 11例)。同时取正常宫颈组织 8例作为正常对照组。
1.2 试验材料 β-catenin鼠抗人单克隆抗体为 ZYMED公司产品。CyclinD1兔抗人多克隆抗体为 Labvision公司产品。羊抗鼠二步法通用型试剂盒。羊抗兔二步法通用型试剂盒。EDTA抗原修复液。封闭用正常山羊血清工作液。显色底物:3,3-二氨基联苯胺 (DAB)。以上试剂均购自北京中山生物技术有限公司。
1.3 方法 (1)采用 β-catenin免疫组织化学染色:二甲苯脱蜡 10 min×2,梯度乙醇入水 (100%×1,90%×1,80%×1)各 10 min,PBS缓冲液 5 min×1,在 3%甲醇 -过氧化氢混合液室温 15 min,灭活内源性过氧化物酶,PBS缓冲液 5 min×3,EDTA抗原修复液,微波炉高火 2.5 min,解冻档 10 min,室温冷却 30 min,PBS缓冲液 5 min×3,10%山羊血清封闭,湿盒内室温 30 min,β-cat鼠抗人单克隆抗体 (工作液 1:100),湿盒内 4℃过夜,PBS缓冲液 5 min×3,羊抗鼠二步法工作液湿盒内室温 30 min,PBS缓冲液 5 min×3,DAB显色液,组织显色后用自来水中止反应,Mayer氏苏木精染液20 s,自来水冲洗,乙醇脱水 (80%×1、90%×1、100%×1)各 10 min,二甲苯透明,中性树脂封片。 (2)cyclinD1免疫组织化学染色。方法同上,以 cyclinD1兔抗人多克隆抗体和羊抗鼠二步法工作液代替 β-cat鼠抗人单克隆抗体和羊抗鼠二步法工作液。
1.4 结果判定标准 β-catenin:正常表达定位于细胞膜,细胞膜上有均匀的棕黄色着色,而胞浆中无染色或仅有微弱着色。细胞膜染色明显减弱或消失同时胞浆或细胞核着色则判定为异常表达。cyclinD1:CyclinD1染色后棕黄色颗粒位于细胞核为阳性,以阳性细胞计数。染色细胞 <5%为阴性 (-),≥5%阳性细胞为阳性 (+)。
1.5 统计学方法 采用 SPSS 11.5统计软件包进行统计分析。采用 χ2检验,四格表确切概率法和 Spearman相关分析,以 P<0.05为差异有统计学意义。
2 结果
2.1 β-catenin在正常宫颈鳞组织、CIN及宫颈癌中的表达β-catenin在 8例正常宫颈鳞状上皮组织中均未见异位表达(见图1),在 CIN、宫颈鳞癌组织中的异位阳性表达率比较,差异有统计学意义 (χ2=4.69,P<0.05)。正常宫颈组织中 β-catenin主要在胞膜表达,CIN和宫颈鳞癌中 β-catenin在胞膜表达明显减弱或缺失,随着病变的发展,β-catenin逐渐呈现在细胞质内表达,而宫颈鳞癌中胞质的表达进一步增强,但本组未发现有明显的细胞核内表达 (图 2~3)。β-catenin在宫颈鳞癌不同组织分级中异位表达率间差异有统计学意义(χ2=9.30,P<0.01);CIN组因例数较少未再行不同分级间比较。宫颈鳞癌淋巴结转移组 β-catenin异位阳性表达率与未转移组比较差异无统计学意义 (χ2=0.00,P>0.05,见表 1~2)。
2.2 cyclinD1在正常宫颈组织、CIN及宫颈鳞癌中的表达cyclinD1在正常宫颈上皮细胞中均未见阳性表达,cyclinD1阳性表达定位于细胞核 (见图 4~5)。cyclinD1在 CIN、宫颈鳞癌组阳性表达率间差异有统计学意义 (χ2=5.52,P<0.05,见表 1)。在宫颈鳞癌各分级组织中 cyclinD1阳性表达率间差异有统计学意义 (χ2=5.52,P<0.05);宫颈鳞癌淋巴结转移组 cyclinD1的阳性表达率与未转移组比较差异无统计学意义(χ2=0.36,P>0.05,表 1~2)。
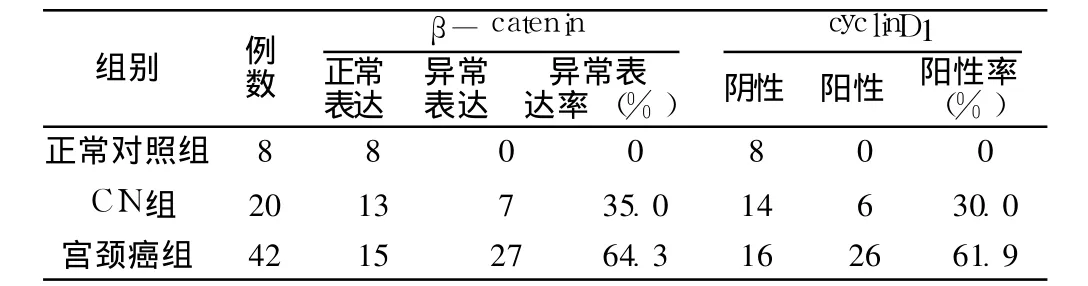
表1 β-catenin、cyclinD1在正常对照组、CIN及宫颈鳞癌组织中的表达比较Table 1 The expression ofβ-catenin and cyclinD1 in squamous cervical carcinoma,cervical intraepithelial neoplasia
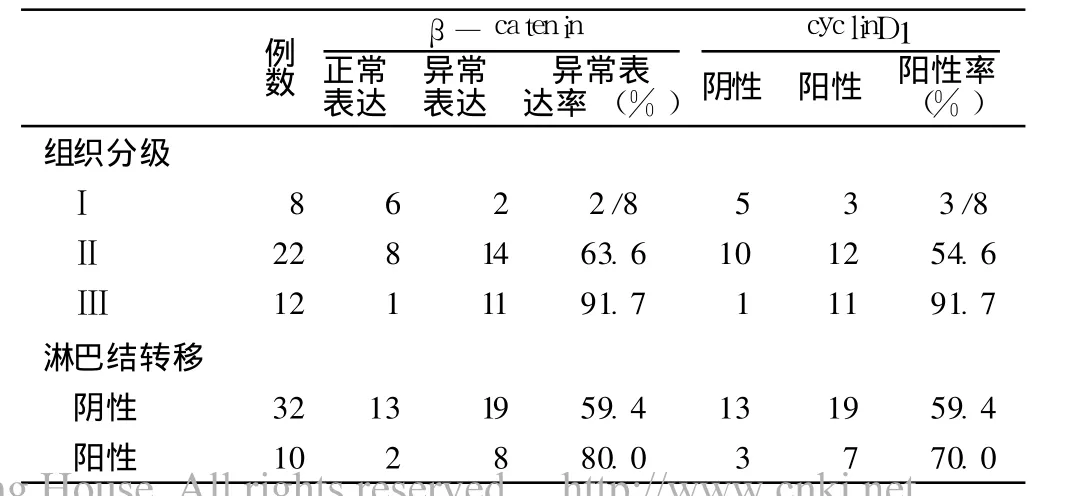
表2 β-catenin、cyclinD1在宫颈鳞癌中的表达与组织分级及淋巴结转移的关系Table 2 Correlation between the expression ofβ-catenin and cyclinD1 and tumor differentiation and lymph node involvement in squamous cervical carcinoma
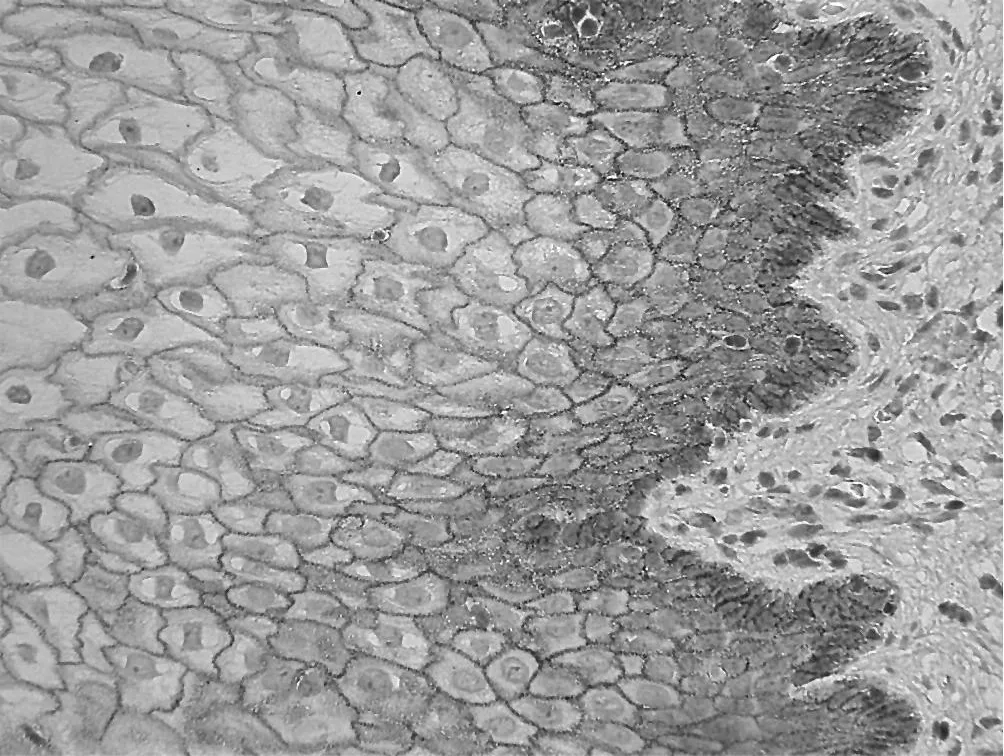
图1 β-catenin在正常组织中的表达 (×400)Figur e 1 Membranous immunostaining ofβ-catenin in normal squamous cervical epithelium

图2 β-catenin在 CIN组织中的表达 (×400)Figure 2 Abnormal expression ofβ -catenin in CIN

图3 β-catenin在宫颈鳞癌组织中的表达 (×400)Figur e 3 Ectopic cytoplasmic accumulation ofβ -catenin in squamouscervical carcinoma
2.3 宫颈鳞癌组织中 β-catenin与 cyclinD1表达之间的关系
在宫颈鳞癌组织中 β-catenin与 cyclinD1共阳性表达有 21例,共阴性表达有 10例,β-catenin的异常表达与 cyclinD1的阳性表达呈正相关 (r=0.885,P<0.05,见表 3)。
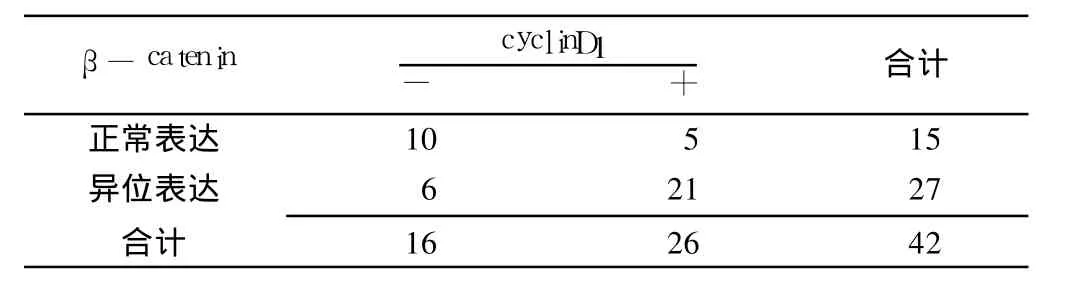
表3 β-catenin与 cyclinD1在宫颈鳞癌中表达的相关性Table 3 Relationship between expression ofβ -catenin and cyclinD1 in squamous carcinoma of the uterine cervix

图4 CyclinD1在 CIN组织中的表达 (×400)Figure 4 Expression of cyclinD1 in CIN
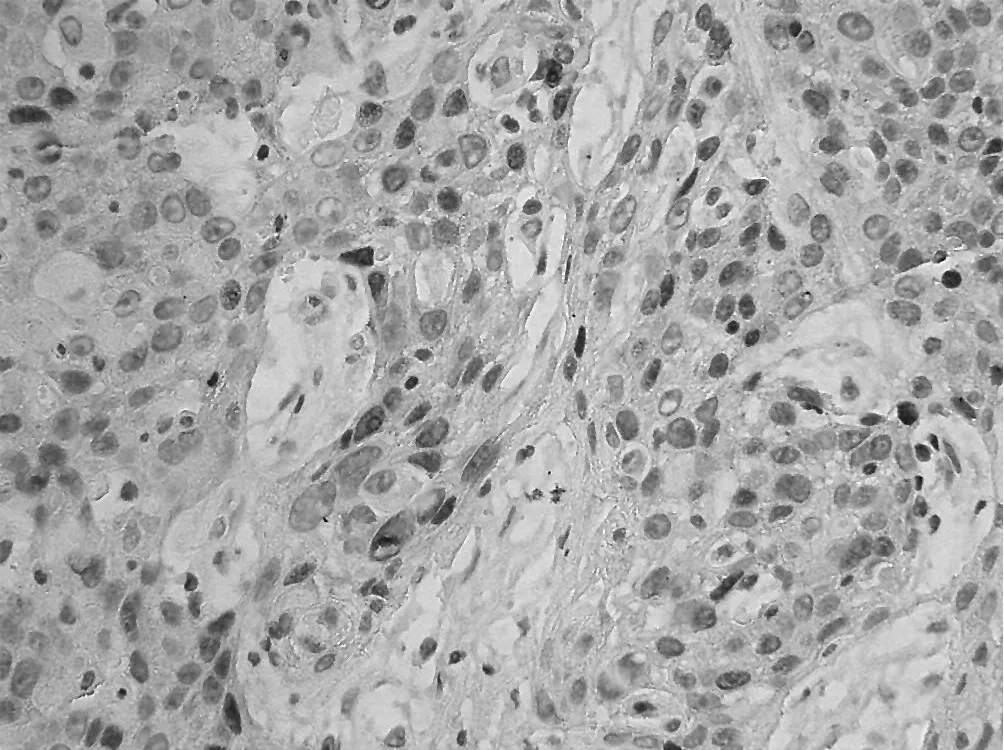
图5 CyclinD1在宫颈鳞癌组织中的表达 (×400)Figur e 5 Overexpression of cyclinD1 in squamous cervical carcinoma
3 讨论
宫颈癌是全球妇女中仅次于乳腺癌的第二大常见恶性肿瘤,在发展中国家女性中其发病率居第一,据世界范围内的统计,每年大约有 50万宫颈癌新发病例,占所有癌症新发病例的 15%,因此研究多种肿瘤相关因子与宫颈癌发生与发展的关系尤为重要[1]。
恶性肿瘤的发生、浸润和转移涉及癌细胞与细胞外基质相互作用的一系列复杂过程中细胞粘附是一个重要环节。βcatenin是一种多功能的胞浆蛋白,既能与 E-钙粘素 (E-cadherin)组成复合体,又是 Wnt信号传导通路的重要调控因子,参与细胞的生长分化、黏附、组织修复、肿瘤发生及转移。正常情况下,β-catenin与 E-cadherin的胞浆部分形成 β-catenin/E-cadherin复合体,定位于细胞膜,维持上皮细胞的极性和完整性。在胞浆中 β-catenin的水平通过两组蛋白质的功能竞争来调节:一组为破坏复合体,是由 GSK3、Axin及APC组成的一种较大的蛋白复合体,起破坏 β-catenin的作用,使其保持低水平,从而关闭 Wnt信号传导通路;另一组为拮抗蛋白类,在对 Wnt信号反应时被活化,起拮抗破坏复合体的作用,使 β-catenin的水平升高,开启 Wnt信号传导通路[2-3]。正常情况下,β-catenin在细胞内保持低水平,Wnt信号传导通路处于关闭状态。cyclinD1是 Wnt信号传导通路的下游靶基因之一[4]。当 Wnt/β-catenin途径处于激活状态时,β-catenin蛋白在细胞质及胞核中累积,作用于 cyclinD1启动子中 LEF-1结合位点而激活其转录,cyclinD1与细胞周期蛋白依赖性激酶 (cyclin dependent kinases,CDKs)结合并激活后者,诱导成人视网膜细胞瘤易感基因 (Rb)产物的磷酸化。使 Rb与转录因子 E2F解离,游离的 E2F进入细胞核内促进基因转录,使细胞完成由 G1期到 S期的转换进入增殖阶段[5]。目前已知人类多种恶性肿瘤中存在 Wnt/β-catenin通路激活。免疫组织化学研究已表明在宫颈鳞状细胞癌中发现 β-catenin和 cyclinD1的异常表达及高表达[6-10],但在 Wnt信号通路中,cyclinD1作为 β-catenin主要调节的靶基因,两者在宫颈癌中表达的相关性尚不明确,未见相关报道。本研究对 42例宫颈鳞癌进行了 β-catenin和 cyclinD1蛋白表达的相关性进行了研究,以进一步观察 Wnt信号通路在该肿瘤发生发展中的作用。
本研究结果显示:β-catenin及 cyclinD1在宫颈鳞癌中的异位表达及过表达分别达 64.3%及 61.9%,与其他文献报道相似[6-10]。相关分析显示两者存在正相关,且随着正常宫颈组织→CIN→鳞癌的转化,β-catenin及 cyclinD1的异常表达呈递增趋势,说明 Wnt/β-catenin通路的激活与宫颈鳞癌的发生密切相关。本结果还显示了 β-catenin异位表达及 cyclinD1过表达与宫颈鳞癌的组织分级成正相关,表明 β-catenin的异常表达可能与肿瘤的恶性行为和去分化有一定的关系,是肿瘤细胞获得高增殖活性和侵袭性的原因之一。由于本组随访不全,未能做相关预后方面的统计分析。但有文献显示 βcatenin的异常表达与宫颈癌患者预后无关[10]。
但目前对 Wnt/β-catenin通路在宫颈癌中异常激活的具体环节尚不完全清楚。β-catenin基因在宫颈癌中突变率并不高,有报道为 17%甚至更低[11-12],说明 β-catenin基因突变可能仅在少数宫颈癌发生及发展中起作用。另有人研究发现APC启动子甲基化在宫颈癌中是一个频繁事件,可能参与了Wnt/β-catenin信号通路异常激活[13-14]。
综上所述,β-catenin及 cyclinD1在宫颈鳞癌中的异位表达及过表达分别达 64.3%及 61.9%,且随着正常宫颈组织→CIN→鳞癌的转化,β-catenin及 cyclinD1的异常表达呈递增趋势,β-catenin异位表达及 cyclinD1阳性表达均与宫颈鳞癌分化相关,随着宫颈癌的组织分级增高,β-catenin异位阳性表达、cyclinD1阳性表达逐渐增强,但两者均与淋巴结是否转移无关。以上结果表明 Wnt信号通路可能在宫颈发生发展中起着重要的作用。
1 徐秋霞,关红琼.中期因子在宫颈癌组织中表达的临床意义 [J].中国全科医学,2010,13(5):1613.
2 Miller JR.Wnt signaling Transduction[M].//Alison M.The Cancer Handbook.London:Nature Publishing Group,2002:195-208.
3 Miller JR.Mechanism and function of signal transduction by the Wnt/beta-catenin and Wnt/Ca2+pathways[J].Oncogene,1999,43:153-190.
4 Tetsu O,Mc Cormick F.Beta-catenin regulates expression of cyclinD1 in colon carcinoma cells[J].Nature,1999,398(6726):422-426.
5 Jares P,Fernandez PL,Campo E,et al.PRAD-1/cyclinD1 gene amplification correlates with messenger RNA over-expression and tumor progression in human laryngeal carcinomas[J].Cancer Res,1994,54:4813.
6 古丽娜.库尔班,李小文,等 .β-catenin,CyclinD1和 C-myc在宫颈鳞癌中的表达及其意义 [J].新疆医科大学学报,2008,31:641-644.
7 何凯,田雪红,张国杰,等.CyclinD1和 P27在宫颈鳞癌中的表达及临床意义 [J].中国实验诊断学,2005,9:549-552.
8 张丽颖,李福琴,艾丽敏,等.β-连环素与上皮型钙粘蛋白在宫颈鳞癌中的表达及意义 [J].哈尔滨医科大学学报,2003,37:500-502.
9 李东辉,李明众,张薛榜.β-catenin和 Ki-67在人宫颈癌组织中的表达及其意义 [J].实用癌症杂志,2007,22:28-30.
10 Fadare O,Reddy H,Wang J,et al.E-cadherin andβ-catenin expression in early stage cervical carcinoma:a tissue microarray study of 147 cases[J].World JSurg Oncol,2005,3:38-48.
11 Teng Y,Wang X,Wang Y,et al.Wnt/beta-catenin signaling regulates cancer stem cells in lung cancer A549 cells[J].Biochem Biophys Res Commun,2010,12:373-379.
12 Khalida MY,Huilgol NG,Hongyo T,et al.Mutations in cervical cancer as predictive factors for radiotherapy[J].Internatonal Congress Series,2002,1236:459-461.
13 Dong SM,Kim HS,Rha SH,et al.Promoter hypermethylation of multiple genes in carcinoma of the uterine cervix[J].Clin Cancer Res,2001,7:1982-1986.
14 Zambrano P,Segura-Pacheco B,Perez-Cardenas E,et al.A phase I study of hydralazine to demethylate and reactivate the expression of tumor suppressor genes[J].BMC Cancer,2005,5:44-55.

