微量清蛋白尿对重症脓毒症患者预后的预测意义
吴玉娟,朱 明,曲 海,杨贺英
重症医学的发展,不仅体现在诊断水平与治疗手段的提高,还体现在对危重患者的病情和预后进行及时准确的评估和预测。重症脓毒症 (severe sepsis,SS)是 ICU常见的危重症。提高对重症脓毒症患者病情评估和预后预测的准确性,有助于临床医生客观而科学的量化病情,尽早识别高危患者,以指导临床诊疗方案的抉择。有研究显示微量清蛋白尿 (MAU)与一些危重症患者器官功能障碍的发生率和病死率增高相关。本研究检测重症脓毒症患者尿微量清蛋白 (MA)水平,动态观察尿 MA与尿肌酐比值 (ACR)变化,探讨 MAU对重症脓毒症患者预后的预测价值。
1 资料与方法
1.1 入选标准 年龄≥18岁,入住 ICU时间≥48 h。重症脓毒症诊断标准根据1992年美国胸科医师学会 (ACCP)和危重病医学会 (SCCM)联席会议制定的标准[1]。
1.2 排除标准 尿蛋白 (+)或以上;有泌尿系统损伤而致血尿或有尿路感染;有慢性肾脏疾患,血肌酐 (Scr) >176 μmol/L;近期使用过有肾毒性药物;妊娠期妇女;入住 ICU时间 <48 h。
1.3 临床资料 选择 2009年6月—2010年 2月符合入院标准的重症脓毒症患者 31例为研究对象,其中男 18例,女 13例;年龄 18~85岁,平均 (62.3±19.8)岁。
1.4 方法 记录患者性别、年龄、入 ICU时间、原发疾病、有无高血压及糖尿病病史。测定患者的血常规、生化、动脉血气分析等指标,入 ICU后 24 h内行急性生理和慢性健康状况评分系统 (APACHEⅡ)评分、感染相关器官功能衰竭 (SOFA)评分 (各参数取 24 h内最差值)。机械通气的通气模式及参数均基本一致,模式均用 BIPAP,调整压力值使潮气量在450~550 ml之间,并记录机械通气治疗时间。记录患者的死亡时间或转出 ICU时间、总住院时间。观察起点为入 ICU时,观察终点为死亡或转出 ICU。
入选患者均留置无创性囊状导尿管,分别于入 ICU后 1 h(ACR0)、24 h(ACR1)、48 h(ACR2)从尿管内直接抽取尿标本 10 ml,分别测定尿 MA及尿肌酐,采用 ACR作为评价指标[2]。对于未能及时检测的尿标本保存在 4℃的冰箱内,最长不超过 24 h。按照入 ICU后第一个 48 h内 ACR的变化计算△ACR(△ACR=ACR2-ACR0),若△ACR≥0,则为△ACR增高组;若△ACR<0,则为△ACR下降组。
1.5 尿 MA和尿肌酐的检测 尿 MA的检定采用免疫比浊法,尿肌酐的测定采用肌酐酶法。严格按照规定的采样时间用无菌空针从导尿管抽取随机尿液 10 ml,3 000 r/min,离心 5min,清除细胞和其他碎片,取上清液待检,待测标本分为两份,测定尿 MA同时测定尿肌酐,尿肌酐标本用去离子水稀释 10倍,参考生化分析操作 SOP文件,选择定标液,完成定标;选择质控品完成质控,安装离心好的样本进行标本测试。参考范围:尿 MA 0~20 mg/L,ACR<2.7 mg/mmol。
1.6 APACHEⅡ评分[3]选用 APACHEⅡ评分评价病情严重程度,由急性生理学评分 (APS)、慢性健康状况评分 (CPS)和年龄评分三部分组成,总分 71分。其中 APS包括体温、平均动脉压、心率、呼吸频率、动脉血氧分压、p H值、血清中Na+和 K+水平、血肌酐、红细胞比容、白细胞计数及格拉斯哥昏迷 (GCS)评分等 12项参数,每项 0~4分,总分 0~60分。CPS为 2或 5分,年龄评分 0~6分。
本文要点
本研究通过对入住 ICU的 31例重症脓毒症患者连续观察 48 h尿微量清蛋白与尿肌酐之比 (ACR)的动态变化,比较其与急性生理和慢性健康状况评分系统 (APACHEⅡ)评分、感染相关器官功能衰竭 (SOFA)评分的相关性;及其与 APACHEⅡ评分、SOFA评分对重症脓毒症患者 ICU内死亡的预测分辨度,得出 ACR的变化趋势与重症脓毒症患者的预后相关,具有与 APACHEⅡ评分、SOFA评分相似的死亡预测分辨度,可作为判断此类患者在 ICU内预后的一个早期预测指标。
1.7 SOFA评分[4]选用 SOFA评分评价器官功能受损程度,包括对呼吸、循环、肾脏、凝血、肝脏及中枢神经系统共 6个器官系统的评估,相应的指标为氧和指数、平均动脉压、血肌酐、血小板计数、血胆红素及 GCS评分共 6项,每项 0~4分,总分 0~24分。通常定义 SOFA评分 1或 2分为器官功能障碍,≥3分为器官功能衰竭。
1.8 统计学方法 采用 SPSS 12.0统计软件进行统计学分析,用非参数检验中的 1-Sample K-S命令项对计量资料的分布类型进行检验,正态分布资料采用 (x ±s)表示,两个均数比较采用 t检验;偏态分布资料以中位数 (四分位数间距)表示,采用两个独立样本的非参数检验,即 Mann-Whitney检验。率的比较采用 χ2检验。两个变量之间的相关性分析用Spearman检验。 ACR0、ACR1、ACR2、△ACR、APACHEⅡ评分及 SOFA评分对患者 ICU内病死率的预测价值采用 ROC曲线下面积比较。以 P<0.05为差异有统计学意义。
2 结果
2.1 死亡组和存活组比较 31例患者存活 23例,死亡 8例。死亡组 ACR2、△ACR、APACHEⅡ评分、SOFA评分较存活组均明显升高,差异有统计学意义 (P<0.05);死亡组及存活组年龄、性别构成、高血压病史、糖尿病病史、ACR0、ACR1、ICU停留时间、总住院时间、机械通气时间比较,差异无统计学意义 (P>0.05,见表 1)。
2.2 △ACR增高组和△ACR下降组比较 △ACR增高组ACR2、APACHEⅡ评分、SOFA评分、机械通气时间及病死率较△ACR下降组均明显升高,差异有统计学意义 (P<0.05);△ACR增高组和△ACR下降组年龄、性别构成、高血压病史、糖尿病病史、ACR0、ACR1、ICU停留时间、总住院时间比较,差异无统计学意义 (P>0.05,见表 2)。
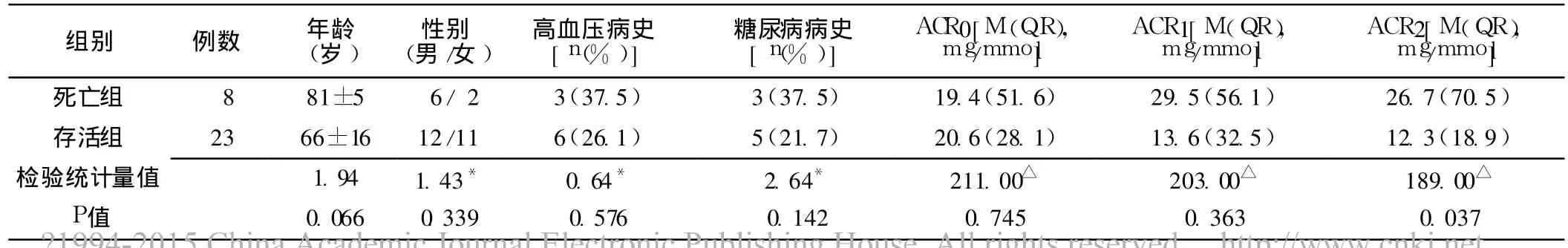
表1 死亡组及存活组临床资料比较Table 1 Comparison of clinical data between death group and survival group
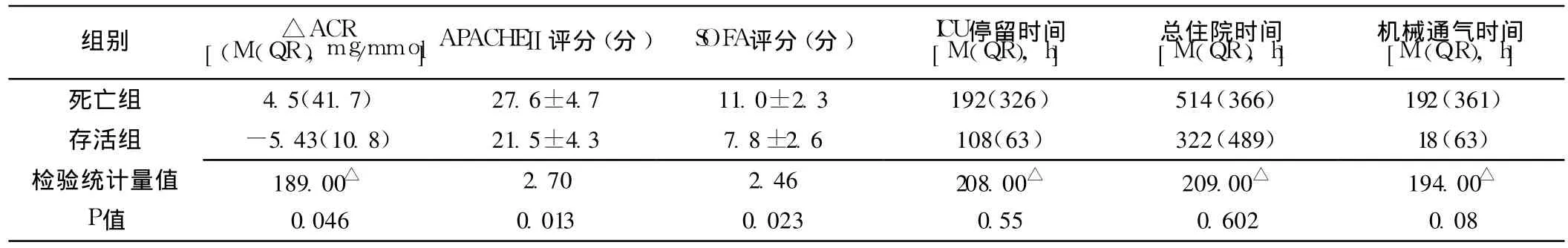
注:*为χ2值,△为 W值,余检验统计量值为t值;ACR=尿微量清蛋白与尿肌酐比值,APACHEⅡ =急性生理和慢性健康状况评分系统,SOFA=感染相关器官功能衰竭
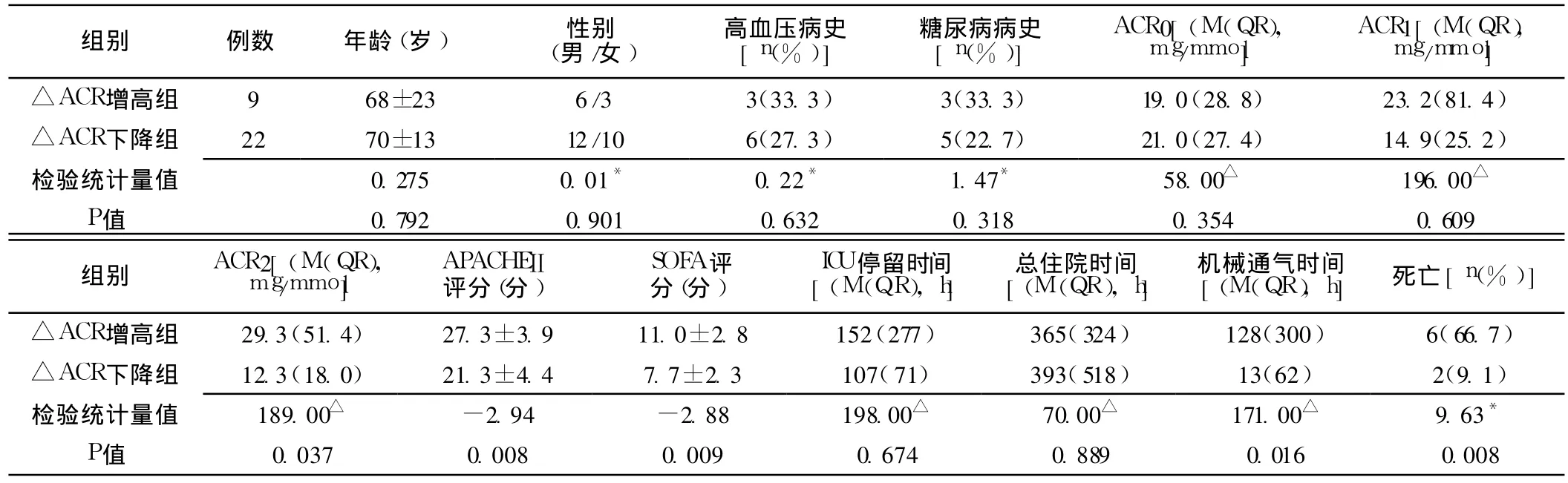
表2 △ACR增高组和△ACR下降组临床资料比较Table 2 Comparison of clinical data between△ACR increased group and△ACR decreased group
2.3 ACR与各评分之间的相关性 患者入 ICU后 ACR1、ACR2与 APACHEⅡ评分呈正相关 (rs分别为 0.456、0.512,P<0.05);ACR1、ACR2与 SOFA评分呈正相关 (rs分别为0.636、0.668,P<0.05,见表 3)。
2.4 △ACR增高预测患者 ICU内死亡的敏感度和特异度分别为 75.0%和 87.0%,阳性预测值和阴性预测值分别为 66.7%和 90.9%(见表 4)。
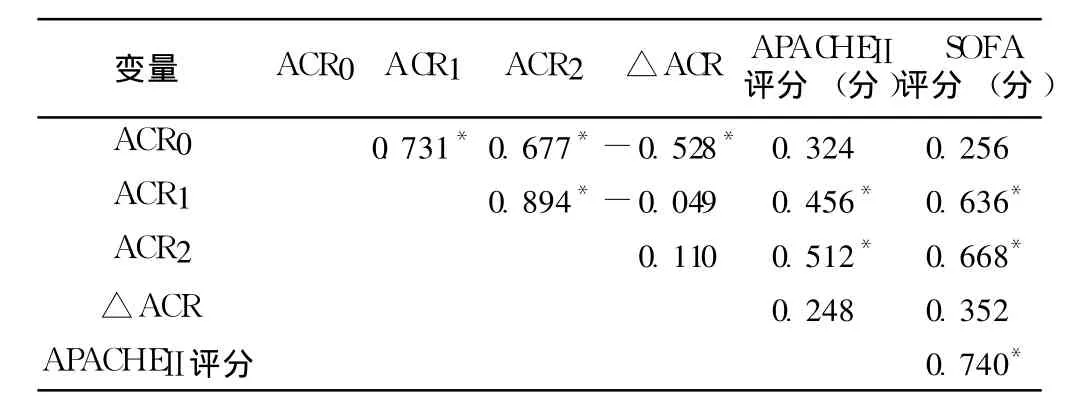
表3 ACR与各评分之间的相关性Table 3 Correlation between ACR and the scores
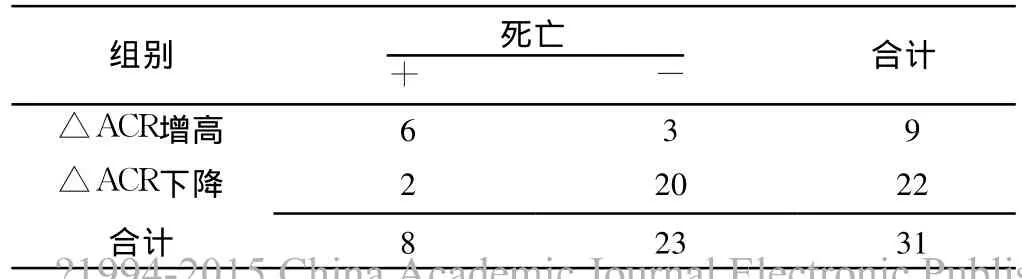
表4 △ACR增高对重症脓毒症患者死亡的预测Table 4 △ACR increased death in patients with severe sepsis predict
2.5 ACR及各评分对 ICU内患者死亡预测 ROC曲线下面积ACR0、ACR1、ACR2、△ACR及 APACHEⅡ评分、SOFA评分对 ICU内死亡预测 ROC曲线下面积分别为 0.556、0.689、0.856、0.800、 0.856、0.833(见表 1,图 1)。

表5 ROC曲线下面积Table 5 The area under the ROC
3 讨论
目前有关尿 MA对危重患者病情评估和预后预测的研究认为,MAU的实质是反映全身毛细血管内皮细胞功能障碍[5-7],其用于危重病领域的理论基础为:(1)当机体遭受创伤、感染、外科手术、缺血性再灌注损伤时,大量促炎因子和炎性递质的级联释放,失控的炎性反应作用于微血管内皮细胞,导致内皮细胞功能障碍,微血管通透性增加,液体漏出,组织水肿,多器官功能障碍,毛细血管内皮细胞早期即参与了这一病理过程[8-9]。(2)由于肾脏接受心输出量的 25%,各种促成危重疾病的外源性、内源性因子均可通过肾循环造成肾小球损伤,当肾小球毛细血管通透性增加时,清蛋白和其他血浆蛋白的滤出增加,健康肾脏可重吸收 95%以上滤过的清蛋白,但这一机制已接近饱和,肾小球毛细血管通透性的轻微增加即可导致肾小管内滤过的清蛋白增加,超过重吸收能力,形成清蛋白尿[8-9]。(3)尿 MA的变化可出现在危重患者肾损害早期,早于传统生化指标和常规尿蛋白检查,监测 MAU可作为直观了解肾脏功能的一个早期指标[10],而肾受累是许多危重症的并发症之一,直接影响患者的预后。
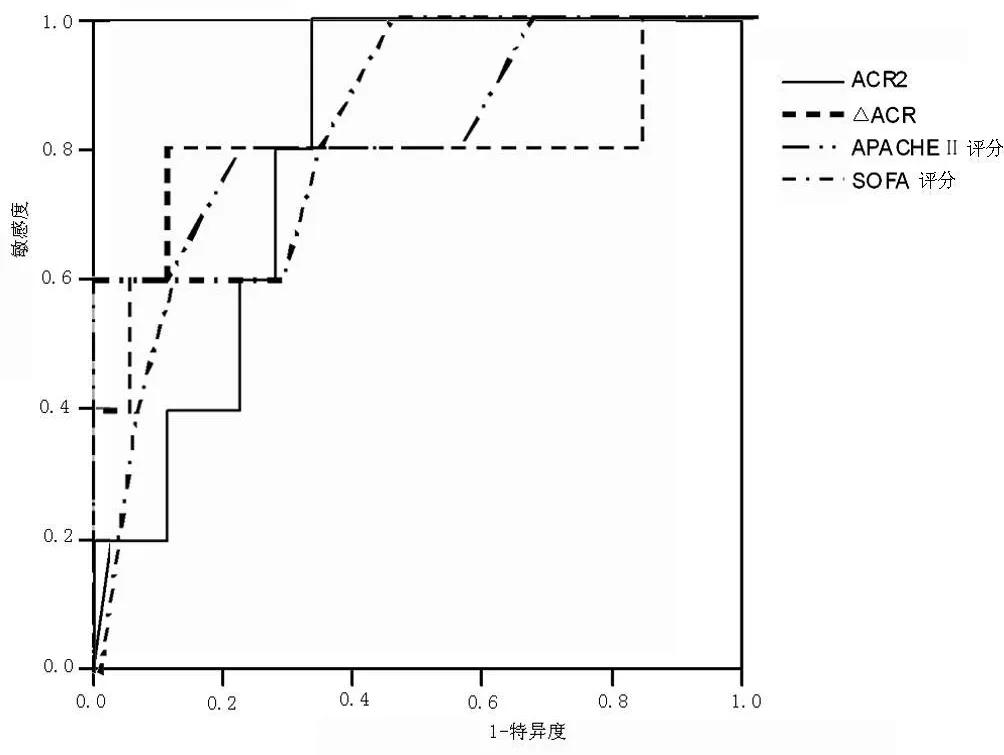
图1 ACR及各评分对死亡预测 ROC曲线下面积Figur e 1 The area under the ROC curve ACR and score the relevance of death in ICU
大量动物和临床研究也发现,在急性炎性反应的早期阶段,肾小球毛细血管通透性增加,MAU尿明显增加[11]。De Gaudio等[6]对术后有无并发脓毒症患者的分组研究发现,并发脓毒症组患者的 ACR和 SOFA评分较入科时均明显增加,提示早期连续监测 MAU可预示并发全身性炎性反应、多器官功能不全等并发症。另外,有文献报道,MAU作为全身性炎症反应 (SIRS)的早期标志物,可较 CRP、血清降钙素原(PCT)等传统监测指标早 2 d出现变化,测定 MA也许较测定某一促炎或抗炎因子更有意义[9]。MAU的实质是反映微血管内皮细胞功能障碍,毛细血管渗漏综合征存在,动态测定 MA可反映患者病情随治疗干预措施的变化,对治疗干预措施做出评价。
大多数研究支持组织损伤或术后 6~48 h测定 MA对患者病情评估和预后预测有重要价值[5,7,12-13]。本研究中,尽管△ACR对患者预后的辨别力 (0.800)略逊于 ACR2(0.856),考虑到危重患者病程的演变是一个连续的过程,危重患者的预后在很大程度上受病情发展的影响,器官功能障碍或衰竭的累积情况对预后有重要价值,因而动态监测 MA的趋势,而不是某一测定值更有意义,Abid等[12]的研究也支持这一观点,本研究除对死亡组和存活组患者各时间点的 ACR进行比较外,还对 ACR的变化趋势做了比较。△ACR增高对于预测患者 ICU内死亡的灵敏度和特异度分别是 75.0%、87.0%,阳性预测值为 66.7%,阴性预测值为 90.9%,支持△ACR的变化趋势对患者 ICU内死亡具有较好的辨别度,这与 Abid等[12]和 Thorevska等[14]的研究报道一致。
考虑到 MAU对危重患者的病情评估和预后预测应针对ICU中所有人群,故未排除糖尿病或高血压患者。本研究中死亡组和存活组以及△ACR增高组和△ACR下降组患者年龄、性别及糖尿病或高血压患病率等一般特征两组间无明显差异,结果具有可比性。
APACHEⅡ评分、SOFA评分作为目前国内外 ICU中应用最为广泛而具权威的危重病病情评价系统,经过反复的实践验证,其对于预后预测的效能已被普遍认同。本研究结果也证实APACHEⅡ评分、SOFA评分分值越高,病情越重,死亡风险越大,二者与 ACR2、△ACR相比,均具有较好的预后预测价值。但 APACHEⅡ评分、SOFA评分均缺乏对胃肠道功能的评估,胃肠道不仅是消化器官,同时也是免疫器官,对其功能的评估应当包括这两个方面,而目前尚未找到评估胃肠道功能的确切指标。
有研究报道监测 MA可以作为慢性阻塞性肺疾病(COPD)患者肺部感染控制以及全身病情改善的客观指标,对指导有创机械通气治疗成功脱机时机有重要参考价值[15]。本组患者△ACR增高组机械通气时间较△ACR下降组延长,△ACR能否作为指导有创机械通气治疗成功脱机的指标值得进一步研究论证。
MA是否能用于 ICU危重患者病情评估和预后预测,观点尚不一致。本研究证实,入 ICU 48 h以上的患者中,MAU有很高的发生率。入 ICU后第一个 48 h的 ACR(即 ACR2)和ACR的动态变化 (即△ACR)与重症脓毒症患者的预后存在相关性,其增高提示患者有更高的病死率。△ACR对于重症脓毒症患者 ICU内死亡的预测,与 APACHEⅡ、SOFA评分具有相似的分辨度,可作为这类患者在 ICU内预后的一个早期预测指标。动态监测 MAU的变化趋势较某一单次测定值更有意义。
1 American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference.Definitions for sepsis and multiple organ failure and guidelines for the use of innovative the rapies in sepsis[J].Crit Care Med,1992,20(6):864-874.
2 Gosling P.Microalbuminuria and cardiovascular risk:a word of caution[J].JHum Hypertens,1998,12(4):211-213.
3 Knaus WA,Draper EA,Wagner DP,et al.APACHEⅡ :a severity of disease classification system[J].Crit Care Med,1985,13(10):818-829.
4 Vincent JL,Moreno R,Takala J,et al.The SOFA(Sepsis-related Organ Failure Assessment)score to describe organ dysfunction/failure.On behalf of the working group on sepsis-related problems of the european society of intensive care medicine[J].Intensive Care Med,1996,22(7):707-710.
5 De Gaudio AR,Spina R,Di Filippo A,et al.Glomerular permeability and trauma:a correlation between microalbuminuria and injury severity score[J].Crit Care Med,1999,27(13):2105-2108.
6 De Gaudio AR,Adembri C,Grechi S,et al.Microalbuminuria as an early index of impairment of glomerular permeability in postoperative septic patients[J].Intensive Care Med,2000,26(9):1364-1368.
7 Mac Kinnon KL,Molnar Z,Lowe D,et al.Use of microalbuminuria as a predictor of outcome in critically ill patients[J].Br J Anaesth,2000,84(2):239-241.
8 刘晓伟,刘志.严重脓毒症并发急性肾衰竭患者 92例临床研究[J].中国全科医学,2010,13(3):738.
9 Gosling P.Critical illness:a view from thekidney[J].Crit Care Med,2006,34(6):1852-1853.
10 Gosling P,Manji M,Czyz J.Microalbuminuria:timing is everything![J].Intensive Care Med,2003,29(8):1394-1395.
11 Tisi PV,Hulse M,Chulakadabba A,et al.Exercise training for intermittent claudication:does it adversely affect biochemical markers of the exercise-induced inflammatory response?[J].Eur J Vasc Endovasc Surg,1997,14(5):344-350.
12 Abid O,Sun Q,Sugimoto K,et al.Predictive value of microalbuminuria in medical ICU patients:results of a pilot study[J].Chest,2001,120(6):1984-1988.
13 Molnar Z,Szakmany T,Koszegi T.Prophylactic N-acetylcysteine decreases serum CRP but not PCT levels and microalbuminuria following major abdominal surgery[J].Intensive Care Med,2003,29(3):391-395.
14 Thorevska N,Sabahi R,Upadya A,et al.Microalbuminuria in critically ill medical patients:prevalence,predictors,and prognostic significance[J].Crit Care Med,2003,31(4):1075-1081.
15 戚佳飞,单红卫.尿微量蛋白监测对 COPD机械通气患者脱机的指导价值 [J].中国急救医学,2006,26(10):702-703.

