夹脊电针治疗对大鼠神经根型颈椎病模型丘脑痛感区 FOS蛋白及脊髓背角COX-2蛋白含量的影响
高曦,李倩,张海兵,李登宇,孙忠人
(黑龙江中医药大学,哈尔滨 150040)
夹脊电针治疗神经根型颈椎病有着可靠地临床镇痛疗效,且无明显不良反应。但我们发现对夹脊电针治疗神经根型颈椎病根性痛的机制尚不明确,给治疗方法的临床推广带来了诸多的困难。
本实验旨在探讨夹脊电针对颈神经根炎的颈椎病模型大鼠的丘脑痛感区 FOS蛋白及脊髓背角COX-2蛋白含量表达的影响,为从分子生物学角度,明确夹脊电针针刺效应与中枢镇痛的关系,揭示夹脊电针治疗神经根型颈椎病的镇痛机制,为夹脊电针临床治疗神经根型颈椎病提供实验依据。
1 材料和方法
1.1 材料 取成年 Wistar大鼠 40只,体质量(300±20)g,由黑龙江中医药大学实验动物中心提供。主要仪器试剂:脑立体定向仪(江湾 I型),德国莱卡 2135型切片机,美国 Moticam3000显微摄影成像系统,上海一恒电热恒温箱,医用微波炉,KWD-808I全能脉冲电疗仪,免疫组织化学 FOS抗体、COX-2一抗抗体(Santa Cruz公司)。
1.2 方法
1.2.1 分组与治疗 将 40只大鼠随机分为健康对照组、模型对照组、手针对照组和电针治疗组,每组10只。健康对照组:正常饲养,不做任何处置。模型对照组:于造模后第 3天开始,每日抓取 1次,不做针刺处置。手针对照组:于造模后第 3天开始手针治疗。电针治疗组:于造模后第 3天开始电针治疗。根据中国针灸学会实验针灸研究会制定的动物针灸穴位图谱[1],取双侧 C6、C7“夹脊”(位于大鼠颈椎棘突间旁开约0.5 cm处),常规消毒穴区皮肤,选用华佗牌 28号 0.5寸不锈钢毫针,直刺进针,进针深度 0.3~0.6 cm,轻捻转提插后,针柄接 KWD-808I全能脉冲电疗仪,夹脊穴正负极左右交替联。密波型,频率 75Hz,电流强度以大鼠颈肌及前肢轻度抖动为度。1次/d,每次 15 min。连续治疗 3周后处死。
1.2.2 动物模型的制作 各组大鼠在 10%水合氯醛 380mg/kg腹腔注射麻醉后,俯卧位固定于操作台上,颈前部垫小棉垫,以利颈椎后突,便于操作,以第七颈椎作为骨性标志,作颈部后正中切口,逐层切开皮肤、皮下组织、颈部筋膜,用骨刀紧贴棘突,钝性剥离左侧颈部肌肉达椎板,确认 C6-C7椎间隙,用止血钳咬除左侧 C6、C7部分椎板,显露出 C7神经根,将浸有甲醛的定量滤纸片放在 C7神经根肩上,逐层缝合,关闭切口。所有操作均在无菌条件下进行,术后每只大鼠腹腔注射青霉素 1万 u,常规饲养。
1.2.3 指标观察及检测
1.2.3.1 丘脑痛感受区 FOS蛋白表达的检测 取材:在麻醉下剖开胸腔,经左心室插管至升主动脉。先快速灌注。0.9%氯化钠溶液 100~150 ml,继之灌注含 4%多聚甲醛的 0.1mol/L磷酸缓冲液(PB,pH7.4)300~350 m l。立即断头,在脑立体定向仪(江湾 I型)上固定,参照大鼠脑立体定位图谱[2],在丘脑范围内(AP1.0~3.0)定位取脑组织块,置于上述灌流液中固定 1 h,移至 20%蔗糖溶液中过夜(4℃)。以约在 AP2.2~2.3范围内以缰核脚间束为标志冰冻切片(40μm),每块切 6~10片。
免疫组织化学法检测 FOS蛋白表达:组织切片收集于 0.01 mol/L磷酸缓冲盐溶液(PBS,pH7.4)内 30 min,浸入含 0.2%TritonX-100的 PBS内30min,FOS抗体用血清稀释液(1%牛血清白蛋白;0.2%TritonX-100,0.08%叠氮钠)稀释成 1∶500,40℃孵育 48 h,阴性对照片以正常血清代之;加二抗(Vector Lab,1∶200稀释),室温下反应 2 h;加 ABC(Vector Lab,1∶100稀释),室温下反应 1 h,DAB显色液显色 15~20min。各步骤之间均以0.01mol/L PBS液冲洗 3次。显色后贴片凉干,系列乙醇脱水,二甲苯透明,封片,光镜下观察。每只动物随机取 5张组织切片,在 Leica Qwin图像分析仪上,分别计数丘脑左右缰核脚间束外侧束旁核区域 FOS免疫阳性细胞数。
1.2.3.2 脊髓背角 COX-2蛋白表达的检测 取材:将大鼠用 8%的水合氯醛 1m l麻醉,左心室插管灌注固定,先以 250 ml 0.9%氯化钠注射溶液快速灌冲,继之灌入 250ml含 4%多聚甲醛的 0.1 M磷酸盐缓冲液(PBS)。灌注完毕后,剥离鼠脊髓颈膨大,置于上述固定液 4℃过夜,随后分别浸泡在含10%,20%,30%蔗糖的 0.1MPBS中,4℃放置。在Reichert-Jung半导体致冷的切片机(德国)上制备30μm厚冰冻冠状切片。
免疫组织化学法检测 COX-2蛋白表达:切片收集于含 30%蔗糖、30%乙二醇的 0.05M PBS中,置-20℃保存。免疫组织化学 COX-2一抗抗体(Santa Cruz公司)稀释度为 1∶400,染色步骤按华美ABC免疫组织化学检测即用型试剂盒使用说明进行,用 PBS代替一抗作为阴性对照。观察脊髓背角COX-2样免疫反应阳性细胞数的变化,经 DAB显色,阳性细胞呈红棕色。以脊髓背角的 RexedⅡ层作为主要观察部位,在 Leica Qwin图像分析仪上计数免疫阳性细胞数。
1.2.4 统计学处理 实验数据用 SPSS 13.0软件进行统计学处理。两组间比较用 t检验,多组间比较用单因素方差分析(ANOVA)。
2 结果
各组大鼠光密度测定结果比较见表 1。
表1 各组大鼠光密度测定结果比较(±s)
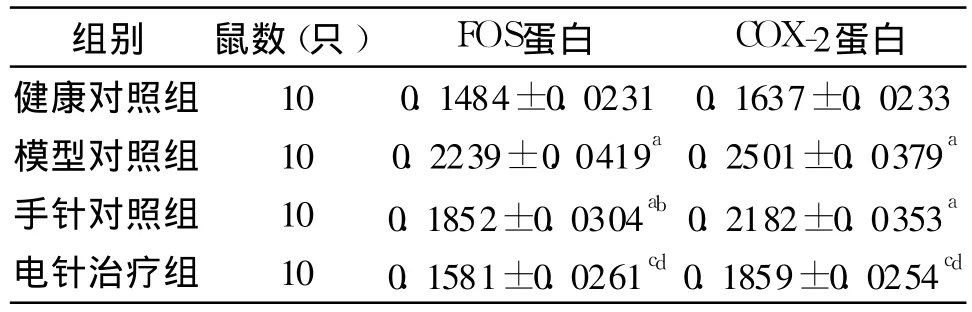
表1 各组大鼠光密度测定结果比较(±s)
注:与健康对照组比较,a P<0.01;与模型对照组比较,b P<0.05,c P<0.01;与手针对照组比较d P<0.05
组别 鼠数(只) FOS蛋白 COX-2蛋白健康对照组 10 0.1484±0.0231 0.1637±0.0233模型对照组 10 0.2239±0.0419a 0.2501±0.0379a手针对照组 10 0.1852±0.0304ab 0.2182±0.0353a电针治疗组 10 0.1581±0.0261cd 0.1859±0.0254cd
3 讨论
3.1 选穴依据 中医认为夹脊穴位于督脉与足太阳膀胱经之间,夹督脉伴太阳经而行,其定位、循行,以及作用功能与督脉和膀胱经的循行密切相关。其中,督脉能“总督诸阳”,为“阳脉之海”,督脉行于脊里,入络于脑。足太阳膀胱经在背部的循行路线上分布着脏腑的背俞穴。通过各种方法刺激夹脊穴可以畅通督脉及太阳经气而调和阴阳,为夹脊穴治疗脊柱相关疾病提供了理论依据[3-4]。
3.2 夹脊电针治疗对神经根型颈椎病大鼠丘脑痛感区 FOS蛋白及脊髓背角 COX-2蛋白含量的影响
现代研究表明,FOS蛋白是 c-fos基因的表达产物,正常生理情况下 c-fos基因在多种细胞中均有低水平的表达,参与细胞的生长、分化、信息传递等生理功能。其特征为当神经元受到某种刺激时,神经元胞核内的 c-fos基因可产生迅速表达,转录形成mRNA,进入胞浆翻译合成分子量为 55kd的核磷蛋白,即 FOS蛋白,并且在丘脑痛感区表达显著。因此,广泛用于痛觉定位和神经科学中枢通路研究[5]。
脊髓 COX-2蛋白在炎症痛的中枢敏化中起至关重要的作用。COX-2蛋白在神经元和神经胶质细胞中都有分布,外周炎症时脊髓 COX-2的表达增加,并与神经元及胶质细胞中的兴奋性氨基酸及其受体、P物质等形成中枢敏化的正反馈环路[6]。
本研究观察了大鼠丘脑痛感区 FOS蛋白及脊髓背角 COX-2蛋白含量的表达,发现颈神经根炎大鼠,FOS蛋白、COX-2蛋白含量较健康对照组的表达明显升高,这与以往的研究相符合。夹脊电针治疗能降低神经根型颈椎病大鼠丘脑痛感区 FOS蛋白及脊髓背角 COX-2蛋白的表达,对神经根组织具有保护作用。
[1] 华兴邦.大鼠穴位图谱的研制[J].实验动物与动物实验,1991,(1):1-5.
[2] 包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1994:57-64.
[3] 安光辉,赵毅,孙鹏.夹脊穴治疗颈椎病的理论与应用[J].中国临床康复,2006,10(31):130.
[4] 李金虎.活血止痛胶囊结合推拿治疗神经根型颈椎病32例疗效观察[J].中国临床保健杂志,2008,11(4):408-409.
[5] 方向义,胡海涛.中枢神经系统fos蛋白的表达与外周伤害性刺激[J].神经解剖学杂志,1996,12(3):281-283.
[6] 方剑乔.环氧合酶-2在炎症疼痛中的表达及电针干预的可能性[J].浙江中医学院学报,2002,26(2):51.

