司帕沙星滴耳液的制备及质量控制
温 坚,林三清,夏敬民
(1.广东省湛江中心人民医院,广东 湛江 524037; 2.湛江师范学院制药工程系,广东 湛江 524048)
司帕沙星为第4代氟喹诺酮类抗菌药物,在体外具有广谱抗菌活性,具有抗菌活性强、渗透性强、半衰期长、疗效确切、不良反应轻微等优点,对耳鼻喉感染治疗效果较好[1]。耳部感染性疾病如化脓性中耳炎、外耳道炎、鼓膜炎是临床常见病,常以局部用药治疗。2005年版《中国药典(二部)》收载司帕沙星有原料药、片剂和胶囊剂[2],文献有司帕沙星滴眼剂的报道[3],但笔者未见有司帕沙星滴耳液的报道。根据临床治疗需要,笔者制成0.3%司帕沙星滴耳液,用于治疗中耳炎和外耳道炎等疾病,现将其制备及质量控制方法报道如下。
1 仪器与试药
UV-2450型紫外分光光度计(日本岛津);AY-120型分析天平(日本shimadzu公司);pHS-25C型数字酸度计(上海鹏顺科学仪器有限公司)。司帕沙星对照品(中国药品生物制品检定所,批号为130461-200501,含量为99.8%);司帕沙星原料药(湖北健源化工有限公司,批号为090804,含量为99.82%);甘油(湖南尔康制药有限公司,批号为20090130,规格为500 g);乙醇、冰醋酸和醋酸钠(均来自广州化学试剂厂,规格均为500 mL,批号分别为20080703-2、20080904-2、20080504-2);试剂均为分析纯。
2 方法与结果
2.1 处方与制备
处方:司帕沙星3.0 g,甘油300mL,95%乙醇400mL,纯化水加至1 000mL。
制备:称取司帕沙星3.0 g,加入约80℃200mL纯化水中,滴加乳酸并搅拌,使司帕沙星恰至溶解,加入95%乙醇400mL,搅拌过滤,加甘油300mL,搅匀,用1mol/L氢氧化钠调pH为5左右,加纯化水至1 000mL,搅匀,即得。
2.2 一般质量控制
性状:本品为淡黄色微黏稠澄明液体。
鉴别:取本品适量,用pH为4.5的醋酸-醋酸钠缓冲液稀释成1 mL含司帕沙星约6μg的溶液,照紫外分光光度法测定,于298 nm波长处有最大吸收。本品显有机氟化物的鉴别反应[3]。
检查:本品pH为4.5~5.5。其他应符合2005年版《中国药典(二部)》附录耳用制剂项下相关规定[2]。
2.3 含量测定
2.3.1 溶液制备
取醋酸钠18 g,加冰醋酸9.8mL,再加纯化水稀释至1 000mL,搅匀,得pH为4.5的醋酸-醋酸钠缓冲液(溶剂A);精密称取司帕沙星对照品50mg,置250mL量瓶中,用溶剂A溶解并稀释至刻度,摇匀,得对照品溶液。精密吸取0.3%司帕沙星滴耳液5mL,置200mL量瓶中,用溶剂A稀释至刻度,摇匀,精密吸取稀释液5mL,置50mL量瓶中,用溶剂A稀释至刻度,摇匀得样品溶液;除司帕沙星外,按处方比例取乙醇、甘油,滴加乳酸和1mol/L氢氧化钠液,照样品溶液的制备方法,制备阴性样品溶液。
2.3.2 测定波长选择
取对照品贮备液,用溶剂A稀释,制成1mL约含司帕沙星8μg的溶液,照紫外分光光度法,以溶剂A为空白,在200~400 nm波长范围内扫描。另外,取阴性样品溶液,同法进行扫描,记录两种溶液的吸光光谱。结果表明,司帕沙星在298 nm波长处有最大吸收,而阴性样品溶液在298nm波长处无吸收,证明辅料对本法测定无干扰(见图1),故选定298 nm波长为司帕沙星含量测定波长。
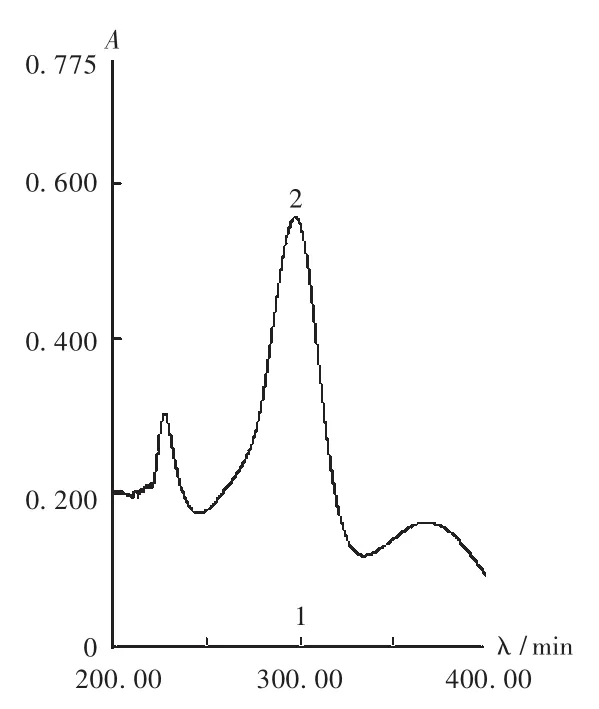
图1 司帕沙星紫外分光光谱图
2.3.3 方法学考察
标准曲线绘制:精密吸取司帕沙星对照品贮备液1.0,2.0,3.0,4.0,5.0 mL,分别置100 mL量瓶中,用溶剂A溶解至刻度,摇匀,制成含司帕沙星2.0,4.0,6.0,8.0,10.0μg/mL的系列溶液,以溶剂A为空白,照紫外分光光度法测定吸光度,将吸光度(A)对质量浓度(C)进行线性回归,得回归方程A=0.075 25C+0.004,r=0.999 9(n=5)。结果表明,司帕沙星质量浓度在2~10μg/mL范围内与吸光度线性关系良好。
稳定性试验:精密吸取样品溶液3mL,置100mL量瓶中,用溶剂A稀释至刻度,摇匀,于0,1,2,4,6,8h时测定吸光度,计算含量。结果的 RSD为0.78%(n=6),表明样品溶液在8h内稳定。
精密度试验:精密吸取司帕沙星对照品贮备液4mL,置100mL量瓶中,用溶剂A稀释至刻度,摇匀,测定吸光度。结果的 RSD为0.57%(n=5)。
加样回收试验:精密称取司帕沙星对照品适量,按处方比例制备司帕沙星滴耳液,按样品溶液的制备方法制成低、中、高不同质量浓度的溶液,按标准曲线绘制项下方法测定,由回归方程计算司帕沙星的含量,并计算回收率。结果见表1。
2.3.4 样品含量测定
取3批样品,依法制备样品溶液,按标准曲线绘制项下方法测定样品吸光度,由回归方程计算含量。结果批号分别为090917-1,090917-2,090918的样品中司帕沙星含量分别为标示量的98.3%,97.2%,101.2%。故本品含司帕沙星应为标示量的90.0%~110.0%。
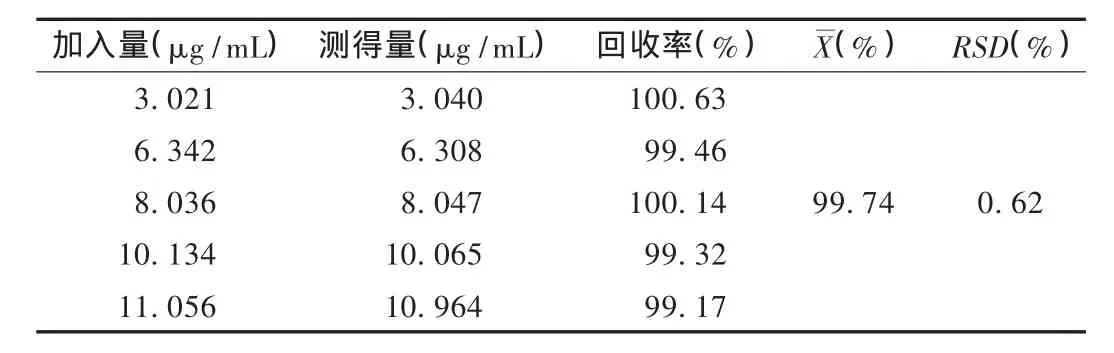
表1 司帕沙星加样回收试验结果(n=5)
2.4 样品稳定性考察
将本制剂在室温下避光放置3个月,每半个月观察其外观,测定pH及含量。结果外观、pH及含量均无显著变化。
3 讨论
本滴耳液处方中加入乙醇,可以保持一定的抑菌作用和增加药物的穿透作用,乙醇体积分数约为38%,从而避免了因乙醇体积分数过高而对耳道的刺激性[4];甘油可延长药物在病灶滞留时间。紫外分光光度法用于测定本品主药的含量,方法简便可靠,可用于本制剂的质量控制。司帕沙星遇光不稳定,故本制剂应在室温下避光保存。
[1]苗 佳,梁德荣.新氟喹诺酮类抗菌药司帕沙星[J].华西医学,1999,14(4):501-504.
[2]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:161-163,附录16,附录20.
[3]李德耀,王著宇,李冬生,等.司帕沙星滴眼剂的制备及质量控制[J].中国药业,2002,11(7):61-62.
[4]冯世栋.对氧氟沙星滴耳液处方内乙醇浓度的商榷[J].中国医院药学杂志,1997,17(8):370.