Beta-微管蛋白ⅢASODN对Ec9706/P-1细胞凋亡的影响
卢 红
(河南大学淮河医院肿瘤科,河南 开封 475000)
Beta-微管蛋白ⅢASODN对Ec9706/P-1细胞凋亡的影响
卢 红
(河南大学淮河医院肿瘤科,河南 开封 475000)
目的:观察β-微管蛋白Ⅲ(β-TubulinⅢ,T UBB3)反义寡核苷酸(Antisense oligonucleotide,ASODN)对Ec9706/P-1细胞凋亡的影响。方法:以体外诱导的人食管癌紫杉醇耐药细胞株Ec9706/P-1为模型,设ASODN组和无关序列寡核苷酸(Nonsense oligonucleotide,NSODN)组,应用免疫细胞化学方法检测 NF-κ Bppabp65、Bcl-2和Caspase-3蛋白的表达;采用逆转录-多聚酶链反应(RT-PCR)检测NF-κ Bppabp65、bcl-2和 caspase-3mRNA的表达;采用DNA凝胶电泳和吖啶橙荧光染色法检测细胞凋亡变化。结果:免疫细胞化学方法显示ASODN组NF-κ Bppabp65蛋白表达率与NSODN组比较差异无统计学意义(P>0.05),ASODN组Bcl-2蛋白表达率与NSODN组比较差异有统计学意义(P<0.05),ASODN组Caspase-3蛋白表达率与NSODN组比较,差异有统计学意义(P<0.05);RT-PCR法显示 ASODN组caspase-3 mRNA条带亮度强于NSODN组,bcl-2 mRNA条带亮度低于NSODN组,ASODN组NF-κ Bppab mRNA条带亮度与NSODN组相近;DNA凝胶电泳显示紫杉醇作用后ASODN组有凋亡特征的DNA改变,而NSODN组细胞却未出现;吖啶橙荧光染色法表明ASODN组凋亡率与NSODN组比较,差异有统计学意义(P<0.05)。结论:T UBB3反义寡核苷酸增加了紫杉醇对Ec9706/P-1细胞的诱导凋亡能力,证明了Bcl-2和Caspase-3的表达变化很可能是产生紫杉醇耐药的主要机制之一。
β-微管蛋白Ⅲ;食管癌;耐药;凋亡
食管癌在我国发病率较高,尤以河南省林州市为高发区之一,严重威胁着人民的生命健康。食管癌预后较差,紫杉醇是化疗有效药物之一,但其产生的获得性耐药使得许多患者失去了治疗机会。我们已成功建立食管癌紫杉醇耐药细胞株Ec9706/P-1,并对其耐药性进行了鉴定[1],发现β-微管蛋白Ⅲ(β-TubulinⅢ,T UBB3)的高表达可能是其产生获得性耐药的主要原因之一[2]。为进一步探讨其他可能机制,我们拟采用β-微管蛋白Ⅲ反义寡核苷酸(Antisense oligonucleotide,ASODN)脂质体转染技术,观察Ec9706/P-1细胞凋亡及其相关蛋白的变化。
1 材料与方法
1.1 细胞及培养
人食管鳞癌细胞株EC 9706由中国医学科学院肿瘤研究所分子肿瘤学国家重点实验室惠赠,Ec9706/P-1由作者建立并保存[1],均培养于含体积分数为15%FCS胎牛血清、100 U/L青霉素和100 g/L链霉素的RPMI 1640培养基中,置于37℃、体积分数为5%CO2培养箱中培养。
1.2 药物及试剂
紫杉醇(Paclitaxel)购于四川太极制药厂;脂质体转染试剂(Lipofectamin2000)购于 Invitrogen公司;SP-9000免疫组化试剂盒购于北京中杉金桥生物技术有限公司;细胞凋亡-DNALadder抽提试剂盒(离心柱式)购于碧云天生物技术研究所;One-step RT-PCR试剂盒购于北京赛百盛公司;Caspase-3兔抗人多克隆抗体购于北京博奥森生物技术有限公司;NFkappab-p65兔抗人多克隆抗体购于武汉博士得生物工程有限公司;Bcl-2鼠抗人多克隆抗体购于北京中杉金桥生物技术有限公司。
1.3 寡核苷酸(Oligonucleotide,ODN)序列及合成
T UBB3 ASODN参照文献[3]的方法,由北京赛百盛公司合成,全程硫代修饰,序列为:5′-ACGTGGGCGACTCGG-3′,并设计与其碱基组成相同,但碱基顺序随机排列的无义寡核昔酸序列(nonsense oligodeoxynucleotides,NSODN)作为对照,由北京赛百盛公司合成,全程硫代修饰,其序列为:5′-GGCGACGTGCGTCGA-3′。在Genbank中行证实ASODN仅与T UBB3基因相应位点匹配,NSODN与任何已知哺乳动物基因无匹配。
1.4 细胞分组及预处理
分为ASODN组和NSODN组:取对数生长期细胞,细胞贴壁至50%~60%,体积分数为0.25%胰蛋白酶消化,反复吹打后收集细胞,PBS液洗涤1次,于37℃、体积分数为5%CO2培养箱中过夜,弃去细胞培养液,并用无血清无双抗的 RPMI1640培养液洗涤细胞 1次,将形成 ASODN-LF2000和NSODNLF2000的浓度为1.0 μmol/L的复合物加入相应细胞中,轻轻混匀,37℃、体积分数为5%CO2培养箱培养6 h,弃去转染液,加入完全1640培养液,继续培养20 h,各组细胞以紫杉醇终浓度1.0mg/L作用8 h,开始实验。
1.5 免疫细胞化学方法检测Ec9706/P-1细胞Bcl-2蛋白、Caspase-3蛋白和NF-κ Bppabp65蛋白的表达
细胞常规胰酶消化,接种于经预处理的盖玻片上,待其长满后用-20℃体积分数为4%多聚甲醛固定5min,按照说明书进行免疫细胞化学染色。光镜每高倍视野下(×400)随机观察100个细胞,以细胞浆内出现棕黄色颗粒为阳性细胞,计算细胞阳性率。实验重复3次,计算各次阳性率的均值。
1.6 半定量 RT-PCR法检测NF-κ Bppab mRNA、caspase-3 mRNA和bcl-2 mRNA的表达
bcl-2引物采用Primer Premier5软件设计,caspase-3引物参照文亚渊等[4]设计,NF-κ Bppab引物参照董为红等[5]设计,由北京赛百盛公司合成,-20℃保存备用。各引物序列为:β-actin:上游 5′-CATCCTGCGTCTGACCT-3′,下游 5′-TCAGGAGGAGCAATGATCT TG-3′(长度:480bp);caspase-3:上游 5′-ATGGACAACAACGAAACCTCCGTG-3′,下游 5′-CCACTCCCAGTCATTCCTTTAGTG-3′(长度:857bp);bcl-2:上游 5′-AGACAGCCAGGAGAAATCAAACAG-3′,下游 5′-TCCACCTGACGCCCT TCAC-3′(长度 :293bp);NF-κ Bppab:上游 5′-TCATCTTCCCGGCAGAGCCAG-3′,下游:5′-GTGGGTCTTGGTGGTATCTGT-3′(长度:136bp)。收集各组细胞,分别抽提总RNA,参照一步法RT-PCR试剂盒说明书进行RT-PCR扩增。扩增条件:第一条cDNA链合成,45℃,30min;预变性,94℃预变性2min,然后94℃变性30 s,bcl-2退火温度55℃下退火30 s,caspase-357.5 ℃退火30 s,NF-κ Bppab 52℃退火60 s;72℃延伸1min。上述3步骤进行30个循环后,再72℃继续延伸5min,置4℃保存。
1.7 DNA凝胶电泳检测细胞凋亡
按照说明书进行操作,取部分抽提得到DNA,10 g/L琼脂糖凝胶电泳分析。阳性结果判定:细胞DNA凝胶电泳后在紫外灯下出现阶梯状(Ladder)条带。
1.8 吖啶橙荧光染色法检测细胞凋亡变化
收集细胞,制成单细胞悬液1×104/mL,PBS洗2遍。吸取95 μ L细胞悬液滴于洁净玻片上,5 μ L吖啶橙混匀,盖玻片封闭,立即置于荧光显微镜下观察拍照。荧光显微镜每高倍视野下(×400)随机观察100个细胞,以细胞核或细胞质内可见致密浓染的黄绿色染色,甚至可见黄绿色碎片为阳性细胞,计算细胞阳性率。实验重复3次,计算凋亡率,凋亡率=凋亡细胞数/100×100%。
1.9 统计学处理
实验数据用SPSS 11.0进行统计学处理。计数资料采用χ2检验;计量资料采用成组设计资料两样本均数比较的 t检验,以表示。以 α=0.05作为显著性检验水准。
2 结果
2.1 免疫细胞化学方法检测Ec9706/P-1细胞Bcl-2蛋白、Caspase-3蛋白和NF-κ Bppabp65蛋白的表达
Bcl-2 蛋白、Caspase-3 蛋白和 NF-κ Bppabp65 蛋白在Ec9706/P-1细胞中表达于细胞浆,呈棕黄色颗粒,见图 1、2、3。ASODN 组 NF-κ Bppabp65 蛋白表达率为(66.72±4.43)%,NSODN组 NF-κ Bppabp65蛋白表达率为(68.20±5.73)%,二者比较差异无统计学意义(t=0.354,P>0.05);ASODN组Bcl-2蛋白表达率为(32.52±5.57)%,NSODN组Bcl-2蛋白表达率为(48.27±6.31)%,二者比较差异有统计学意义(t=3.241,P<0.05);ASODN组Caspase-3蛋白表达率为(61.23±9.64)%,NSODN组Caspase-3蛋白表达率为(40.01±7.67)%,二者比较差异有统计学意义(t=2.984,P<0.05)。
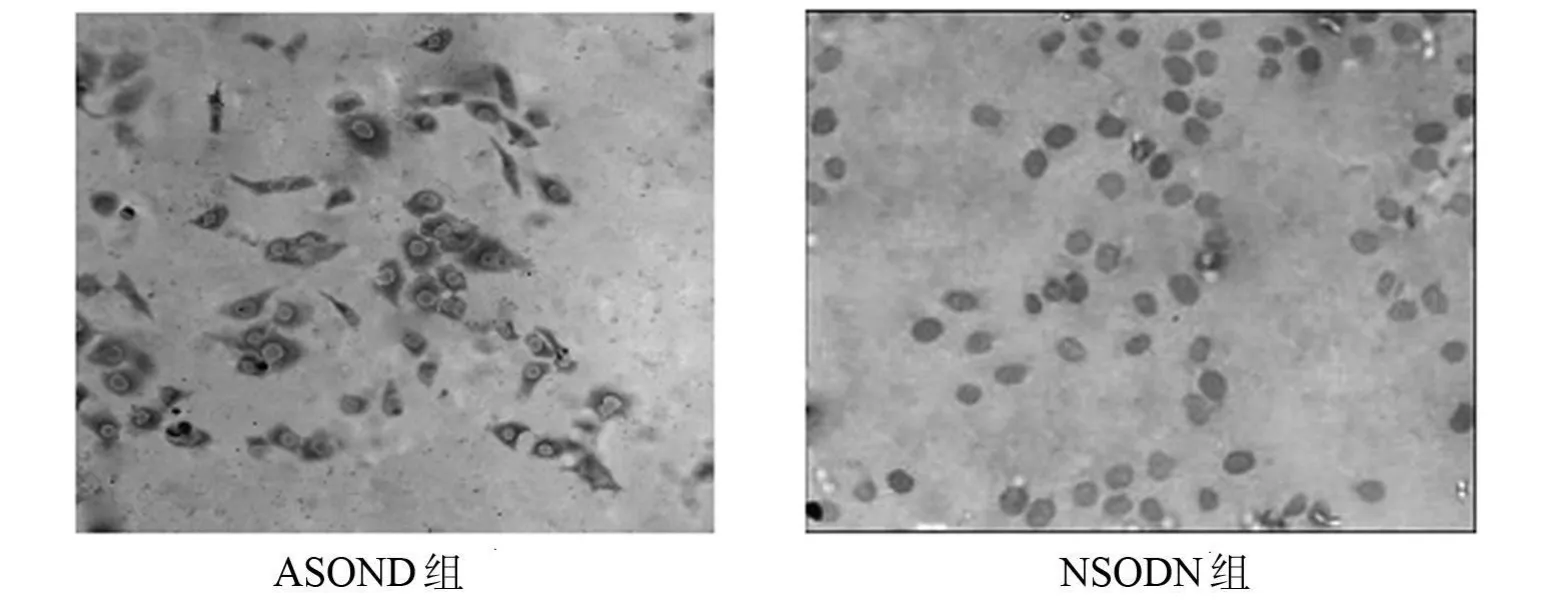
图1 Ec9706/P-1细胞Caspase-3蛋白的表达(SP×200)
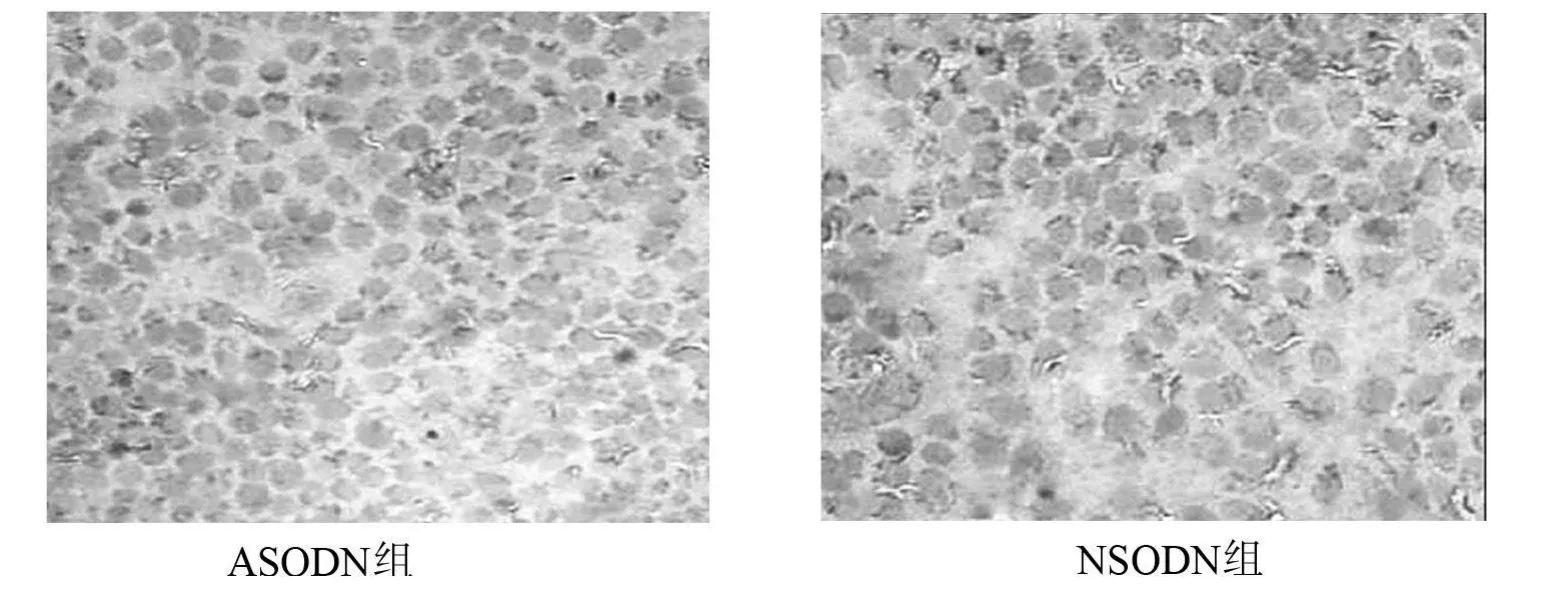
图2 Ec9706/P-1细胞NF-κ Bppabp65蛋白的表达(SP×200)
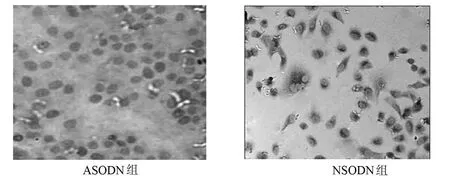
图3 Ec9706/P-1细胞Bcl-2蛋白的表达(SP×200)
2.2 半定量RT-PCR法检测caspase-3 mRNA、bcl-2 mRNA 和NF-κ Bppab mRNA 的表达
ASODN组caspase-3 mRNA条带亮度强于NSODN组,而bcl-2 mRNA条带亮度低于NSODN组,ASODN 组 NF-κ Bppab mRNA 条带亮度与NSODN组相近,见图4;ASODN组caspase-3 mRNA相对表达量为0.77±0.13,NSODN组caspase-3 mRNA相对表达量为0.47±0.11,二者比较差异有统计学意义(t=3.332,P<0.05);ASODN组bcl-2 mRNA相对表达量为0.40±0.09,NSODN组bcl-2 mRNA相对表达量为0.72±0.10,二者比较差异有统计学意义(t=4.12,P<0.05);ASODN组 NF-κ Bppab mRNA相对表达量为0.67±0.15,NSODN组NF-κ Bppab mRNA 相对表达量为0.70±0.18,二者比较差异无统计学意义(t=0.547,P>0.05)。
2.3 DNA凝胶电泳检测细胞凋亡
紫杉醇作用后ASODN组有凋亡特征的DNA改变,即形成典型的 DNA降解“梯状”条带片段(DNA Ladder),而NSODN组细胞却未出现,见图5。

图4 RT-PCR法检测Ec9706/P-1细胞凋亡相关基因的表达

图5 Ec9706/P-1细胞凋亡DNA ladder
2.4 吖啶橙荧光染色法检测细胞凋亡
紫杉醇作用后ASODN组细胞核或细胞质内可见致密浓染的黄绿色染色,甚至可见黄绿色碎片,凋亡率为(0.69±0.15)%,而NSODN组细胞大部分细胞核DNA为黄色或黄绿色均匀荧光,细胞质和核仁RNA为桔黄色或桔红色荧光,见图 6,凋亡率为(0.08±0.02)%,二者比较差异有统计学意义(t=6.982,P<0.05)。

图6 Ec9706/P-1细胞凋亡形态(AO×400)
3 讨论
本研究表明:转染 TUBB3 ASODN后,在紫杉醇的诱导下,呈现出不同的凋亡现象。有报道证明,微管蛋白数量的减少降低了微管蛋白的聚合能力,这是因为微管蛋白的浓度是微管聚合的必要条件[6]。有文献[7]显示,当微管蛋白减少60%~70%时,细胞的生存严重受到了威胁。
ASODN组吖啶橙染色后,在荧光显微镜下可见细胞核或细胞质致密浓染的黄绿色染色,甚至可见黄绿色碎片荧光,凋亡特征的DNA改变,而其余各组变化不明显,这说明随着T UBB3的减少,细胞发生的凋亡就越明显。由此推断出凋亡途径可能发生了改变。本研究发现ASODN组抗凋亡因子Bcl-2在蛋白水平和RNA水平表达降低,NFkB表达变化不明显,而促凋亡因子Caspase-3表达升高。
微管蛋白通过秋水仙碱、长春碱、埃坡霉素、紫杉醇等调节与细胞周期和凋亡有关的基因和蛋白激酶的表达[8-9],诸如Bcl-2,Cdc25c,蛋白激酶A,c-Jun和NFκ B[10-11]。作者认为,有几种机制存在:①TUBB3转染后,微管蛋白系统恢复了原有的结构,也就暴露出了紫杉醇的结合位点,紫杉醇得以作用于细胞的有丝分裂期M期,使部分细胞阻滞于G2-M期,中断了细胞周期,通过各种信号途径(包括死亡信号),Bcl-2癌蛋白磷酸化从而使 Bcl-2蛋白失活,诱导凋亡[12-13],同时,由于 Bcl-2蛋白失活导致最终的Caspase-3活化上调,共同完成了凋亡途径。所以,尽管抗微管药物所诱导的凋亡机制还不十分明了,但是Bcl-2家族在凋亡途径中占有重要地位[14-16]。②普遍认为抗有丝分裂药物诱导凋亡的主要机制之一是:有丝分裂受到干扰,导致 Bcl-2的磷酸化,使Bax、Bak、Bid以及其他Bcl-2家族成员中的促凋亡因子得到释放,从而导致凋亡。然而有人[17-18]认为有丝分裂的阻滞并不是抗有丝分裂药物诱导细胞凋亡的主要因素。研究[19]发现,在缺乏细胞质的情况下,微管独立于线粒体与秋水仙碱和紫杉醇的药物结合的位点而存在这一事实说明,在线粒体膜内外直接作用于微管蛋白可能是干扰微管蛋白功能的又一特点。微管蛋白二聚体的结构改变或其内部由于结合导致的Bcl-2配体的变化可能调节了Bcl-2及其家族成员和其他凋亡相关蛋白的功能。有研究[20]显示紫杉醇在治疗上皮性肿瘤时,可以改变Bax/Bcl-2的比例。因此,可以理解为,TUBB3反义寡核苷酸转染Ec9706/P-1细胞后,紫杉醇得以与细胞的微管位点结合,从而改变了后者的Bcl-2配体的结构,使得与之结合更紧密,而促凋亡因子得以释放,从而显现出明显的凋亡现象。以上两点提示 TUBB3反义寡核苷酸并不是直接改变了Bcl-2和Caspase-3的表达,但是可能间接通过紫杉醇的作用影响了二者的表达和活性,从而了启动了凋亡效应,出现了明显的凋亡现象。③NF-κ B在凋亡中的作用不容忽视,然而关于NF-κ B在凋亡中的作用却有不同报道。有研究[21]称紫杉醇及其他抗微管药物通过激活NF-κ B/Iκ B信号转导通路是使细胞凋亡的机制之一。④体外实验表明在化疗药物5-氟脲嘧啶(5-FU)、阿霉素、紫杉醇和顺铂的作用下,NFkB被激活上调[22]从而削弱化疗药物诱导细胞凋亡的能力[23]。已有结果[23-24]显示,NFkB能够抑制细胞对紫杉醇和顺铂的敏感性。而本研究中发现,转染后NF-kB表达水平无明显变化。可能由于紫杉醇得以与细胞的微管蛋白结合,紫杉醇作用后,尽管不影响NF-kB的表达,但是下调Iκ Bα,反过来启动NF-κ B的核定位,激活了凋亡信号转导通路,转染起了间接作用使得NF-kB诱导凋亡。但是这仍需进一步的研究证实。
由此可见,TUBB3反义寡核苷酸增加了紫杉醇对Ec9706/P-1细胞的诱导凋亡能力,凋亡相关蛋白Bcl-2和 Caspase-3表达分别降低和升高,而 NF-κ Bp65没有变化。提示T UBB3可能间接影响了Bcl-2和Caspase-3的表达和活性。食管癌对紫杉醇产生耐药的机制及其复杂,我们发现转染 TUBB3 ASODN后,凋亡相关蛋白及凋亡现象出现了不同的变化,这就启发我们思考在凋亡信号转导过程中,一些相关信号转导因子是否发生了变化,发生了哪些变化,我们将进行更深一步的研究。
[1]卢红,樊青霞,王瑞林,等.耐紫杉醇食管鳞癌 Ec9706/P-1的建立及特征[J].中国肿瘤临床,2007,34(13):731-734.
[2]卢红,樊青霞,王留兴.Ec9706/P-1细胞多药耐药基因、多药耐药相关蛋白基因1及β-微管蛋白Ⅲ基因mRNA的表达[J].郑州大学学报:医学版,2009,44(2):236-238.
[3]Kavallaris M,Burkhart CA,Horwitz SB,et al.Antisense oligonucleotides to class III β-tubulin sensitize drug-resistant cells to Taxol[J].British Journal of Cancer,1999,80(7):1020-1025.
[4]文亚渊,刘宝华,付涛.胃癌组织中surviin,caspase-3和caspase-9基因表达的变化[J].第三军医大学学报,2005,27(21):2194-2195.
[5] 董卫红,颉彦华,汪洪波,等.抗凋亡基因 NF-κ B 和 Survivin对卵巢癌细胞株耐药性的诊断价值[J].实用妇产科杂志,2005,21(12):728-730.
[6]Caudron N,Valiron O,Usson Y,et al.A reassessment of the factors affecting microtubule assembly and disassembly in vitro[J].Jmol Biol,2000,297(1):211-220.
[7]Barlow SB,Gonzalez-GaraymL,Cabral F.Paclitaxel-dependent mutants have severely reduced microtubule assembly and reduced tubulin synthesis[J].J Cell Sci,2002,115(pt17):3469-3478.
[8]Wang LG,Liu XM,Kreis W,et al.The effect of antimicrotubule agents on signal transduction pathways of apoptosis:a review[J].Cancer Chemother Pharmacol,1999,44(5):355-361.
[9]Bhalla KN.Microtubule-targeted anticancer agents and apoptosis[J].Oncogene,2003,22(56):9075-9086.
[10]Bourgarel-Rev V,Vallee S,Rimet O,et al.Involvement of nuclear factor-κ B in c-Myc induction by tubulin polymerization inhibitors[J].Mol Pharmacol,2001,59(5):1165-1170.
[11]Bava SV,Puliappadamba VT,Deepti A,et al.Sensitization of taxol-induced apoptosis bycurcumin involves down-regulation of nuclear factor-κ B and the serine/threonine kinase Akt and is independent of tubulin polymerization[J].J Biol Chem,2005,280(8):6301-6308.
[12]Basu A,Dubois G,Haldar S.Posttranslational modifications of Bcl2 family members-a potential therapeutic target for human malignancy[J].Front Biosci,2006,11:1508-1521.
[13]Haldar S,Basu A,Croce CM.Serine-70 is one of the critical sites for drug-induced Bcl2 phosphorylation in cancer cells[J].Cancer Res,1998,58(8):1609-1615.
[14]Poruchynsky MS,Wang EE,Rudin CM,et al.Bcl-xL is phosphorylated in malignant cells following microtubule disruption[J].Cancer Res,1998,58(15):3331-3338.
[15]Haldar S,Basu A,Croce CM,et al.Bcl2 is the guardian of microtubule integrity[J].Cancer Res,1997,57(2):229-233.
[16]Basu A,Haldar S.Microtubule-damaging drugs triggered bcl2 phosphorylation-requirement of phosphorylation on both serine-70 and serine-87 residues of bcl2 protein[J].Int J Oncol,1998,13(4):659-664.
[17]Lieu CH,Liu CC,Yu T H,et al.Role of mitogen-activated protein kinase in taxol-induced apoptosis in human leukemic U937 cells[J].Cell Growth Differ,1998,9(9):767-776.
[18]Pourrov B,Carre M,Honore S,et al.Low concentrations of vinflunine induce apoptosis in human SK-N-SH neuroblastoma cells through a postmitotic G1 arrest and a mitochondrial pathway[J].Mol Pharmacol,2004,66(3):580-591.
[19]Pasquier E,Carre M,Pourroy B,et al.Antiangiogenic activity of paclitaxel is associated with its cytostatic effect,mediated by the initiation but not completion of amitochondrial apoptotic signaling pathway[J].Mol Cancer T-her,2004,3(10):1301-1310.
[20]Kapahi P,Takahashi T,Natoli G,et al.Inhibition of NF-kappa B activation by arsenite through reaction with a critical cysteine in the activation loop of Ikappa B kinase[J].J Biol Chem,2000,275(46):36062-36066.
[21]Chuang SE,Yeh PY,Lu YS,et al.Basal levels and patterns of anticancer drug-induced activation of nuclear factor-kappaB(NF-kappaB),and its attenuation by tamoxifen,dexamethasone,and curcumin in carcinoma cells[J].Biochem Pharmacol,2002,63(9):1709-1716.
[22]Baldwin AS.Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB[J].J Clin Invest,2001,107(3):241-246.
[23]Huang Y,Fan W.IkappaB kinase activation is involvedin regulation of paclitaxel-induced apoptosis in human tumor cell lines[J].Mol Pharmacol,2002,61(1):105-113.
[24]Mabuchi S,Ohmichi M,Nishio Y,et al.Inhibition of inhibitor of nuclear factor-kappaB phosphorylation increases the efficacy of paclitaxel in in vitro and in vivo ovarian cancer models[J].Clin.Cancer Res,2004,10(22):7645-7654.
[责任编辑 姬 荷]
Effect ofβ-tubulin Ⅲ antisense oligonucleotides on Ec9706/P-1 cells apoptosis
LU Hong(Department of Oncology,Huaihe hospital of Henan University,K ai feng,Henan 475000,China)
Objective:To investigate the effect ofβ-tubulin Ⅲ antisense oligonucleotides on Ec9706/P-1 cells apoptosis,study the expression of NF-κ Bppabp65、Bcl-2 and Caspase-3,and to investigate the possible mechanism of acquired resistance of Paclitaxel-resistant human esophageal carcinoma cell line Ec9706/P-1.Methods:There were 2 groups in this study:antisense oligonucleo tides(ASODN)group and oligodeoxynucleotides(NSODN)group.Immunohistochemistry assay was performed to detect the expression of Bcl-2 protein,caspase-3 protein and NF-κ Bppab protein in Ec9706/P-1 cells.The expression level of Bcl-2 mRNA,caspase-3 mRNA and NF-κ BppabmRNA were detected by semi-quantity RT-PCR assay.DNA fragments were resolved by agarose gel electrophoresis to detect cell apoptosis.Apoptosis rates and morphology were detected by arcading orange(AO)staining.Results:The expression rate of Bcl-2 protein in ASODN group was lower than that in NSODN group statistically(P<0.05).The expression rate of caspase-3 protein in ASODN group was higher than that in NSODN group statistically(P <0.05).There was no significant difference in the expression of NF-κ Bppab protein between ASODN group and NSODN group(P>0.05).The expression level of Bcl-2 mRNA in ASODN group was lower than that in NSODN group statistically(P<0.05).The expression level of caspase-3 mRNA in ASODN group decreased significantly compared with that of NSODN group(P<0.05).There was no significant difference in the expression of NF-κ Bppab mRNA between ASODN group and NSODN group(P>0.05).There was obvious apoptosis characteristic DNA ladder in ASODN group induced by Paclitaxel but not in NSODN group.The apoptosis rate in NSODN group was lower significantly than that in ASODN group(P<0.05).Conclusion:TUBB3 ASODN increases the apoptosis of Ec9706/P-1 cells induced by Paclitaxel.It is proved that Bcl-2 and caspase-3 may be one of the main mechanisms of acquired resistance of Paclitaxel-resistant human esophageal carcinoma cell line Ec9706/P-1.
β-TubulinⅢ Esophageal;Carcinoma;Drug-resistance;Apoptosis
R735.1
A
1672-7606(2010)03-0164-06
2010-05-10
卢红(1973-),女,河南 开封 人,博士,主治医师,副教授,从事恶性肿瘤综合治疗的工作。
——水芹主要害虫识别与为害症状

