结肠定位盐酸小檗碱羧甲基魔芋胶小丸体外释药的影响因素
张 瑜,侯世祥
(1.河南大学中药研究所,河南 开封 475004;2.四川大学华西药学院,四川 成都 610041)
结肠定位盐酸小檗碱羧甲基魔芋胶小丸体外释药的影响因素
张 瑜1,侯世祥2*
(1.河南大学中药研究所,河南 开封 475004;2.四川大学华西药学院,四川 成都 610041)
目的:研究影响盐酸小檗碱羧甲基魔芋胶小丸体外释药的因素,评价其释药特性。方法:采用离子胶凝法制备羧甲基魔芋胶小丸,测定小丸在不同释放介质(β-甘露聚糖酶浓度和离子强度)条件下的药物释放、丸粒溶胀和溶蚀情况,并对药物释放和丸粒溶蚀与介质参数进行相关性分析。结果:与在不含酶介质相比,羧甲基魔芋胶小丸在含酶介质中的药物释放和丸粒溶蚀明显加快,随酶浓度增加,药物释放及丸粒溶蚀程度增加,药物释药符合Peppas方程,其中释药指数n大于1;随介质离子强度降低,小丸溶胀程度、药物释放和丸粒溶蚀程度增加。结论:盐酸小檗碱羧甲基魔芋胶小丸体外释药与介质中酶浓度和离子强度有关,释药过程为酶降解溶蚀释放,具有结肠定位释药的可行性。
盐酸小檗碱;羧甲基魔芋胶小丸;酶浓度;离子强度;结肠定位
近年来,炎症性肠道疾病(包括溃疡性结肠炎、克罗恩氏病等)的发病率在我国呈逐年上升趋势。其发病主要位于胃、肠道下段的结肠部位,普通制剂口服给药存在患处药物浓度低影响药效,药物胃、肠道上段吸收易产生副作用等问题。因此,口服结肠定位给药成为此类疾病治疗用新型给药系统的研究热点[1]。
羧甲基魔芋胶(Carboxymethyl konjac glucomannan,简称CMKGM)作为我国优势植物资源魔芋提取物-魔芋胶的氯乙酸醚化改性产物,可用于新型给药系统的研制[2]。我们选择炎症性肠道疾病治疗用中药有效成分(盐酸小檗碱,BH)为模型药物[3],采用离子胶凝法制备羧甲基魔芋胶小丸,测定小丸在不同条件(酶浓度和离子强度)的释放介质中药物释放、丸粒溶胀和溶蚀程度,通过体外释药数据的Peppas方程拟合及各参数间相关性研究,探讨影响盐酸小檗碱羧甲基魔芋胶小丸体外释药的因素,评价其释药特性。
1 仪器与试药
UV-2201紫外可见光分光光度计(日本岛津);恒温振荡水浴(江苏太仓鹿河生化仪器厂);Startorious 1721型电子天平(西德);CMKGM(自制,醚化度为0.479(酸化法测定));BH(四川亚宝光泰制药有限公司);BH对照品(中国药品生物制品检定所);β-甘露聚糖酶(上海市宝丰生化有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 CMKGM小丸的制备
将BH加至质量浓度为20 g/LCMKGM水溶液(BH与CMKGM质量配比为2∶1)中,搅拌得均匀混悬液,将上述混悬液滴加至10倍体积量的凝胶液(质量浓度为5 g/L的三氯化铁和质量浓度为2.5 g/L的壳聚糖混合液,pH3.0)中,胶凝化处理8 h,过滤收集小丸,用水冲洗丸粒表面,37℃干燥,再置于50℃烘箱中热处理10 h;将以上制得小丸在质量浓度为30 g/L氯化钙溶液中搅拌10min,取出吸干丸粒表面溶液,置于质量浓度为6 g/L海藻酸钠溶液中,包衣10min,过滤收集小丸,用水冲洗除去丸粒表面未凝胶化的海藻酸钠,37℃干燥,制得载药小丸。同法制备得到不含BH的空白小丸。
2.2 小丸的体外释放度,溶胀和溶蚀测定
2.2.1 释放度测定 称取载药小丸,置于含100mL释放介质的锥形瓶中,在(37±0.5)℃恒温振荡水浴(振荡频率为50次/min)中进行体外释放试验,于规定时间取样5mL(同时补加同体积相应的新鲜介质),采用紫外分光光度法测定BH量[4],计算药物释放百分数。
2.2.2 溶蚀度测定 称取空白小丸(W初始),按“2.
2.1释放度测定”项下操作,于规定时间将小丸取出,置烘箱中烘干后称重(W烘干),按下式计算小丸溶蚀度。
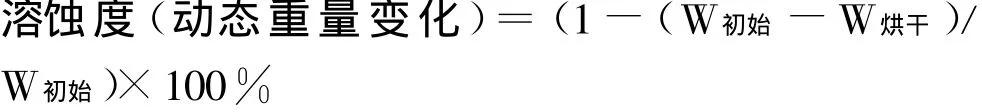
2.2.3 溶胀度测定 称取空白小丸(W初始),按“2.2.1释放度测定”项下操作,于规定时间将小丸取出,吸干表面水分后称重(W溶胀),然后置烘箱中烘干后再称重(W烘干),按下式计算小丸溶胀度。
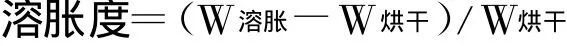
2.3 介质离子强度对酶活性影响
取5mL用不同离子强度pH6.8磷酸盐缓冲液(分别添加质量浓度为2,4,6和8 g/L氯化钠)配制的质量浓度为5 g/LCMKGM 溶液,加入0.1 g/Lβ-甘露聚糖酶液0.1mL,立即置于40℃水浴中并计时,30min后取出,沸水中煮沸5min灭活酶,取出冷却至室温。同时另用加灭活酶液平行操作为对照,采用DNS法测定酶解产生的还原糖量[5],结果见图1。
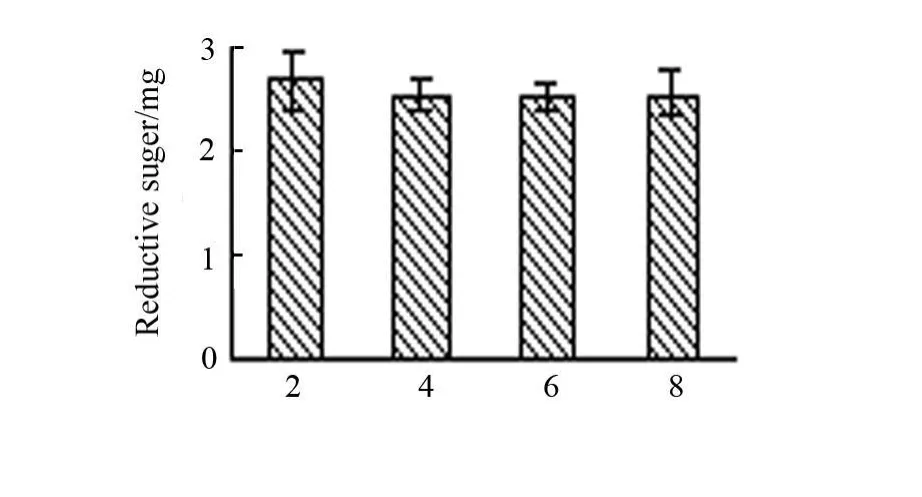
图1 介质离子强度对酶降解活性的影响(n=3)
由图1发现,在不同离子强度介质中,酶降解生成的还原糖量无差异(P>0.05),由此可见,在所考察的介质离子强度条件下,β-甘露聚糖酶的活性无明显变化。
2.4 介质条件对小丸释药的影响
2.4.1 酶浓度 按“2.2小丸的体外释放度,溶胀和溶蚀测定”项下,采用变换介质(开始2 h为0.1mol/L盐酸液(模拟胃部环境),后3 h为pH6.8磷酸盐缓冲液(模拟小肠环境),最后为含不同浓度(分别为0,0.05,0.1,0.2和0.3 g/L)β-甘露聚糖酶的pH6.8磷酸盐缓冲液(模拟结肠环境))操作,结果见图2。
由图2中药物释放和溶蚀曲线发现,在模拟胃、小肠环境介质中,小丸的丸粒溶蚀程度较低,药物释放量少,5 h累积释放百分数在20%以下;在模拟结肠环境的介质中,酶的存在可明显加快丸粒的溶蚀和药物释放,14 h药物释放达90%以上。
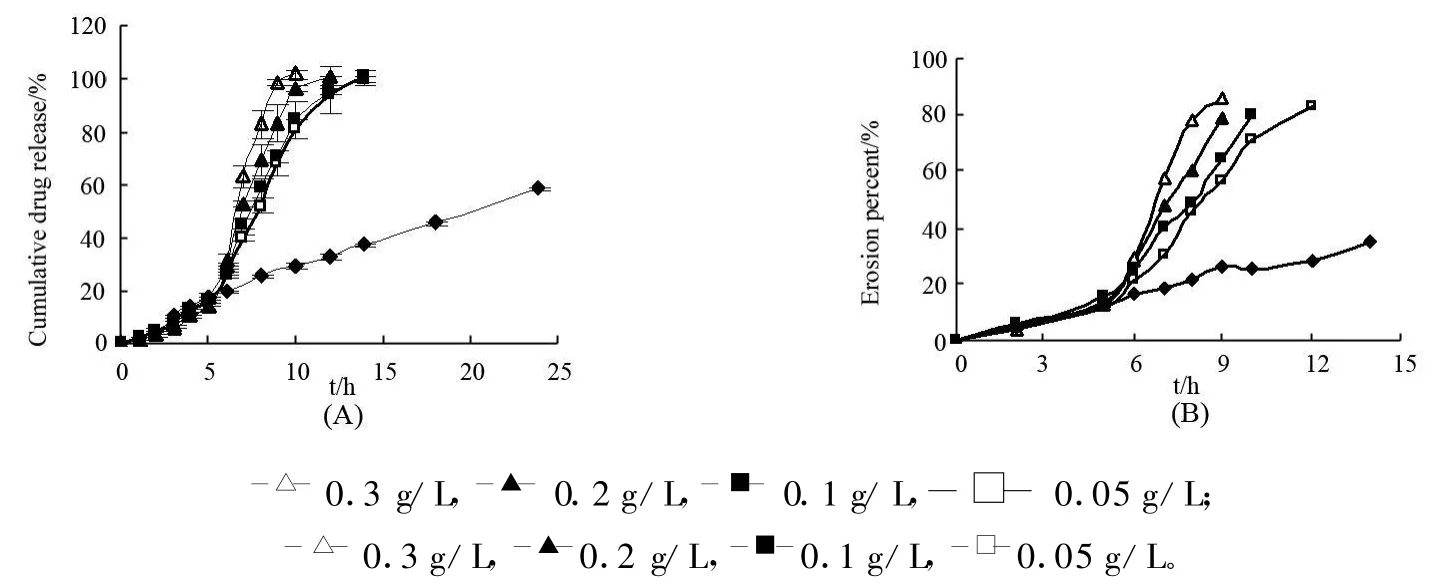
图2 介质酶浓度对CMKGM小丸的药物释放(A,,n=3)和丸粒溶蚀(B)影响
将小丸在各介质中的溶蚀量(%)对溶蚀时间(h)进行零级方程拟合,得丸粒溶蚀速度(单位为%/h)。对不同酶浓度条件下的丸粒溶蚀速度(Y,%/h)与酶浓度(X,g/L)进行线性回归(Y=31.49×X+9.645,R2=0.9799),发现小丸的溶蚀速度与介质中酶浓度呈正相关,随酶浓度增加,小丸溶蚀加快。
将小丸在含酶介质中的药物释放数据进行Peppas方程拟合,结果见表1。
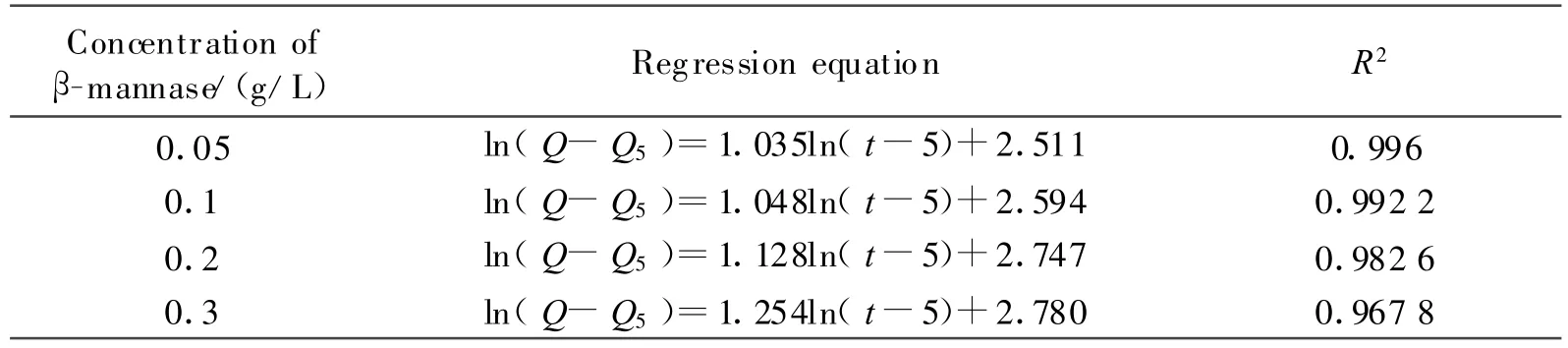
表1 含酶介质中CMKGM小丸释药数据的Peppas方程拟合结果
表1数据显示,在含不同酶浓度的介质中,小丸释药数据按Peppas方程拟合,其中释药指数n均大于1,由此可见,小丸的释药机制为酶降解溶蚀释放[6]。
2.4.2 离子强度 按“2.2小丸的体外释放度,溶胀和溶蚀测定”项下,采用变换介质(开始2 h为0.1mol/L盐酸液,后3 h为pH6.8磷酸盐缓冲液,最后为不同离子强度的含酶pH6.8磷酸盐缓冲液(β-甘露聚糖酶质量浓度均为0.05 g/L,根据离子强度不同分别添加质量浓度2,4,6,8 g/L氯化钠))操作,结果见图3。
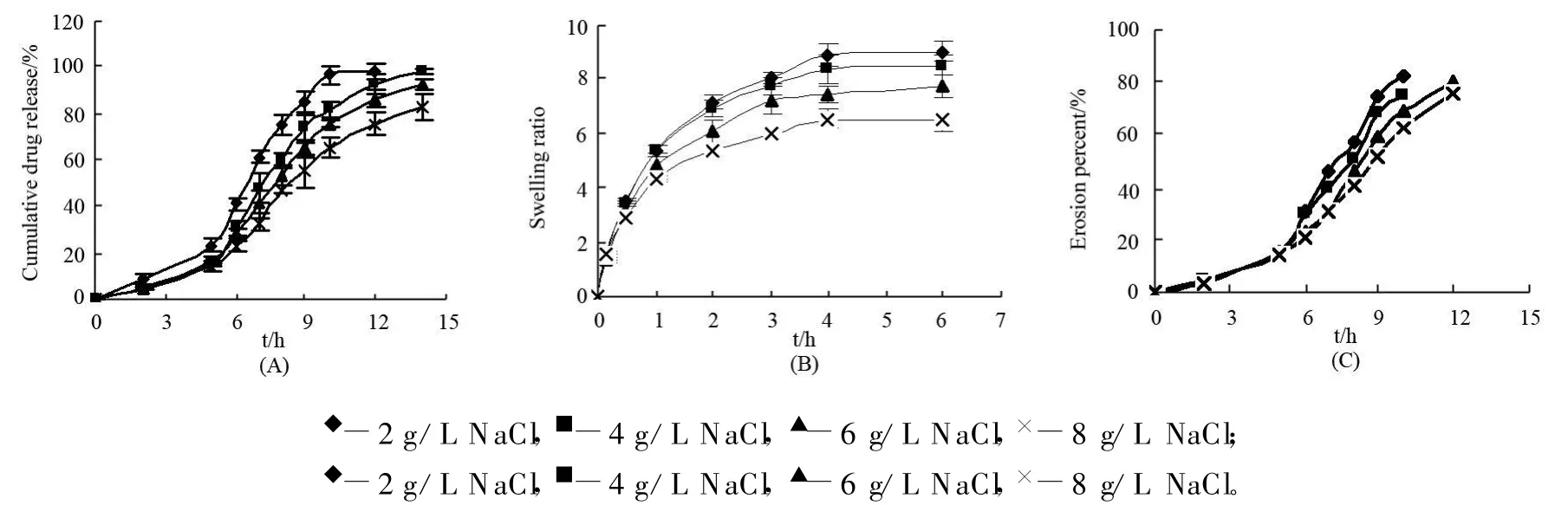
图3 介质离子强度对CMKGM小丸的药物释放(A,,n=3)和丸粒溶胀(B,n=3)及丸粒溶蚀(C)影响
由图3中药物释放,溶胀和溶蚀曲线发现,随介质离子强度(即添加氯化钠量)增加,小丸的药物释放,丸粒溶胀和溶蚀程度均有所降低。
将小丸在各介质中的溶蚀量(%)与溶蚀时间(h)进行零级方程拟合,得丸粒溶蚀速度(单位为%/h),对不同离子强度条件下的丸粒溶蚀速度(Y,%/h)与相应介质中添加的氯化钠浓度(X,g/L)进行线性回归(Y=-0.6771×X+14.61,R2=0.975),发现丸粒溶蚀速度与介质中氯化钠浓度呈负相关,随氯化钠浓度(即介质离子强度)增加,丸粒溶蚀速度减慢。
3 讨论
小丸剂属于单剂量由分散的多个单元组成的剂型。与常用单元剂型如片剂等相比,具有释药规律重现性好,便于制剂后续加工(如填装胶囊)等优点,是目前口服新型给药系统研制的常用剂型之一。本研究中,以具有结肠定位酶降解特性的CMKGM为载体材料,采用离子胶凝法制备盐酸小檗碱羧甲基魔芋胶小丸,凝胶液中加入壳聚糖,可利用带正电荷(氨基)的壳聚糖与带负电荷(羧基)的CMKGM形成聚电解质复合物,改善丸粒结构,延缓药物释放。小丸外层包海藻酸钙衣膜可提高丸粒骨架在胃部酸性环境中的稳定性,减少其在胃、肠道上段的药物释放。同时此衣膜在肠道介质环境中会较快溶蚀脱落,不影响小丸骨架材料的酶降解溶蚀及药物释放,从而改善小丸的结肠定位释药特性[7]。
以多糖为载体材料的口服结肠定位给药系统的释药机理,通常是利用结肠微生物酶对多糖材料的降解造成给药系统崩散而释放药物。此类制剂进行体外释药研究时,为有效模拟体内结肠环境酶降解作用,常用方法包括:采用含鼠盲、结肠内容物的溶液作为释放介质,但存在批次间重现性差,操作不便等问题;从鼠盲、结肠内容物中提取得到含降解酶的溶液作为介质,但操作步骤多;用人体结肠环境特异性存在,并已商品化生产的酶(如β-甘露聚糖酶、果胶酶等)配制一定浓度的含酶溶液作为介质,具有操作简便,重现性好等优点[8]。结合文献报道及前期CMKGM的酶降解性能研究结果,本研究确定采用含β-甘露聚糖酶的溶液作为释放介质,进行小丸的体外药物释放研究[8]。
将小丸在含酶介质中的体外释药数据按Peppas方程拟合,并进行小丸溶蚀速度与介质中酶浓度的相关性研究。结果发现,在含酶介质中,小丸释药数据Peppas拟合方程的释药指数n均在1以上(>0.86),说明小丸的释药过程为丸粒骨架溶蚀释放;与不含酶介质相比,小丸的溶蚀在含酶介质中明显加快,并且溶蚀速度与酶浓度呈正相关,说明介质中酶的存在是影响丸粒骨架溶蚀的主要因素;另外研究发现β-甘露聚糖酶可降解小丸骨架材料——CMKGM,由此可见,CMKGM小丸的释药过程为酶降解小丸骨架材料,造成丸粒溶蚀而释放药物[6]。
在不同离子强度的含酶介质中,小丸溶蚀速度与介质中氯化钠浓度呈负相关,这可能与离子强度影响因素有关:①β-甘露聚糖酶降解活力;②酶与小丸骨架材料的接触。针对因素①进行“2.3介质离子强度对酶活性影响”试验。结果发现,在所考察的介质离子强度条件下,酶的活性无明显变化。针对因素②进行了小丸溶胀度试验。结果发现,小丸溶胀程度随介质离子强度增加而降低,而小丸溶胀程度直接关系到酶与丸粒骨架的接触,从而影响酶对骨架材料的降解作用及小丸溶蚀速度。因此,介质离子强度主要通过改变小丸的溶胀程度,从而影响丸粒骨架的酶降解溶蚀及药物释放,与文献报道相一致[9]。由此可见,在含酶介质中,CMKGM小丸的酶降解释药过程,首先要求小丸溶胀形成有效的孔道,才能保证酶与丸粒骨架表面充分接触,并作用于载体材料,造成丸粒降解溶蚀而释放药物。
小丸体外药物释放研究发现,在模拟胃、小肠环境介质中,5 h累积释放百分数在20%以下,在模拟结肠环境的含β-甘露聚糖酶介质中,药物释放明显加快,14 h累积释放达90%以上。由此可见,小丸主要在模拟结肠环境的介质中释放药物,具有酶降解型结肠定位给药系统的释药特性。
4 结论
盐酸小檗碱羧甲基魔芋胶小丸体外药物释放与介质中酶浓度和离子强度有关,随介质中酶浓度增加或离子强度降低,小丸的丸粒溶蚀和药物释放加快。小丸释药过程为酶降解溶蚀释放,具有结肠定位释药的可行性,此结果还有待通过体内试验进一步证实。
[1]Friend D R.New oral delivery systems for treatment of inflammatory bowel disease[J].Advanced Drug Delivery Reviews,2005,57(2):247-265.
[2]Jian D,Sun R,Zhang S H,et al.Novel polyelectrolyte carboxymethyl konjac glucomannan-chitosan nanoparticles for drug delivery[J].Macromol Rapid Commun,2004,25(2):954-958.
[3]Ji G X,Wang B M,Fang W L.The effects of berberine chloride on platelet activation of mice with dextransulphate sodium-induced colitis[J].J Tianjin Med Uni,2004,10(2):182-184.
[4]Liu D W,Li Z H,He J J.Determination of berberine hydrochloride in changyan enema by UV spectrophotometry[J].Guangdong Pharm J,2002,12(4):27-28.
[5]Yuan Z H,Wu D C,Wu H,et al.Studies on ultrasonic wave extracting method determining konjac glucomannan in konjac refined powder[J].China J Chin Mater Med,2003,28(4):324-327.
[6]Peppas N A.A model of dissolution-controlled solute release from porous drug-delivery polymeric systems[J].J Biomed Mater Res,1983,17(3):1079-1084.
[7]Atyabi F,Majzoob S,Iman M,et al.In vitro evaluation and modification of pectinate gel beads containing trimethyl chitosan,as a multi-particulate system for delivery of water-soluble macromolecules to colon[J].Carbohydrate Polymers.2005,61(2):39-51.
[8]Zhang Y,Hou Sh X,Chen G,et al.Study on in vitro release medium of colon-specific drug delivery system prepared with konjac glucomannan to simulate colonic environment[J].Chin Pharm J,2006,41(8):308-311.
[9]Gliko-Kabir I,Yagen B,Baluom M,et al.Phosphated crosslinked guar for colon-specific drug delivery II.In vitro and in vivo evaluation in the rat[J].J.Control.Rel.2000,63(2):129-134.
[责任编辑 李武营]
Influence factors on in vitro release of berberine hydrochloride from carboxymethyl konjac glucomannan pellets
ZHANG Yu1,HOU Shi-Xiang2*(1.Institute of Chinese material midica,Henan University,K aifeng,Henan 475004,China;2.West China School of Pharmacy,Sichuan University,Chengdu,Sichuan 610041,China)
Objective:The factors which influence in vitro release of berberine hydrochloride(BH)from carboxymethyl konjac glucomannan(CMKGM)pellets were studied to elevate drug release characteristics of the CMKGM pellets.Methods:CM KGM pellets were prepared by ionotropic gelation technique.The effects ofβmannase concentration and ionic strengthen of dissolution media on the release of BH,the swelling and erosion properties of the pellets were studied.The correlations between release of BH,erosion properties of the pellets and parameters of the dissolution media were studied.Results:Compared with the dissolution media without enzyme,the release of BH and the erosion of the pellets were increased obviously in the media withβ-mannase.With the increased of β-mannase concentration,the release of BH and the erosion of the pellets increased.The release of BH followed Peppas equation,the n value was more than 1.With the decreased of ionic strength,the release of BH,the swelling and erosion of the pellets increased.Conclusion:The release of BH from CMKGM pellets is related toβmannase concentration and ionic strength of dissolution media,drug release mechanism is enzymatic erosioncontrolled,which indicates the potential of the pellets to serve as a colon-specific drug delivery system.
Berberine hydrochloride;Carboxymethyl konjac glucomannan pellets;Enzyme concentration;Ionic strength;Colon-specific
R284
A
1672-7606(2010)02-0089-05
2010-03-12
张瑜(1972-),男,河南 开封 人,博士,副教授,从事药剂学的教学和科研工作。*通讯作者:侯世祥,男,教授,博士生导师,从事药物制剂的研究工作。

