牛蒡菊糖酶法提取
牛蒡菊糖酶法提取
采用固定化酶法提取牛蒡菊糖。结果表明酶水解提取牛蒡菊糖的最佳工艺为:13.5g/100mL中性蛋白酶、pH 7、固液比1:15、50℃、酶水解6h,菊糖提取率为14.57%;固定化酶制备最佳工艺为:以甲醛(40%):NaOH (2mol/L)=2:3为凝结液、pH7.5、壳聚糖2.5g/100mL、60℃、加酶量7.5mg/mL,固定8h,酶活力回收率可达到39.13%;固定化酶提取牛蒡菊糖最适条件为:pH7、固液比1:15、60℃、固定化酶加入量13.5g/100mL、酶解5h,在此条件下菊糖提取率达到12.89%。固定化酶的稳定性与游离酶相比有显著的提高,连续反应10次后,固定化酶仍然具有良好的使用性能,此时牛蒡菊糖的提取率为9.42%。
牛蒡;菊糖;中性蛋白酶;壳聚糖;固定化酶
牛蒡,别名树根菜,又名大力子,是菊科牛蒡属直根系两年生大型草本植物,生长适应性强,在我国江苏省徐州市的沛县、丰县已实现大面积人工栽培[1]。牛蒡根营养十分丰富,含多种维生素和钙、镁、铜和锰等矿物质,还含有牛蒡甙、牛蒡酚、牛蒡苦素和菊糖等有机物,有健胃、益气、利尿、泻下、滋阴壮阳、清热解毒和抑菌消炎等功效[2],深受日本及东南亚等国家人们的喜爱。在国内,牛蒡根作为民间草药,药典并未收载,也很少形成商品。随着人们对它营养价值的不断深入了解,牛蒡将有广阔的发展前景[3-5]。
菊糖,又称菊粉,广泛存在于自然界菊科植物体内,在牛蒡中含量极其丰富。菊糖是一种呋喃构型的D-果糖经β(2-1)糖苷键脱水聚合而成的果聚糖的混合物。菊糖微溶于冷水,在热水中能很快溶解;与碘不呈显色反应,没有还原性,有旋光性[6]。菊糖是目前发现的少有的几种可溶性膳食纤维之一,是体内双歧杆菌及乳酸菌的增强因子,其热值低,水溶性极好,且温度越高溶解性越好。它能够提高钙、锌和铁等矿物质的吸收率;有较好的持水性能;可调节血液中的胆固醇,降低血压及血糖,供糖尿病人食用;因此,菊糖可作为防治肿瘤、冠心病、糖尿病和便秘等保健食品配料和天然药物。另外菊糖还可以改善食品的组织结构,使其结构紧密,同时可改善食品的味觉及口感。基于其功效,在食品工艺中,可以将它广泛加入食品和饲料中,包括乳制品、糖果、焙烤制品、方便餐、早餐谷物及饮料,营养丰富,极其有利于身体健康。
目前,国内外从植物体中提取多糖的方法有[3-8]:热水提取醇沉法、碱提取法、酸提取法、酶提取法、微波提取法、超声波提取法、CO2超临界萃取、超滤法等,而利用固定化酶法提取牛蒡菊糖的研究,目前未见报道。本实验用固定化酶法提取牛蒡菊糖,旨在为开发利用这一植物资源提供科学依据。
1 材料与方法
1.1 原料与试剂
牛蒡购自徐州市翟山农贸市场。鲜牛蒡根用自来水洗净、去皮、切成薄片,干燥至质量恒定,粉碎,过40目筛,置于磨口瓶中备用。
胰蛋白酶(3500 U/g)、酸性蛋白酶(10万U/g)、中性蛋白酶(13万U/g)、木瓜蛋白酶(80万U/g)、碱性蛋白酶(30万U/g)、果胶酶(10万U/g)、纤维素酶(13万U/g)天津市诺奥科技发展有限公司;其他试剂均为分析纯;水为蒸馏水。
1.2 仪器与设备
7230G型可见分光光度计、FA2104N电子天平 上海精密科学仪器有限公司;PC-1000数显式电热恒温水浴锅、GZX-DH-600电热恒温干燥箱 上海跃进医疗器械厂;DZF-6020型真空干燥箱 上海精宏实验设备有限公司;DL-5低速大容量离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 单酶的确定
设定在50℃下,固液比为1:15,根据各种酶的活力不同加入一定量的单酶,pH值根据加入酶类而定,分别酶解4h,取出冷却,4000r/min离心10min,取上清液分别稀释到一定倍数,于分光光度计上测定吸光度,分别测定总糖和还原糖的含量,从而计算出菊糖提取率,确定最佳单酶。
1.3.2 单酶提取牛蒡菊糖研究
1.3.2.1 温度对牛蒡菊糖提取率的影响
选取pH7、固液比1:15、加酶量10%、时间5h,分别在30、40、50、60℃和70℃下于振荡器中水浴,取出冷却,4000r/min离心10min,取上清液,分别稀释相应的倍数,测定总糖和还原糖含量,计算出菊糖提取率,确定最佳温度。
1.3.2.2pH值对牛蒡菊糖提取率的影响
其他条件不变,在温度50℃条件,研究pH5、6、7、8和9对菊糖提取率的影响,确定最佳pH值。
1.3.2.3 固液比对牛蒡菊糖提取率的影响
其他条件不变,研究固液比1:5、1:10、1:15、1:20和1:25对菊糖提取率的影响,确定最佳固液比。
1.3.2.4 时间对牛蒡菊糖提取率的影响
其他条件不变,研究水浴3、4、5、6h和7h对菊糖提取率的影响,确定最佳时间。
1.3.2.5 加酶量对牛蒡菊糖提取率的影响
其他条件不变,研究加酶量3、6.5、10、13.5g/100mL和17g/100mL对菊糖提取率的影响,确定最佳加酶量。
1.3.3 单酶提取牛蒡多糖正交试验
选取4个主要影响因素进行四因素三水平的正交试验,操作步骤同单因素试验。
1.3.4 固定化酶的制备
1.3.4.1 制备工艺流程
采用吸附法进行固定化酶制备。
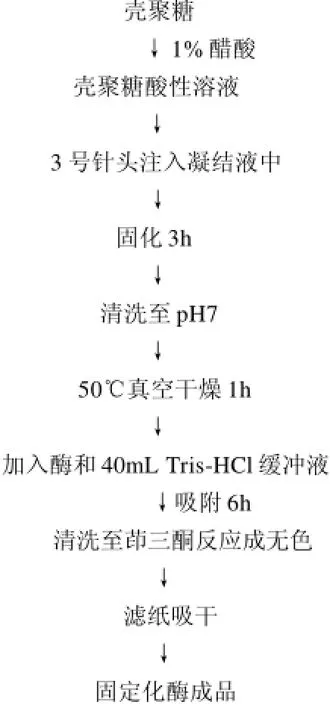
1.3.4.2 凝结液的选择
在pH7.5、加酶量7.5mg/mL、壳聚糖质量浓度3g/ 100mL、吸附时间6h、60℃条件下对酶进行固定化,通过测定酶活力回收率,对以下不同的凝结液进行选择:甲醛(40%):NaOH(2mol/L)=2:3(体积比)、甲醇(100%): NaOH(2mol/L)=1:3(体积比)、乙醇(95%):NaOH(15g/ 100mL)=2:4、乙酸乙酯:NaOH(3g/100mL)=2:3。

1.3.4.3 壳聚糖质量浓度的选择
在pH7.5、加酶量7.5mg/mL、时间6h、60℃的条件下,分别在壳聚糖质量浓度为1.5、2.0、2.5、3.0g/100mL和3.5g/100mL对酶进行固定化,通过测定酶活力回收率,对壳聚糖质量浓度进行选择。
1.3.4.4pH值对固定化酶活力回收率的影响
在加酶量7.5mg/mL、时间6h和温度60℃条件下,选取pH6.5、7.0、7.5、8.0和8.5,研究pH值对固定化酶酶活力回收率的影响。
1.3.4.5 加酶量对固定化酶活力回收率的影响
其他条件不变,在pH7.5条件,选择加酶量2.5、5.0、7.5、10.0mg/mL和12.5mg/mL(壳聚糖酸性溶液的体积)进行研究。
1.3.4.6 固定化时间对固定化酶活力回收率的影响
在pH7.5、加酶量为7.5mg/mL、温度60℃条件下,选取固定化时间2、4、6、8h和10h进行研究。
1.3.4.7 固定化温度对固定化酶活力回收率的影响
在pH7.5、加酶量7.5mg/mL、固定化时间6h条件下,选择固定化温度30、40、50、60℃和70℃进行研究。
1.3.4.8 固定化酶制备正交试验
选取4个影响因素进行四因素三水平正交试验。1.3.5固定化酶提取牛蒡菊糖试验
1.3.5.1pH值对固定化酶提取菊糖的影响
按单酶酶解法从牛蒡中提取菊糖的步骤,将单酶替换成固定化酶,在温度60℃、固液比1:15、固定化酶加酶量6.5mg/100mL、时间5h条件下,选取pH5、6、7、8和9进行研究。
1.3.5.2 固定化酶加酶量对菊糖提取率的影响
其他条件不变,在pH6条件下,选取固定化酶量3、6.5、10、13.5g/100mL和17g/100mL情况下,研究固定化酶加酶量对提取牛蒡菊糖的影响。
1.3.5.3 固液比对菊糖提取率的影响
其他条件不变,研究固液比1:5、1:10、1:15、1:20和1:25对固定化酶提取牛蒡菊糖的影响。
1.3.5.4 酶解时间对菊糖提取率的影响
其他条件不变,研究酶解时间3、4、5、6h和7h对固定化酶提取牛蒡菊糖的影响。
1.3.5.5 酶解温度对菊糖提取率的影响
其他条件不变,研究酶解温度30、40、50、60℃和70℃对固定化酶提取牛蒡菊糖的影响。
1.3.5.6 固定化酶提取牛蒡菊糖正交试验
选取4个影响因素进行四因素三水平的正交试验。
1.3.6 固定化酶使用稳定性实验
选取固定化酶提取菊糖的最佳方案,用同一批固定化酶对牛蒡进行水解,提取菊糖10次,测定每一次的提取率,对固定化酶的稳定性进行研究。
1.3.7 分析方法
1.3.7.1 菊糖含量的测定
总糖的测定:采用苯酚-硫酸法[4-10],以葡萄糖为标准,以吸光度(y)为纵坐标,糖质量浓度(μg/mL)(x)为横坐标,绘制标准曲线,得线性回归方程:y=0.0593x+0.0261,R2=0.9993。计算出总糖的含量。
还原糖的测定:采用3,5-二硝基水杨酸法[3-7],以葡萄糖为标准,以吸光度(y)为纵坐标,糖质量浓度(x)为横坐标,绘制标准曲线,得线性回归方程:y=0.0162x-0.0860,R2=0.9995。计算出还原糖的含量。
总糖含量减去还原糖含量即为菊糖的含量。
1.3.7.2 菊糖提取率的测定[3]

1.3.7.3 蛋白质含量的测定
采用考马斯亮蓝法[11],以牛血清白蛋白溶液为标准,以吸光度(y)为纵坐标,牛血清白蛋白溶液浓度(x)为横坐标,绘制标准曲线,得线性回归方程:y=0.0062x+0.0411,R2=0.9992。计算出蛋白质的含量。
1.3.7.4 蛋白酶活力测定
一个活力单位(U)是指每1g蛋白酶平均1min释放酪氨酸的微克数。
1.3.8 酪氨酸标准曲线的绘制[12]
将 L-酪氨酸用 Tris-HCl 缓冲液配制成不同浓度的溶液,测定它们在 275nm 处的吸光度,以浓度(x)为横坐标,吸光度(y)为纵坐标作出标准曲线。得线性回归方程:y = 0.0074x+0.0396,R2=0.9992。计算酶的活力。
1.3.9 游离酶活力测定[13-14]
在具塞试管中依次加入 1mL酶液(V1)、3mL 酶激活剂,37℃水浴中预热 10min后,加入 10mL 酪蛋白溶液(已经于 37℃水浴中预热),摇匀,在 37℃水浴中精确反应 10min,然后加入 10mL三氯醋酸溶液,剧烈摇动后,在 37℃水浴中放置0.5h 后,离心,取上清液在275nm 处测定吸光度。
空白为在加入底物之前加入三氯醋酸终止剂。其余步骤同上。
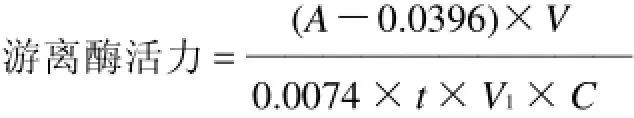
式中:A为溶液的吸光度;V为测定时溶液的总体积/mL;t为测定所用时间/min;V1为酶液的测定用量/ mL;C为酶液的质量浓度/(g/mL)。
1.3.10 固定化酶活力测定[12-15]
在具塞试管中加入适量的固定化酶(g)和3mL酶激活剂,在37℃水浴中预热10min 后,加入 10mL 酪蛋白溶液(已经于37℃水浴中预热),摇匀,在37℃水浴中精确反应 10min,然后加入 10mL 三氯醋酸溶液,剧烈摇动后,在 37℃水浴中放置0.5h,离心,取上清液在275nm 处测定吸光度。空白:在加入底物之前加入三氯醋酸终止剂。其余步骤同上。
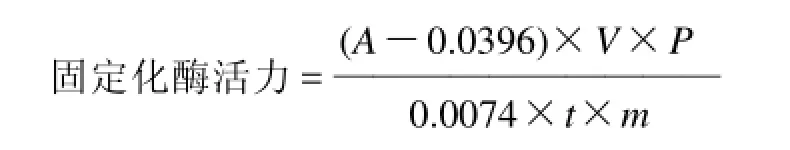
式中:P为稀释倍数;m为固定化酶测定用量/g。
2 结果与分析
2.1 游离酶提取牛蒡菊糖试验
2.1.1 最佳单酶的确定
于七支具塞试管中分别加入1g牛蒡粉,在固液比1:15、酶解时间5h、酶解温度50℃、加酶量10万U及pH值为各个酶的最佳pH值条件下,研究不同单酶对牛蒡菊糖的提取率,结果如图1所示。
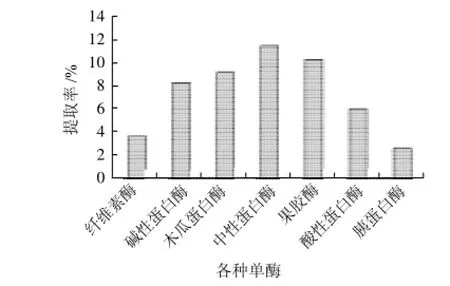
图1 不同单酶的菊糖提取率Fig.1 Effect of enzyme on the yield of inulin from burdock root
由图1可见,分别用纤维素酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、果胶酶、酸性蛋白酶和胰蛋白酶这七种酶,从牛蒡中提取菊糖,中性蛋白酶的提取率最高,为11.24%,所以在以下实验中均采用中性蛋白酶进行研究。
2.1.2 单因素试验
2.1.2.1pH值对中性蛋白酶提取菊糖的影响
由图2可知,菊糖提取率随pH值增大而增大,当pH值为7时,菊糖提取率最大,随着pH值的继续增大,提取率变化不大。所以,中性蛋白酶提取菊糖的最佳pH7,此时菊糖提取率为12.07%。当pH值低于7时,由于未达到该酶的最佳状态,因此,菊糖的提取率较低;而当pH值大于7时,菊糖提取率也小于在pH值为7时的菊糖提取率。因此,中性蛋白酶的最佳pH值为7。
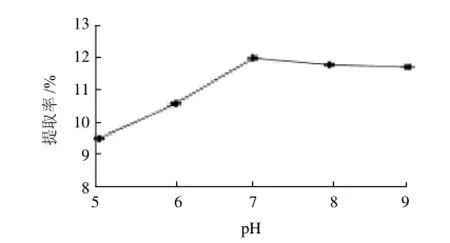
图2 pH值对菊糖提取率的影响Fig.2 Effect of pH value on the yield of inulin from burdock root
2.1.2.2 加酶量对中性蛋白酶提取菊糖的影响
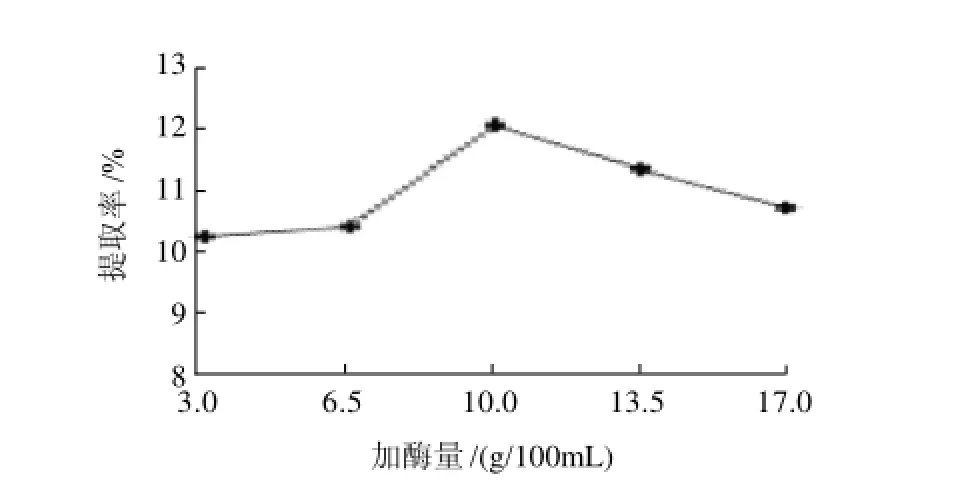
图3 加酶量对菊糖提取率的影响Fig.3 Effect of enzyme dosage on the yield of inulin from burdock root
由图3可见,当加酶量10g/100mL时,中性蛋白酶的菊糖提取率最高,为12.10%;加酶量再增加时,提取率不能继续提高。所以确定最佳加酶量为10g/ 100mL。当加酶量较低时,菊糖不能充分地释放出来,因此,菊糖提取率较低;当加酶量达到10g/100mL时,菊糖提取率达到最高。
2.1.2.3 固液比对中性蛋白酶菊糖提取率的影响
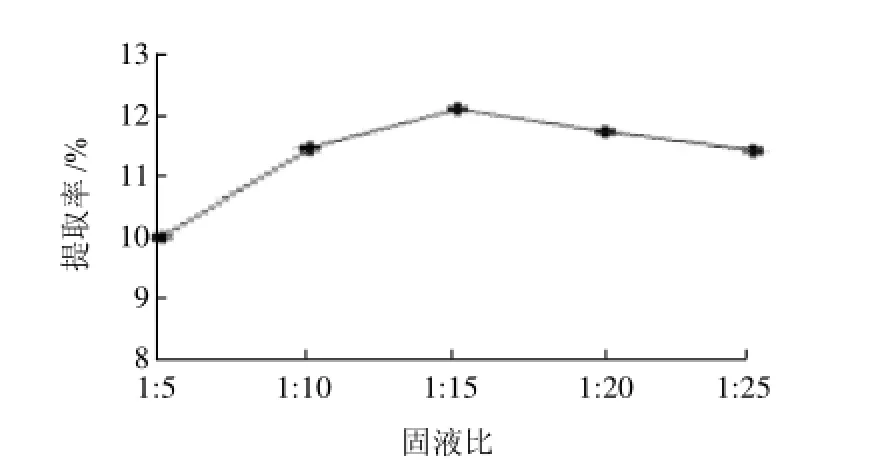
图4 固液比对菊糖提取率的影响Fig.4 Effect of solid-liquid ratio on the yield of inulin from burdock root
由图4可知,中性蛋白酶在固液比1:15时对牛蒡的菊糖提取率最高,为12.16%。因此最佳固液比为1:15。因为液体比例过高会导致牛蒡液浓度过低,所提取的菊糖量就会降低,而液体比例过低时,牛蒡液浓度又过高,甚至出现糊状,样液不能被充分酶解,菊糖提取率就会比较低。
2.1.2.4 酶解时间对中性蛋白酶菊糖提取率的影响
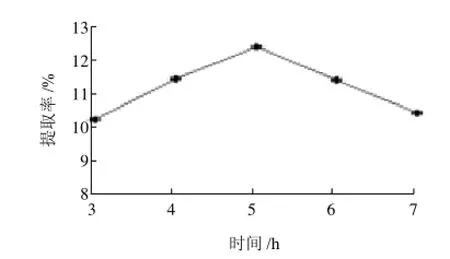
图5 酶解时间对菊糖提取率的影响Fig.5 Effect of hydrolysis time on the yield of inulin from burdock root
由图5可知出,中性蛋白酶提取牛蒡中菊糖的最佳酶解时间为5h,提取率为12.45%,时间大于或小于5h,提取率均呈下降趋势。因此,中性蛋白酶提取牛蒡中菊糖的最佳时间是5h。当酶的作用时间小于5h时,酶的作用没有得到充分发挥,因此菊糖提取率不高;而当酶的作用时间大于5h时,可能酶的活性又会有部分损失,菊糖提取率会有所下降,因此酶的最佳作用温度是5h。
2.1.2.5 酶解温度对中性蛋白酶菊糖提取率的影响
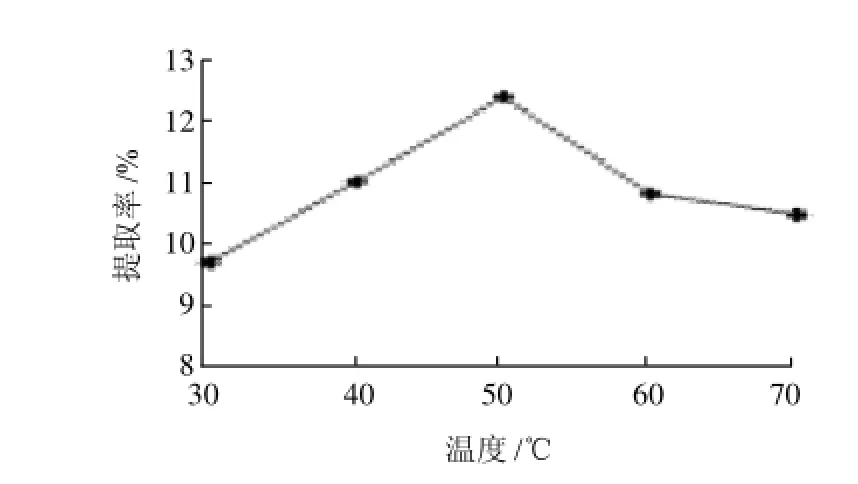
图6 酶解温度对菊糖提取率的影响Fig.6 Effect of hydrolysis temperature on the yield of inulin from burdock root
由图6可知,在温度50℃时,中性蛋白酶菊糖提取率最高,为12.44%。当酶的作用温度小于50℃时,酶的作用没有得到充分发挥,因此菊糖提取率不高;而当酶的作用时间大于50℃时,可能酶的活性又会有部分损失,菊糖提取率会有所下降,因此酶的最佳作用温度是50℃。
2.1.3 最佳条件的确定
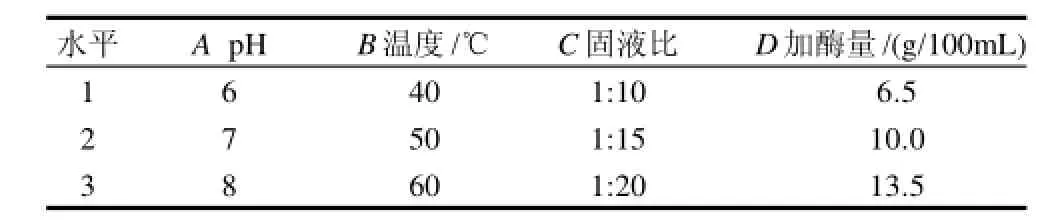
表1 单酶提取试验因素水平表Table 1 Factors and the levels for orthogonal test
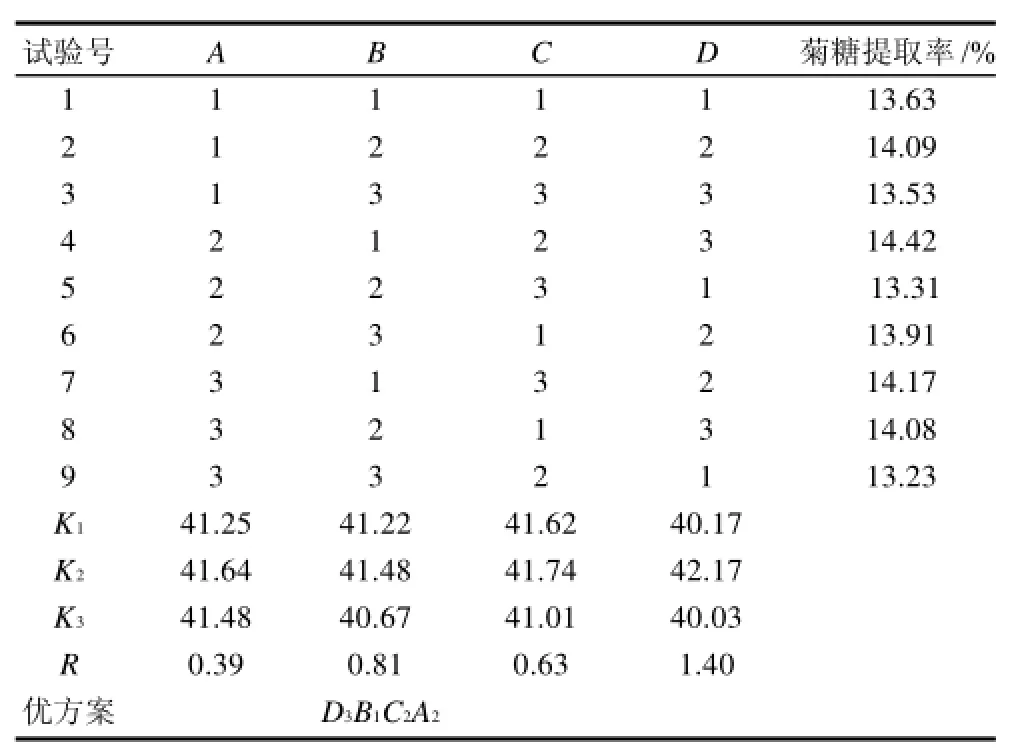
表2 中性蛋白酶提取牛蒡菊糖正交试验结果Table 2 Experimental design and results
为了优化提取条件,在以上单因素试验的基础上,进行了四因素三水平正交试验,选用因素水平见表1,正交试验结果见表2。
由表2可知,通过正交试验,各个因素对中性蛋白酶提取牛蒡菊糖提取率的影响顺序为D>B>C>A,最佳组合为D3B1C2A2,在此条件下的牛蒡菊糖提取率为14.42%;而分析最佳为D3B2C2A2。由于试验最佳方案和分析最佳方案不一致,因此,通过验证实验来确定最佳方案。

表3 不同水平下的单酶提取菊糖效果Table 3 Yield of inulin under different extraction conditions
通过验证实验,确定最佳方案为D3B2C2A2,即pH7、温度50℃、固液比1:15、加酶量13.5g/100mL、时间4h,在此条件下,菊糖提取率为14.57%(表3)。
2.2 固定化酶的制备
2.2.1 凝结液的选择
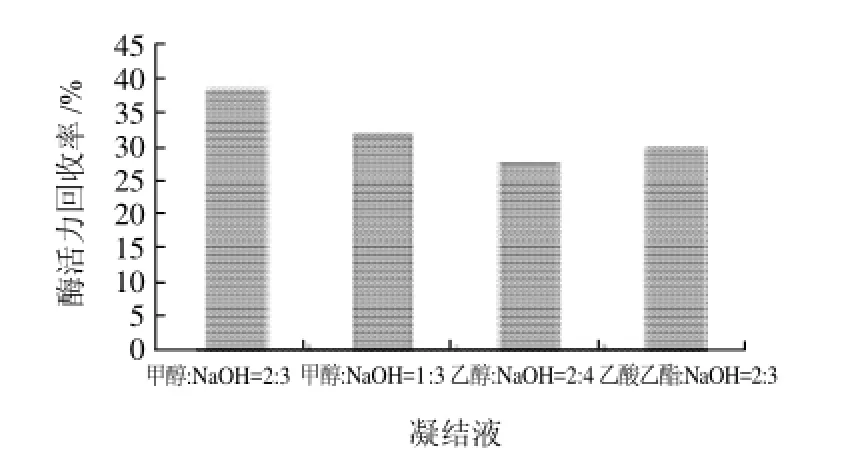
图7 凝结液对固定化酶活力的影响Fig.7 Effect of suspension medium on the recovery of immobilized enzyme activity
在pH7.5、加酶量7.5mg/mL、时间6h、温度60℃的条件下,通过测定固定化酶酶活力回收率,对不同的凝结液进行了选择。结果如图7所示。
由图7可以看出,当凝结液为醛:NaOH=2:3时,固定化效果最好,酶活力回收率为38.25%。所以选择甲醛(40%):NaOH溶液(2mol/L)=2:3作为凝结液。
2.2.2 壳聚糖质量浓度的选择

表4 壳聚糖质量浓度对壳聚糖微球制备的影响Table 4 Effects of chitosan concentration on the preparation of chitosan microspheres
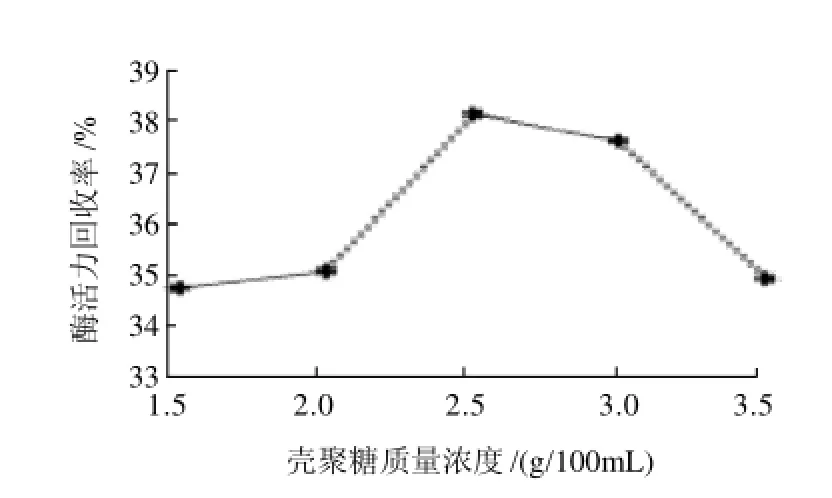
图8 壳聚糖质量浓度对酶活力回收率的影响Fig.8 Effect of chitosan concentration on the recovery of immobilized enzyme activity
由表4和图8可以看出,当壳聚糖质量浓度为2.5g/ 100mL时,固定化的效果最好,酶活力回收率最高,为38.21%。
2.3 酶固定化影响因素
2.3.1 单因素对固定化酶酶活力回收率的影响
2.3.1.1pH值对固定化酶活力回收率的影响
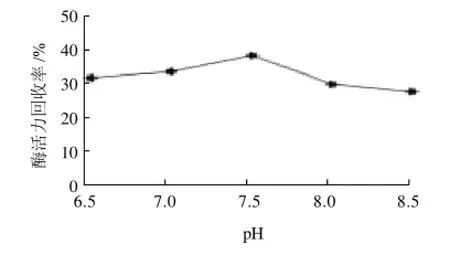
图9 pH值对固定化酶活力回收率的影响Fig.9 Effect of pH value on the recovery of immobilized enzyme activity
由图9可知,在pH值为7.5下固定的固定化酶的效果最好,酶活力回收率为38.67%。每一个固定化酶都有其最佳pH值,低于或高于最佳pH值,都不能使酶的作用充分发挥,因此,该固定化酶的最佳作用pH值为7.5。
2.3.1.2 加酶量对固定化酶活力回收率的影响

图10 加酶量对固定化酶活力回收率的影响Fig.10 Effect of enzyme concentration on the recovery of immobilized enzyme activity
从图10可以看出,壳聚糖溶液中的最佳加酶量7.5mg/mL 时的固定化效果最好,此时酶活力回收率为38.58%。壳聚糖溶液中的加酶量过低,酶的固定化量则较少,壳聚糖没有充分被利用,因此酶活力回收率就会较低;壳聚糖溶液中的加酶量过高,则会超出壳聚糖的吸附量,有些酶就会损失,也会使酶的回收率较低,因此在加酶量在7.5mg/mL时,壳聚糖的含量与酶的含量最为合适,因此酶活力回收率也最高。
2.3.1.3 固定化时间对固定化酶活力回收率的影响
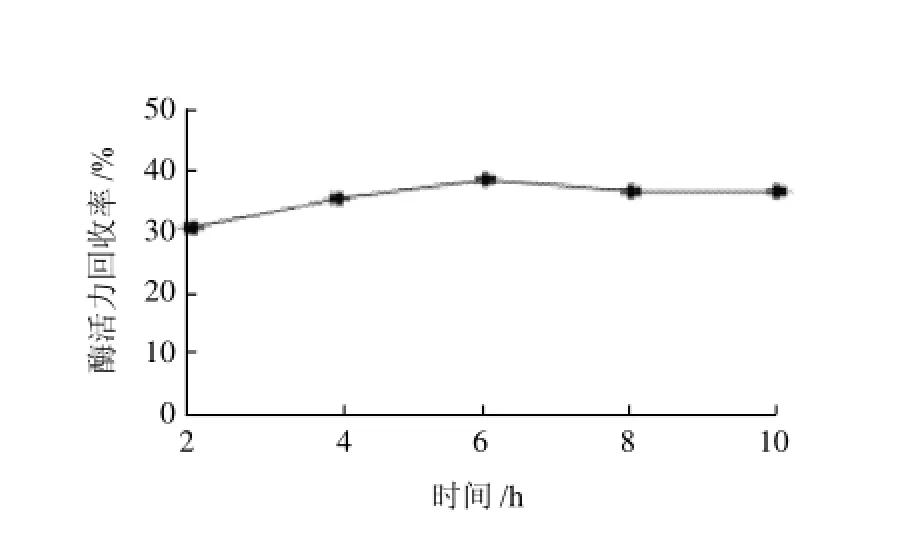
图11 固定化时间对固定化酶酶活力回收率的影响Fig.11 Effect of immobilization time on the recovery of immobilized enzyme activity
由图11可知,当固定化时间为6h,固定化效果达到最好,酶活力回收率为38.95%。固定化时间过短,酶的固定化量则较少,因此酶活力回收率就会较低;固定化时间过长,则会增加实验时间。因此在固定化时间为6h时,作用时间最为合适。
2.3.1.4 固定化温度对固定化酶活力回收率的影响
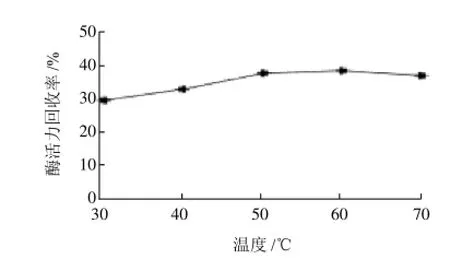
图12 固定化温度对固定化酶活力回收率的影响Fig.12 Effect of immobilization temperature on the recovery of immobilized enzyme activity
从图12可以看出,当60℃时,固定化酶的固定化效果最好,酶活力回收率为39.06%。固定化温度过低,酶的固定化量则较少,因此酶活力回收率就会较低;固定化温度过高,则会增加实验时间,同时也会使酶的活性有所较低。因此在固定化温度为60℃时,作用时间最为合适。
2.3.2 固定化酶工艺的正交试验

表5 固定化酶工艺正交试验因素水平表Table 5 Factors and levels for enzyme immobilization
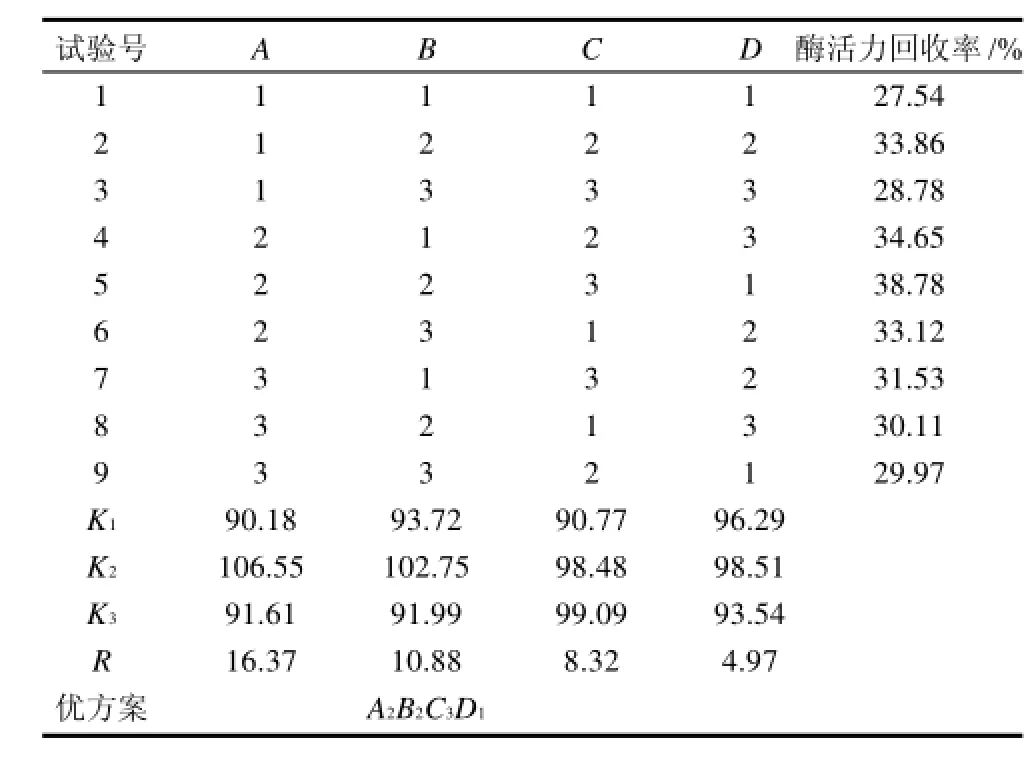
表6 固定化酶固定化条件正交试验结果Table 6 Experimental design and results of the orthogonal test for enzyme immobilization
由表5、6可以看出:最佳酶活力回收率为38.78%,最佳水平组合是A2B2C3D1,根据表中极差R的分析,各个因素对固定化效果的影响顺序为A>B>C>D,并且分析最佳为A2B2C3D2。

表7 不同水平下的固定化酶效果Table 7 Recoveries of immobilized enzyme activity under different conditions
由于试验最佳和分析最佳得到的最优水平组合不一致,因此需要做验证实验,结果见表7。由表7可以看出,分析最佳的结果为39.13%,其值大于试验最佳,确定固定化酶的固定化最佳工艺为分析最佳:pH7.5,加酶量7.5mg/mL,固定化时间8h,固定化温度60℃。
2.3.3 固定化酶提取牛蒡菊糖试验
2.3.3.1pH值对菊糖提取率的影响
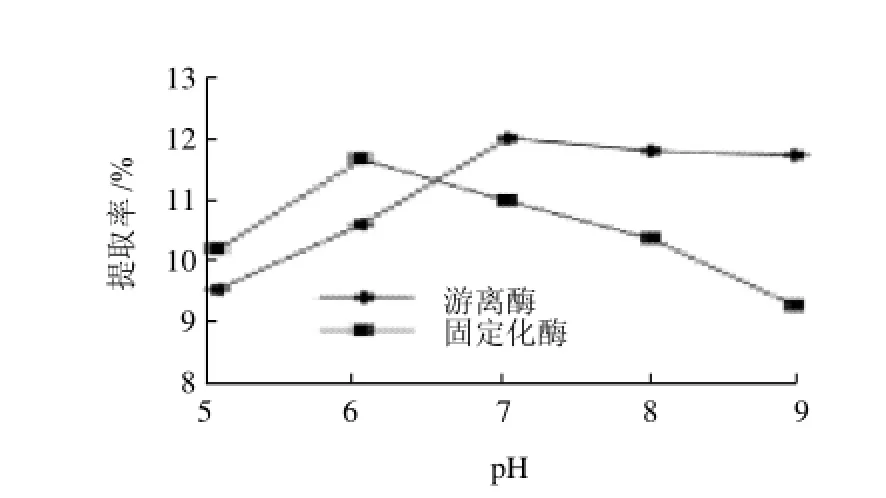
图13 pH值对菊糖提取率的影响Fig.13 Effect of pH value on the yield of inulin
由图13可以看出,固定化酶的最佳pH值为6,菊糖提取率为11.72%,而游离酶的最佳pH值为7,菊糖提取率为12.07%。说明游离酶经过固定化后,其pH值的稳定性增加了。
2.3.3.2 加酶量对菊糖提取率的影响

图14 固定化酶用量对菊糖提取率的影响Fig.14 Effect of immobilized enzyme dosage on the yield of inulin
从图14可以看出,固定化酶的最佳加酶量是10g/ 100mL,此时菊糖提取率是11.72%。游离酶的最佳加酶量也为10g/100mL时,菊糖提取率为12.10%。
2.3.3.3 固液比对菊糖提取率的影响
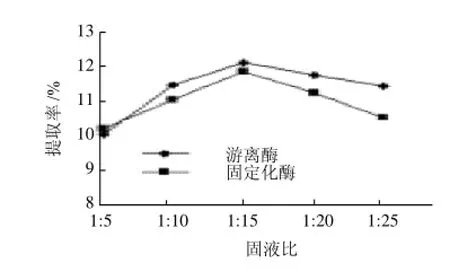
图15 固液比对菊糖提取率的影响Fig.15 Effect of solid/liquid ratio on the yield of inulin
从图15可以看出,固定化酶提取菊糖的最佳固液比是1:15,菊糖提取率11.79%,而游离酶的最佳固液比也是1:15,菊糖提取率12.16%。
2.3.3.4 酶解时间对菊糖提取率的影响
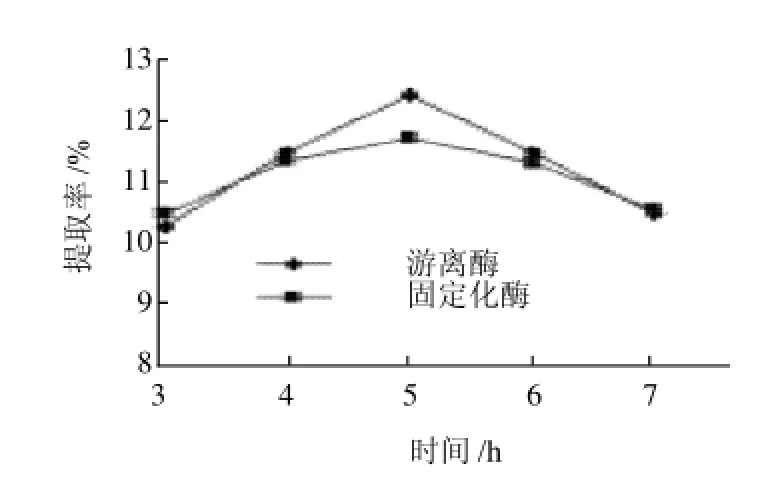
图16 酶解时间对菊糖提取率的影响Fig.16 Effect of enzymatic hydrolysis time on the yield of inulin
由图16可知,游离酶和固定化酶提取菊糖的最佳时间都是5h,此时,游离酶的提取率是12.45%,而固定化酶的提取率为11.74%。
2.3.3.5 酶解温度对菊糖提取率的影响
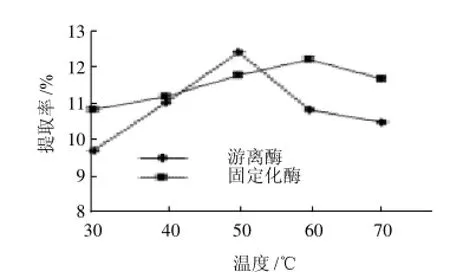
图17 温度对菊糖提取率的影响Fig.17 Effect of enzymatic hydrolysis temperature on the yield of inulin
由图17可知,固定化酶的最佳酶解温度为60℃,此时的菊糖提取率为11.82%,而游离酶的最佳酶解温度50℃,此时的菊糖提取率为12.44%。说明游离酶经过固定化后,其热稳定性增加了。
2.3.3.6 固定化酶提取菊糖的正交试验
选取4个影响因素进行四因素三水平的正交试验。选取因素水平表和正交试验结果如表8、9所示。
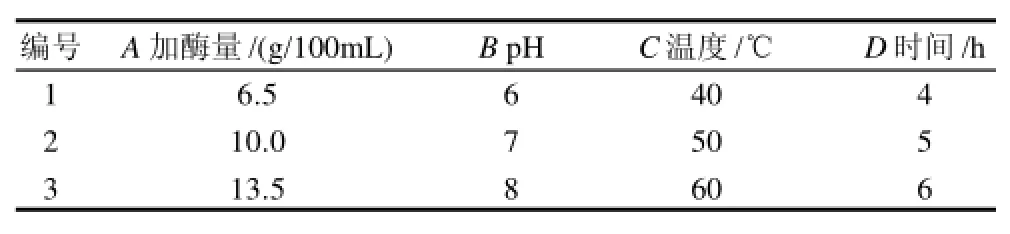
表8 固定化酶试验的因素及水平表Table 8 Factors and levels for preparation of inulin by immobilized enzyme hydrolysis
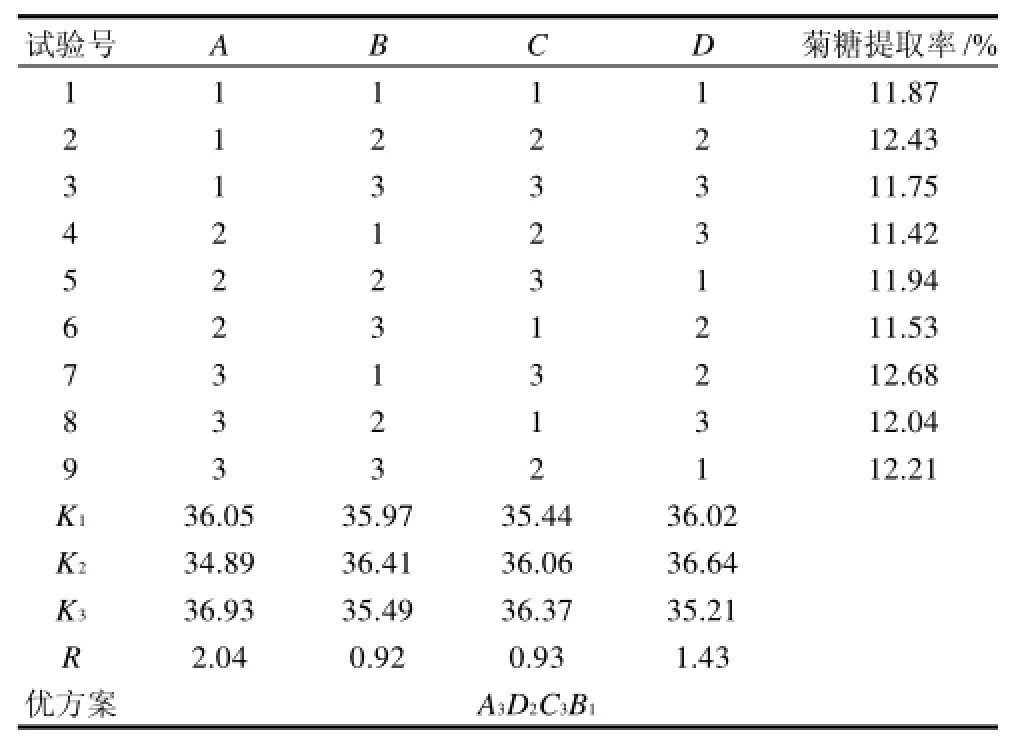
表9 固定化酶提取菊糖工艺条件正交试验结果Table 9 Experimental design and results for preparation of inulin by immobilized enzyme hydrolysis
由表9正交试验表可以看出,试验得到菊糖提取率最高为12.68%,最佳水平组合是A3D2C3B1,根据表中极差R的分析,各个因素对固定化效果的影响顺序为A>D>C>B,并且分析最佳为A3D2C3B2。
由于试验最佳和分析最佳得到的最优水平组合不一致,因此需要做验证性实验,结果如表10所示。

表10 不同水平下的提取效果Table 10 Yield of inulin under different hydrolysis conditions
通过验证实验,确定最佳试验方案是分析最佳,即加酶量13.5g/100mL、时间5h、温度60℃和pH7,此时,固定化酶对牛蒡菊糖的提取率为12.89%。
2.3.3.7 固定化酶使用稳定性实验
选取固定化酶提取菊糖的最佳方案,用同一批固定化酶对牛蒡进行水解,提取菊糖10次,测定每一次的提取率,对固定化酶的稳定性进行研究。结果如图18所示。由图18可见,固定化酶在使用10次后,对牛蒡中菊糖的提取效率由12.62%降低到9.46%,说明酶在经过固定化后性能稳定,可重复利用。
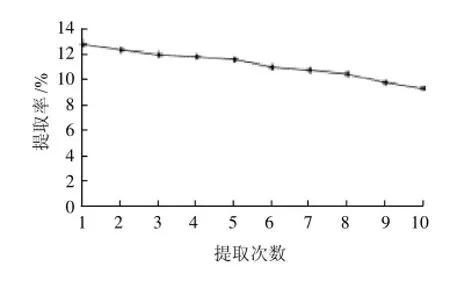
图18 固定化酶的稳定性实验Fig.18 Stability test of immobilized enzyme
3 结 论
3.1 用7种单酶从牛蒡中提取菊糖,其中中性蛋白酶的菊糖提取率最高,为11.24%。
3.2 采用中性蛋白酶提取牛蒡菊糖,最佳工艺条件为:固液比为1:15,中性蛋白酶加酶量为13.5g/100mL,pH7,在50℃下酶解5h,菊糖提取率可达到14.57%。
3.3 固定化酶工艺:采用吸附工艺固定化中性蛋白酶:以甲醛:NaOH=2:3为凝结液,壳聚糖质量浓度为2.5g/100mL,在pH7.5、60℃、加酶量7.5mg/mL中性蛋白酶的条件下,固定化时间8h,酶活力回收率可达到39.13%。
3.4 固定化酶提取牛蒡菊糖的最佳条件为:固液比1:15,固定化酶用量13.5g/100mL,pH7,在60℃、酶解5h,菊糖提取率达到12.89%。
3.5 固定化酶的稳定性:固定化酶pH值稳定性、热稳定性与溶液酶相比都有显著的提高,并且固定化酶具有较好的操作稳定性,连续反应10次后,固定化酶仍然具有良好的使用性能。
3.6 用以上方法制备的固定化酶提取的粗菊糖,菊糖含量为65.48%,蛋白质含量为1.63%。
[1]YOSHIHIKO M, JUN K, RYOYA N. Antioxidative caffeoy lquinic acid derivatives in the roots of Burdock(Arctium lapa L.)[J]. Agri Food Chem, 1995, 43: 2592-2595.
[3]曹泽虹, 董玉玮, 苗敬芝, 等. 双酶水解提取牛蒡菊糖的研究[J]. 食品科学, 2009, 30(22): 168-172.
[4]COTE F, HHN M G. Oligosaccharins structures and signal transduction [J]. Plant Molbiol, 1994, 26: 1375-1411.
[5]CHEN Fuan, WU Anbang, CHEN Chauyang. The influence of different treatments on the free radical scavenging activity of burdock and variations of its active components[J]. Food Chemistry, 2004, 86: 479-484.
[6]郝林华, 陈靠山, 李光友. 牛蒡菊糖及其制备方法的研究[J]. 中国海洋大学学报, 2004, 34(3): 423-428.
[7]董梅, 姚惠源. 牛蒡根中菊糖的提取与制备[J]. 食品工业, 2005(2): 43-45.
[8]张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999: 10-12.
[9]熊善柏. 菊糖的提取与精制[J]. 冷饮与速冻食品工业, 2001(12): 1-3.
[10]WANG Zhaojing, LUO Dianhui, LIANG Zhongyan. Structure of polysaccharides from the fruiting body of Hericium erinaceus Pers[J]. Carbobydrate Polymer, 2004, 57: 241-247.
[11]刘成梅, 万茵, 涂宗财, 等. 百合多糖脱蛋白方法的研究[J]. 食品科学, 2002, 23(1): 89-90.
[12]陈巍, 罗志刚. 天然多糖在酶固定化材料载体材料中的应用[J]. 中国酿造, 2006(4): 1-4.
[13]PESSONI R A, FIGUEIREDO-RIBEIRO R C, BRAGA M R. Extracellular inulinases from Penicillium janczewskii, a fugus isolated from the rhizosphere of Vernonia herbacea (Asteraceae)[J]. J Appl Microbiol, 1999, 11: 105-117.
[14]宣景宏, 张春艳, 孟宪军, 等. 壳聚糖固定化红树莓超氧化物歧化酶的研究[J]. 北方园艺, 2007(2): 31-33.
[15]许牡丹. 甲壳素固定化β-甘露糖酶的研究[J].食品科技, 2007(1): 50-52.
Enzymatic Extraction of Inulin from Burdock (Arctium lappa L.) Root
CAO Ze-hong,LU Hai-yan, DONG Yu-wei,SHAO Ying,YANG Jin-yu,DIAO Jin-jin (Jiangsu Provincial Research Centre of Food and Biology Process Engineering Technology,
School of Food Biological Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
Inulin was extracted by using enzyme hydrolysis method from burdock (Arctium lappa L.) root. The optimum extraction conditions were as follows: neutral protease content 13.5 g/100 mL, pH 7, solid/liquid ratio 1:15, hydrolysis time 6 h, temperature 50 ℃. The yield of inulin under the optimum conditions was 14.57%. A 2.5 g/100 mL solution of chitosan in 1% aqueous acetic acid was prepared which contained 7.5 mg/mL of neutral protease, and then it was poured, dropwise, into a suspension medium consisting of 40% formaldehyde and 2 mol/L of NaOH at the volume ratio of 2:3 at 60℃ and pH 7.5. The immobilization time was 8 h. And the recovery of enzyme activity was 39.13%. The optimum extraction conditions using immobilized enzyme were as follows: pH 7, solid/liquid ratio 1:15, hydrolysis temperature 60 ℃, immobilized enzyme 13.5 g/100 mL. Under such conditions ,the yield of inulin was 12.89%. After 10 times continuous reaction, the yield of inulin decreased to 9.42%, which indicated that the stability of the immobilized enzyme was significantly improved.
burdock;inulin;neutral protease;chitosan;immobilized enzyme
O629.12
A
1002-6630(2010)24-0037-09
2010-06-19
江苏省高校自然科学研究计划项目(07KJD550202);江苏省高等学校大学生实践创新训练计划项目(X201003)
曹泽虹(1963—),女,副教授,本科,研究方向为食品生物技术。E-mail:czh001001@163.com

