光皮木瓜绿原酸的提取及抗菌活性测定
胡仲秋,洪小迪,岳田利
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
光皮木瓜绿原酸的提取及抗菌活性测定
胡仲秋,洪小迪,岳田利
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
为提高木瓜的利用价值,首次利用甲醇研究光皮木瓜中绿原酸的最佳提取工艺,在单因素试验基础上,通过正交试验设计考察浸提溶剂体积分数、浸提温度、浸提料液比和浸提时间对绿原酸提取的影响,并初步考察绿原酸样品液对志贺氏痢疾杆菌及金黄色葡萄球菌的抗菌活性。结果表明从木瓜中提取绿原酸的最佳工艺条件为:以85%甲醇溶液(85:15,V/V)浸提木瓜粉、浸提料液比1:30(g/mL)、浸提温度40℃、浸提时间14h。在该工艺条件下,绿原酸的最高产率可达到0.142%。绿原酸提取液对志贺氏痢疾杆菌和金黄色葡萄球菌具有明显的抗菌活性,表明民间所用的木瓜白酒浸泡液的主要药理活性成分可能为绿原酸。
光皮木瓜;绿原酸;提取优化;抗菌活性;志贺氏痢疾杆菌;金黄色葡萄球菌
绿原酸(chlorogenic acid)是许多食用植物及药用植物中抗菌消炎、清热解毒的重要活性成分[1-4],有研究认为,绿原酸是很有希望的抗艾滋病毒(HIV)的先导化合物[5],它具有清除自由基[6-7]、抗脂质过氧化[8]和抗菌抗病毒等作用[9-10]。国内外一些学者从植物中提取多酚(绿原酸作为多酚中的一个组分),并考察了绿原酸的活性[11-12]。然而,很少有人从资源丰富的木瓜中提取绿原酸并研究其活性。木瓜为蔷薇科植物贴梗海棠[Chaenomeles speciosa (Sweet) Nakai]的成熟果实,有平肝和胃、去湿舒筋的功效,常用于治疗腰酸腿痛、风湿性关节炎、四肢转筋、吐泻等症[13-14]。在民间医术中,木瓜常用水或酒精浸泡,饮用后可以治腹泻和肿胀。木瓜在我国广泛种植,为我国特有古老果树之一,而且产量极大,仅云南省木瓜年产量就达5×106kg,现在山东、河南、陕西、安徽、江苏、湖北、四川、浙江、江西、广东、广西等省(区)都有栽培。本实验基于我国丰富的木瓜资源,研究光皮木瓜中绿原酸的甲醇提取法及其最佳工艺,并根据民间用木瓜白酒浸泡液治疗腹泻和肿胀,初步考察绿原酸对志贺氏痢疾杆菌及金黄色葡萄球菌的抗菌活性。
1 材料与方法
1.1 材料、试剂与仪器
鲜光皮木瓜(干燥后制成粉状),采于西北农林科技大学;绿原酸标准品 中国药品生物制品检定所;金黄色葡萄球菌CVM14、志贺氏杆菌CMCC56由西北农林科技大学食品微生物安全试验室杨保伟博士恵赠。
甲醇(分析纯);正己烷、氯仿(均为分析纯);蒸馏水;甲醇(色谱纯) 美国Fisher公司。
MP200B电子天平 上海精科天平仪器厂;电热恒温水浴锅 杨凌天成公司;SHB-III循环水式多用真空泵郑州长城科工贸有限公司;旋转蒸发仪 瑞士Buchi公司;PK121R离心机 意大利ALC公司;UV mini 1240紫外分光光度计和Lc2010型高压液相色谱仪 日本Shimadzu公司;PL202-S精密电子天平 瑞士梅特勒-托利多公司;CNP-9080隔水式恒温培养箱 上海精宏实验设备有限责任公司;ClassⅡ生物安全柜 美国 Nuaire公司。
1.2 木瓜中绿原酸的甲醇提取工艺以及工艺优化方法
1.2.1 提取工艺
工艺流程:200g干燥的木瓜片→粉碎成粉状(60目过筛)→加入甲醇浸提(2000mL)→抽滤→旋转蒸发(60℃旋转至100mL)→冷冻干燥得51.3g固体→取7g加入150mL蒸馏水充分溶解→加入100mL正己烷萃取→加入100mL氯仿→滤纸过滤→通过0.22μm水系滤膜过滤→获得滤液80mL→旋转蒸发(60℃旋转至50mL)→冷冻干燥得2.0g绿原酸粗品。
检测步骤:取2.0g绿原酸粗品和绿原酸标准品0.020g分别于100mL的容量瓶中用蒸馏水溶解并定溶,即得到样品液和0.2g/L绿原酸标准溶液。标准液稀释10倍后为0.02g/L的绿原酸标准溶液。样品液和0.02g/L标准溶液分别通过0.45μm水系滤膜过滤,分别上高压液相色谱仪进行检测。流动相为甲醇-水(3:7,V/V),流速0.8mL/min,紫外检测器检测波长设定为329nm,用Dikma HPLC反相C18柱(250mm×46mm,5μm)分离,确证提取液中是否含有绿原酸。
1.2.2 光皮木瓜绿原酸提取的单因素试验
采用1.2.1节提取工艺,用紫外-可见分光光度计检测绿原酸含量。
1.2.2.1 甲醇溶液的选择
精确称取5.00g木瓜粉,分别用体积分数50%、70%、90%、100%甲醇溶液100mL作为浸提剂, 40℃水浴浸提12h。按照1.2.2节方法进行操作。
1.2.2.2 浸提时间的选择
精确称取5.00g木瓜粉,用100mL 70%甲醇溶液作为浸提剂,分别在40℃水浴下浸提8、12、24、36h,按照1.2.2节方法进行操作。
1.2.2.3 浸提温度的选择
精确称取5.00g木瓜粉,用100mL 70%甲醇溶液作为浸提剂,分别在30、40、50、60℃水浴下浸提12h,按照1.2.2节方法进行操作。
1.2.2.4 料液比的选择
按照浸提料液比为1:10、1:20、1:30、1:40(g/mL)精确称取10.00、5.00、3.33、2.50g木瓜粉,用100mL 70%甲醇溶液作为浸提剂,在40℃水浴下浸提12h,按照1.2.2节方法进行操作。
1.2.3 木瓜中绿原酸的甲醇提取法正交试验
将甲醇溶液体积分数、浸提时间、浸提温度、浸提料液比4个因素,分别设计3个不同水平,选择L9(34)正交试验表(表1),按照1.2.2节方法进行试验。

表1 甲醇提取法提取木瓜中绿原酸因素水平表Table 1 Factors and levels for extracting chlorogenic acid from Chaenomeles sinensis Koehne
1.2.4 正交试验预期最佳组合验证实验
从正交试验中得到的最佳组合如果没有在正交试验表中,则进行验证实验。
1.2.5 光皮木瓜甲醇提取物中绿原酸的检测
粗提物中绿原酸的确证采用HPLC方法检测,后续结果均采用紫外分光光度计法检测。
1.2.5.1 绿原酸标准品紫外分光光度法检测波长的扫描
精确称取绿原酸标准品0.020g,用无水甲醇溶解,定容于100mL容量瓶中,在紫外分光光度计上从310~400nm对标准溶液进行波长扫描,获得标准品稀释液的紫外吸收光谱曲线。
1.2.5.2 绿原酸标准品标准曲线的制作
精确称取绿原酸标准品20mg,用100mL无水甲醇溶解配制为200μg/mL的绿原酸标准溶液,吸取一定体积的200μg/mL绿原酸标准溶液分别制作成质量浓度1.0、3.0、5.0、7.0、10.0、15.0、20.0、25.0、30.0μg/mL的梯度溶液,用无水甲醇作参比液,在紫外分光光度计上于329nm波长处分别测量各自的吸光度,绘制标准曲线。
1.2.6 光皮木瓜绿原酸提取产率的计算
将木瓜绿原酸提取样品溶液稀释100倍,分别于329nm处检测其吸光度,根据其吸光度在标准曲线上查得绿原酸含量。所有实验平行3次,数值为3次实验平均值。光皮木瓜绿原酸提取产率按下式计算:

式中:V为稀释100倍滤液中绿原酸的含量/(μg/mL);C为过滤后的体积/mL;m为木瓜粉的质量/g。
1.2.7 抗菌活性实验
使用琼脂扩散法进行抗菌实验[16]。细菌细胞菌悬液经24h培养将浓度调整到1×108CFU/mL。将灭菌营养琼脂倒入灭菌平板中,待琼脂凝固后以每20mL琼脂加200μL细菌菌悬液的比例加入调整好浓度的细菌菌悬液,并使其分布均匀。用灭菌的打孔器在平板中均匀地打孔。在孔穴中或不锈钢圈中加入70μL绿原酸提取液,用与绿原酸提取液相同浓度的青霉素作为阳性对照,用空白样做阴性对照。每个实验重复1次。
1.2.8 数据处理
所有数据采用DPS数据处理软件(V2.000)处理和分析(α=0.01)。
2 结果与分析
2.1 绿原酸最大吸收波长的扫描
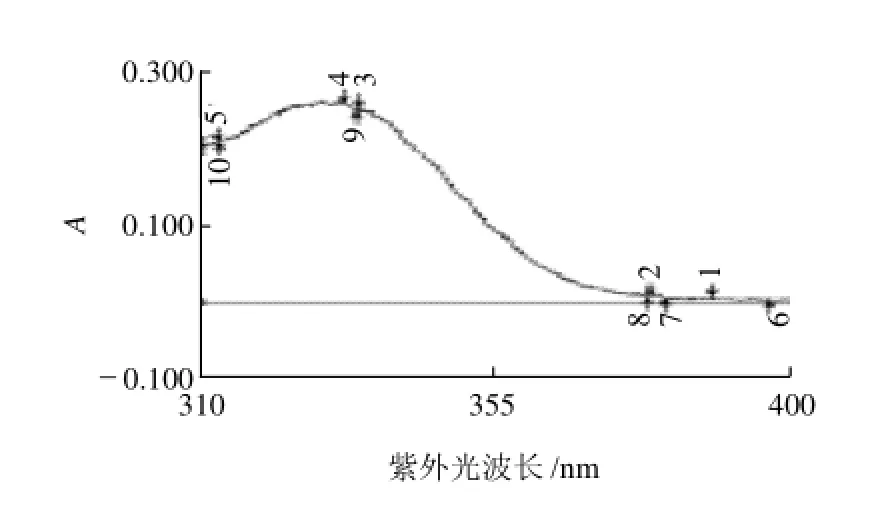
图1 2μg/mL绿原酸标准品溶液(无水甲醇作为溶剂)的紫外光谱扫描图谱Fig.1 Ultraviolet absorption spectrum of chlorogenic acid standard solution (2μg/mL in anhydrous methanol)
实验发现以200μg/mL绿原酸标准溶液稀释100倍(2 μg/mL)后的扫描图谱最好。即从图1可看出,绿原酸的最大吸收峰都在329nm(峰4),即选取329nm为HPLC和紫外分光光度法检测绿原酸的检测光波长。
2.2 光皮木瓜甲醇粗提物中绿原酸的HPLC检测结果
由图2可以看出,木瓜绿原酸提取纯化液的HPLC图谱中峰2与绿原酸标品溶液的峰1重合,而且绿原酸是提取物中的一个主要成分。

图2 绿原酸样品液和0.02g/L绿原酸标品溶液HPLC图谱的比对Fig.2 HPLC chromatograms chlorogenic acid sample solution and 0.02 g/L of chlorogenic acid standard solution
2.3 绿原酸标准品标准曲线
用200μg/mL的绿原酸标准液溶液制作质量浓度分别为0.0、1.0、3.0、5.0、7.0、10.0、15.0、20.0、25.0、30.0μg/mL的溶液,利用紫外分光光度计在329nm波长处测出各自的吸光度绘制出标准曲线如图3所示:y = 0.0562x-0.009(R2= 0.9992)。
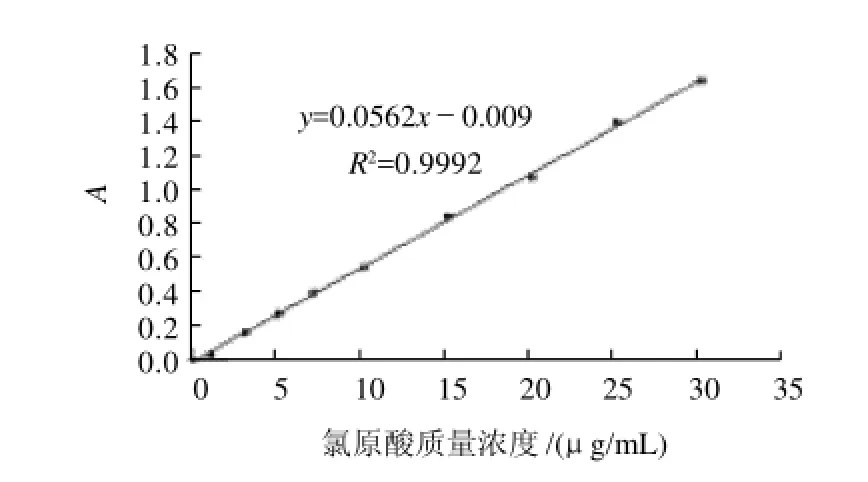
图3 绿原酸标准品溶液(无水甲醇作为溶剂)的标准曲线Fig.3 Standard curve of chlorogenic acid standard solution (anhydrous methanol as solvent)
2.4 木瓜中绿原酸的甲醇提取法单因素试验
2.4.1 甲醇溶液(浸提剂)体积分数对绿原酸产率的影响
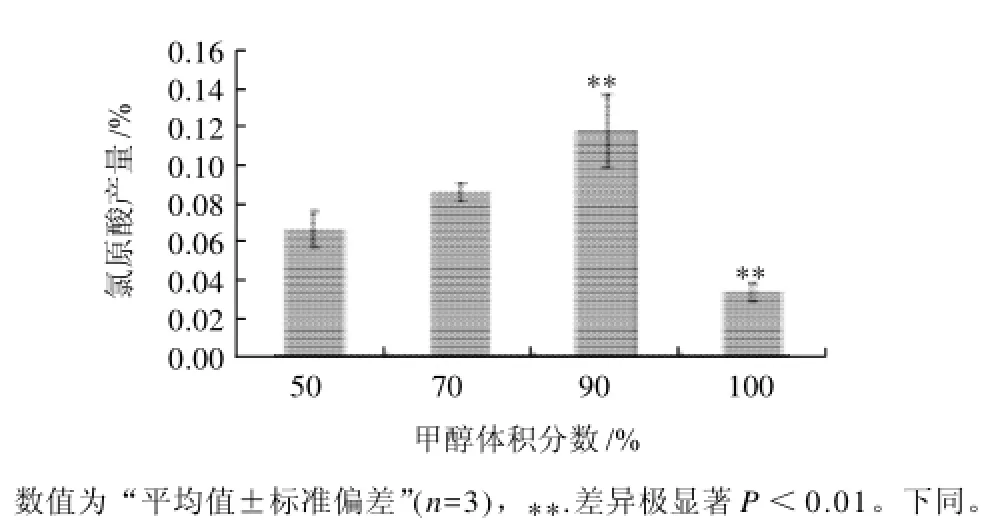
图4 不同甲醇溶液(浸提剂)中甲醇体积分数对绿原酸产率的影响Fig.4 Effect of ethanol concentration on the yield of chlorogenic acid
从图4可以看出,用甲醇溶液作为浸提剂时甲醇体积分数分别是50%、70%、90%时,绿原酸产率呈逐渐上升趋势,当90%甲醇作提取溶剂时绿原酸产率达到最大,甲醇体积分数为90%~100%时绿原酸产率迅速减小。方差分析显示在1%差异水平下,90%甲醇作为浸提溶剂时与100%甲醇作为浸提溶剂时绿原酸产率的差异是极显著的,说明甲醇体积分数在70%~90%之间为提取绿原酸的最佳区域。所以做正交试验时甲醇体积分数的3个水平分别选取为80%、85%、90%。
2.4.2 浸提时间对绿原酸提取的影响

图5 浸提时间对绿原酸产率的影响Fig.5 Effect of extraction time on the yield of chlorogenic acid
从图5可看出,浸提时间从8~12h绿原酸产率迅速提高,12h达到最高,12h后开始逐渐降低,24h次之,36h绿原酸产率最低。方差分析显示,在1%差异水平下,8h浸提的产率与其他各水平的产率呈极显著性差异。浸提时间12、24h和36h各水平之间,绿原酸产率的差异都是极不显著的。从提高绿原酸的效率角度考虑,选取正交试验该因素的不同水平选在12h左右为宜。故做正交试验时,浸提时间这个因素的3个水平分别选取为10、12、14h。
2.4.3 浸提温度对绿原酸产率的影响
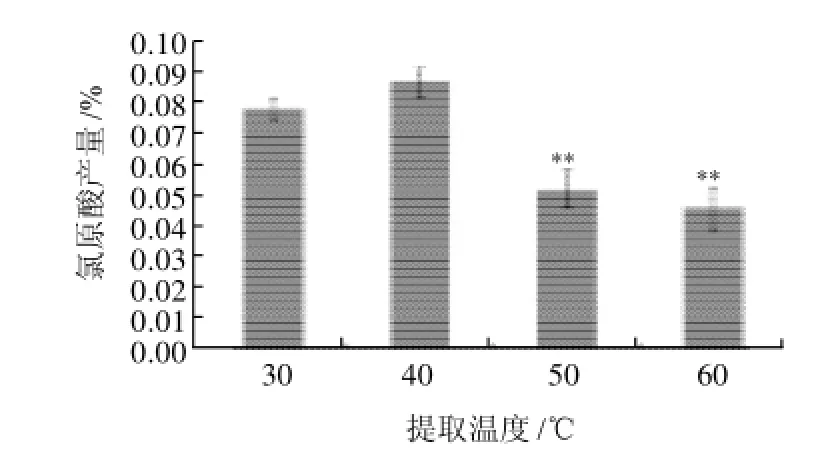
图6 浸提温度对绿原酸产率的影响Fig.6 Effect of extraction temperatures on the yield of chlorogenic acid
从图6可看出,浸提温度分别设定为30、40、50、60℃时,绿原酸产率呈现先增高后减小趋势。30℃到40℃为上升阶段,40℃时最大,从40℃到50℃迅速降低,而50℃到60℃缓慢下降。说明在40℃以下时随温度的增加产率增加,但当温度超过40℃时,温度再升高产率不仅没有增加,反而导致产率下降,这与时间因素的现象一致。方差分析显示,在1%差异水平下,50℃和60℃与40℃和30℃水平之间绿原酸产率的差异都极显著。因此为了提高提取绿原酸的效率,在40℃左右为最佳,所以正交试验时浸提温度的3个水平分别选取35、40、45℃。
2.4.4 料液比对绿原酸产率的影响

图7 液料比对绿原酸产率的影响Fig.7 Effect of liquid-to-solid ratio on the yield of chlorogenic acid
从图7可看出,料液比从1:10减小到1:20时绿原酸产率迅速增加,料液比从1:20减小到1:30时其产率缓慢增加,料液比在1:30到1:40时其产率缓慢下降。说明当料液比达到一定的比例但却未达到饱和绿原酸溶解度时,绿原酸的产率随料液比的减小而增大,料液比在1:30和1:40之间可能是绿原酸在木瓜粉细胞内外的溶解平衡区。方差分析显示,在1%差异水平下,料液比1:30、1:40、1:20各水平间的绿原酸产率的差异是极不显著的;料液比1:10与其他各水平之间的绿原酸产率的差异都是很显著的。因此为了提高提取绿原酸的效率、节省提取剂,做正交试验时料液比的3个水平分别选取为1:25、1:30、1:35。
2.5 木瓜中绿原酸的甲醇提取法正交试验
2.5.1 木瓜中绿原酸甲醇提取法正交试验极差分析

表2 甲醇提取木瓜中绿原酸产率L9(34)正交试验设计及结果Table 2 Results and analysis of the orthogonal test
由表2中各因素极差R值可知,影响木瓜中绿原酸产率的因素主次顺序为:C>B>A>D,即浸提料液比>甲醇体积分数>浸提时间>浸提温度。由正交试验极差分析还可知,其最佳组合条件为A3B2C2D2,即浸提时间14h、甲醇体积分数85%、浸提料液比1:30、浸提温度40℃。
2.5.2 木瓜中绿原酸甲醇提取法正交试验方差分析
对木瓜中绿原酸提取正交试验的方差分析结果,采用新复极差法进行方差分析(表3)。
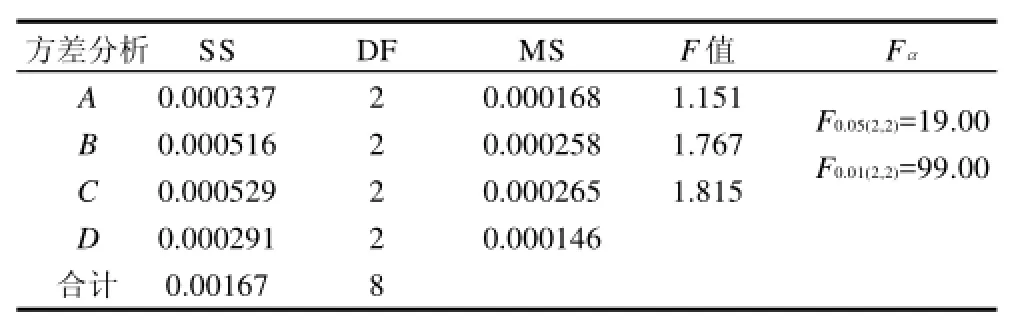
表3 甲醇提取木瓜中绿原酸产率正交试验方差分析结果Table 3 Analysis of variance
表3以D因素(影响最小)来估计其他各因素的F值,从表3结果可看出,其他因素F值均小于Fα,即4个因素影响都不显著,这说明各因素水平取值在最佳范围。从表3还可以看出,影响木瓜中绿原酸产率因素主次顺序为C>B>A,即浸提料液比>甲醇体积分数>浸提时间,这与2.5.1节中的极差分析结果相一致。
2.5.3 预期最佳组合的验证实验结果
由于最佳组合试验并没有在正交表中,所以按照最佳的试验组合A3B2C2D2进行验证实验,结果所测得的产率为(0.142±0.006)%,高于正交试验9个试验组合中任一个产率值,说明正交试验结果可靠。
2.5.4 抗菌活性检测结果
经初步纯化的绿原酸样品液对金黄色葡萄球菌的抗菌试验结果如图8A所示,对志贺氏痢疾杆菌的抗菌试验结果如图8B所示。
从图8A可以看出,绿原酸样品液对金黄色葡萄球菌具有明显的抗菌活性,而且随剂量的增大抗性增强。当绿原酸质量浓度从0.49×10-3g/mL增大到0.71×10-3g/mL时,抑菌圈从(12.0±0.3)mm增大到(16.2±0.2)mm。从图8B可以看出,绿原酸样品液对志贺氏痢疾杆菌也具有明显的抗菌活性,当绿原酸质量浓度为0.49×10-3g/ mL时,抑菌圈直径为(12.3±0.1)mm,表现出对志贺氏痢疾杆菌与对金黄色葡萄球菌相当的抗性。这个结果表明,民间使用木瓜白酒浸泡液对冶疗腹泻和肿胀的机理是因为其中含有主要活性成分绿原酸。面对当前病原菌对抗生素类药物产生了普遍的耐药性[15-16],利用我国丰富的木瓜资源开发出抗菌新药,这无疑具有广阔的前景。

图8 绿原酸样品液的抗菌活性检测结果Fig.8 Antibacterial activities of chlorogenic acid sample solution against Staphylococcus aureus and Shigella dysenteria
3 结 论
3.1 本实验首次从光皮木瓜中提取出绿原酸,通过数据分析可知,甲醇提取法在试验范围内各因素对绿原酸产率影响作用的大小依次为浸提料液比>甲醇体积分数>浸提时间>浸提温度。
3.2 甲醇提取法提取木瓜中绿原酸的最佳工艺参数是:以体积分数85%甲醇溶液为浸提溶剂,以浸提料液比1:30(g/mL)在40℃浸提14h后得到绿原酸的最高产率为0.142%。
3.3 绿原酸样品液对引起炎症的金黄色葡萄球菌和对引起腹泻的志贺氏痢疾杆菌具有明显的抗性。该结果表明民间木瓜白酒浸泡液的主要药理活性成分为绿原酸。
[1]VIVIANE M, ADRIANA F. Chlorogenic acids and related compounds in medicinal plants and infusions[J]. Food Chemistry, 2009, 113: 1370-1376.
[2]ZHANG Lunyi, COSMA G, GARDNER H, et al. Effect of chlorogenic acid on hydroxyl radical[J]. Mol Cell Biochem 2003, 247: 205-210.
[3]NARDINI M, CIRILLO E, NATELLA F, et al. Absorption of phenolic acids in humans after coffee consumption[J]. J Agric Food Chem, 2002, 50: 5735-5741.
[4]ZHAO Zhaohui, SHIN HS, SATSU H, et al. 5-Caffeoylquinic acid and caffeic acid down-regulate the oxidative stress- and TNF-α-induced secretion of interleukin-8 from Caco-2 cells[J]. J Agric Food Chem, 2008, 56: 3863-3868.
[5]YANG B, MENG Z Y, YAN L P, et al. Pharmacokinetics and metabolism of 1,5-dicaffeoylquinic acid in rats following a single intravenous administration[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 40: 417-422.
[6]FEDERICA P, STEFANIA B, LARA M, et al. Analysis of phenolic compounds and radical scavenging activity of Echinacea spp.[J]. Pharmaceutical and Biomedical Analysis, 2004, 35: 289-301.
[7]DONATA B, MICHAEL M, WERNER P, et al. Detection and activity evaluation of radical scavenging compounds by using DPPH free radical and on-line HPLC-DPPH methods[J]. Eur Food Res Technol, 2002, 214: 143-147.
[8]LI Shuyuan, CHANG Cuiqing, MA Fuying, et al. Modulating effects of chlorogenic acid on lipids and glucose metabolism and expression of hepatic peroxisome proliferator-activated receptor-α in golden hamsters fed on high fat diet[J]. Biomedical and Environmental Sciences, 2009, 22: 122-129.
[9]FARAH A, DONANGELO C M. Phenolic compounds in coffee[J]. Brazilian Journal of Plant Physiology, 2006, 18: 23-36.
[10]WANG Guifeng, SHI Liping, REN Yudan, et al. Anti-hepatitis B virus activity of chlorogenic acid, quinic acid and caffeic acid in vivo and in vitro[J]. Antiviral Research, 2009, 83: 186-190.
[11]CLIFFORD W B, MAMDOUH M A, ADRIENNE L E K, et al. A flavanone and two phenolic acids from Chrysanthemum morifolium with phytotoxic and insect growth regulating activity[J]. Journal of Chemical Ecology, 2004, 30(3): 589-606.
[12]TRAN M H, MINKYUN N, PHUONG T T, et al. Antioxidant activity of caffeoyl quinic acid derivatives from the roots of Dipsacus asper Wall [J]. Journal of Ethnopharmacology, 2006, 108: 188-192.
[13]李琼, 刘乐全, 徐怀德, 等. 光皮木瓜中有机酸成分研究[J]. 西北农业学报, 2008, 17(1): 207-210.
[14]张冬松, 高慧媛, 吴立军. 光皮木瓜的化学成分药理活性及临床研究进展[J]. 沈阳药科大学学报, 2007, 24(11): 721-726.
[15]RUUD H D, ELLEN E S. The evolution of Staphylococcus aureus[J]. Infection, Genetics and Evolution, 2008, 8: 747-763.
[16]RAYMOND B, MARIE D, CARLOS R, et al. Molecular epidemiology of multidrug-resistant Shigella dysenteriae type 1 causing dysentery outbreaks in Central African Republic, 2003-2004[J]. Transactions of the Royal Society of Tropical Medicine and Hygiene, 2006, 100: 1151-1158.
Extraction of Chlorogenic Acid from Fruit of Chaenomeles sinensis Koehne and Evaluation of Its Antibacterial Activity
HU Zhong-qiu,HONG Xiao-di,YUE Tian-li
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Chlorogenic acid was extracted from the fruit of Chaenomeles sinensis Koehne using methanol as solvent. Effects of four extraction variables (methanol concentration, extraction temperature, solid/liquid ratio and extraction time) on yield of chlorogenic acid were investigated by conducting single factor test. Subsequently, a L9(34) orthogonal test was employed to optimize the extraction conditions. In the following, the anti-Shigella dysenteriae and Staphylococcus aureus activities were evaluated by using inhibition zone test. Results showed the optimum extractions conditions were as follows: aqueous methanol concentration 85%, the solid/liquid ratio 1:30 (C. sinensis Koehne powder(g)/aqueous methanol (mL)), extraction at 40 ℃ for 14 hours. Under the optimum conditions, the yield of chlorogenic acid were 0.142%. The antibacterial activity of chlorogenic acid samples against S. dysenteriae and S. aureus was significant. It indicated that chlorogenic acid may be a main pharmacological compound of a folk medicine of white spirit soaked with C. sinensis Koehne.
Chaenomeles sinensis Koehne;chlorogenic acid;extraction and optimization;antibacterial activity;Shigella dysenteriae;Staphylococcus aureus.
S646
A
1002-6630(2010)24-0008-06
2010-02-06
“十一五”国家科技支撑计划项目(2006BAK02A24)
*通信作者:胡仲秋(1969—),男,讲师,博士,研究方向为天然产物提取。E-mail:hutiger-2005@126.com

