不同中和剂对米根霉发酵产L-乳酸的影响
姜绍通,张巧兰,吴学凤,罗水忠,潘丽军
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
不同中和剂对米根霉发酵产L-乳酸的影响
姜绍通,张巧兰,吴学凤,罗水忠,潘丽军
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
在米根霉发酵产L-乳酸过程中,采用CaCO3作为中和剂会造成下游分离过程中膜堵塞和环保压力,因此以NH3·H2O和NaOH替代CaCO3作中和剂,对米根霉发酵产L-乳酸的工艺条件和发酵动力学进行研究。结果表明:添加CaCO3后L-乳酸产量平均提高7.3倍;NaOH、NH3·H2O作为中和剂的最佳浓度及质量分数分别为10mol/L、25%,以该条件进行发酵72h得菌丝体小球直径分别为0.2~1.2mm和1.2~2.2mm,残糖含量分别为2.58g/L和1.37g/L,L-乳酸产量分别为74.34g/L和80.61g/L。
米根霉;L-乳酸;中和剂;发酵动力学
L-乳酸是一种重要的天然有机酸,广泛应用于食品、医药、生物降解塑料等领域[1-3]。自然界中可产生L-乳酸的微生物有很多,但米根霉因其营养要求简单,产酸能力强且产品的光学纯度高而被普遍应用于工业生产[4-6]。在L-乳酸的发酵过程中,发酵生成的L-乳酸可以作为一种解偶联剂,使质子从培养基中进入细胞的质子泵。在这种情况下,细胞的生长和L-乳酸的生成都会随着终产物L-乳酸的积累受到抑制。因此,发酵过程中培养基的pH值和发酵产生的游离L-乳酸都会对米根霉菌体的生长和产物L-乳酸的生成带来影响[7-8]。在传统的L-乳酸发酵工艺中,CaCO3是使用最为普遍的酸中和剂[8-9]。但使用CaCO3作为中和剂时,发酵罐中大量的CaCO3容易使取料口堵塞;在菌体生长过程中,容易产生米根霉菌体包埋现象;在发酵中后期,高浓度的乳酸钙使发酵液变得黏稠,生成大量泡沫,造成跑料,易染菌[10];或发生固化现象,使发酵难以继续。另外,使用CaCO3作为中和剂时,发酵液的主要成分是粗乳酸钙,在L-乳酸的下游分离提取过程中,产生的大量硫酸钙不仅在过滤中会造成膜堵塞,造成乳酸损失,而且产生的大量硫酸钙废渣会造成严重的环保压力和废渣处理成本,不利于L-乳酸大规模生产的可持续发展[11-12]。因此,寻求新型中和剂代替传统的CaCO3中和剂具有十分重要的现实意义,受到乳酸生产商和研究者的高度关注。本实验通过以NaOH和NH3·H2O替代CaCO3作为米根霉发酵产L-乳酸的中和剂,以L-乳酸产量为指标,对Ca2+添加量、菌体形态、中和剂最适浓度和发酵动力学进行研究。
1 材料与方法
1.1 材料
1.1.1 菌种
米根霉AS3.819为合肥工业大学生物与食品工程学院发酵实验室保藏菌种。
1.1.2 培养基
菌种保藏斜面培养基:马铃薯葡萄糖培养基(PDA);以NaOH作为中和剂发酵培养基(g/L):葡萄糖120、 (NH4)2SO44.0、MgSO4·7H2O 0.35、ZnSO4· 7H2O 0.22、NaH2PO40.10、KH2PO40.15;以NH3· H2O作为中和剂发酵培养基(g/L):葡萄糖 120、 (NH4)2SO41.0、MgSO4·7H2O 0.35、ZnSO4·7H2O 0.22、NaH2PO40.15、KH2PO40.15。
1.2 方法
1.2.1 摇瓶发酵
250mL三角瓶中装液量50mL,121℃灭菌15min,接种1mL孢子悬液(5×106个/mL),200r/min摇床上32℃振荡培养72h。
1.2.27 L发酵罐发酵
7L发酵罐中装液量5L,通气量6L/min,搅拌转速300r/min,pH值:分别流加NaOH、NH3·H2O溶液均保持pH值在5.5左右,32℃下培养72h。
1.3 检测方法
L-乳酸产量测定:HPLC法[13];还原糖含量测定:3,5-二硝基水杨酸(DNS法);生物量测定:菌体干质量法[14]。
2 结果与分析
2.1 Ca2+添加量的影响
Ca2+在菌丝体的生长和菌丝球的形成过程中起着非常重要的作用。分别以NaOH、NH3·H2O作为中和剂,在发酵培养基中加入不同量的CaCO3和CaCl2进行摇瓶实验,结果如图1~4所示。
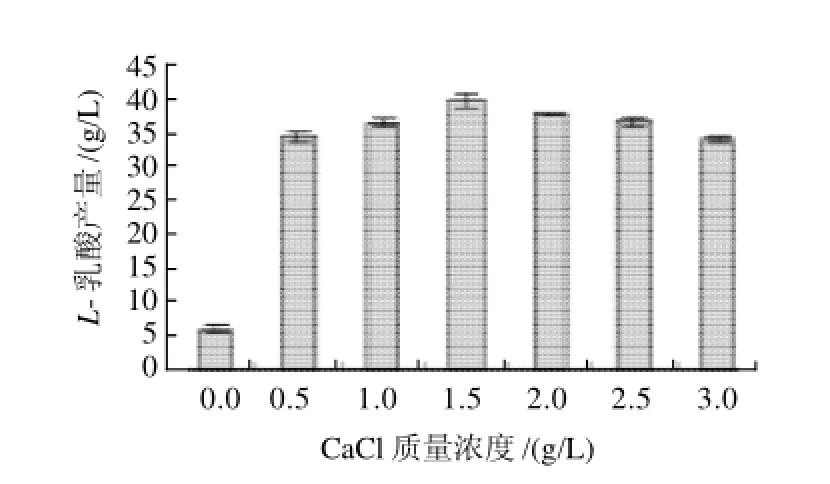
图1 NaOH作中和剂CaCl2质量浓度对L-乳酸产量的影响Fig.1 Effect of CaCl2concentration onL-lactic acid production with NaOH as the neutralizer
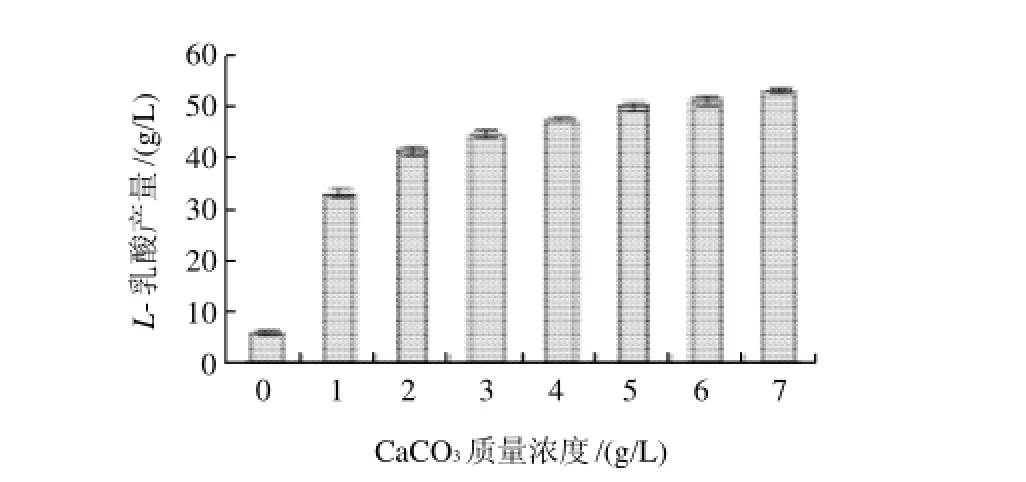
图2 NaOH作中和剂CaCO3质量浓度对L-乳酸产量的影响Fig.2 Effect of CaCO3concentration onL-lactic acid production with NaOH as the neutralizer
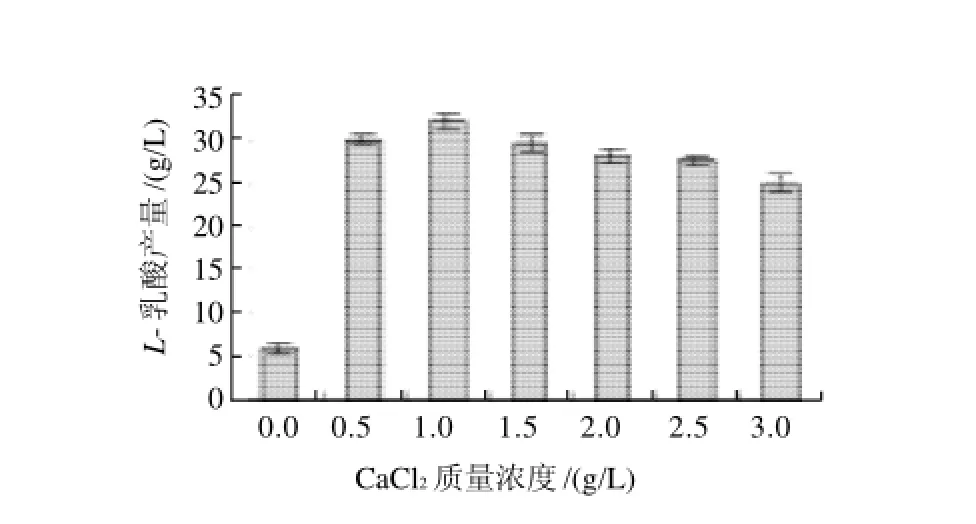
图3 NH3·H2O作中和剂CaCl2质量浓度对L-乳酸产量的影响Fig.3 Effect of CaCl2concentration onL-lactic acid production with NH3·H2O as the neutralizer
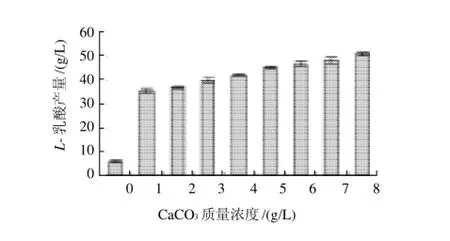
图4 NH3·H2O作中和剂CaCO3质量浓度对L-乳酸产量的影响Fig.4 Effect of CaCO3concentration onL-lactic acid production with NH3·H2O as the neutralizer
由图1、3可知,添加Ca2+后L-乳酸产量显著提高。随着CaCl2质量浓度增加,L-乳酸产量先上升后下降,可能是高质量浓度的Cl-对菌体有毒害作用,因此不采用CaCl2;由图2、4可知,随着CaCO3质量浓度增加,L-乳酸产量不断提高,参照最佳CaCl2最佳质量浓度,选用2g/L CaCO3,因CaCO3易在发酵罐中沉淀,无法完全利用,可适当增加CaCO3用量。如图1、2所示,以NaOH作为中和剂时,添加CaCO3和CaCl2后L-乳酸最大产量分别是未添加Ca2+的8.8倍和6.6倍。如图3、4所示,以NH3·H2O作为中和剂时,添加CaCO3和CaCl2后L-乳酸最大产量分别是未添加Ca2+的8.5倍和5.3倍。
2.2 中和剂质量浓度对L-乳酸产量及L-乳酸/葡萄糖总得率的影响
2.2.1 NaOH浓度对L-乳酸产量及L-乳酸/葡萄糖总得率的影响
在7L发酵罐中对NaOH浓度进行优化,且由于低产量NaOH溶液和高浓度NaOH溶液加入的量不同使最终L-乳酸浓度产生差别,因此将发酵完成时的发酵罐总体积内L-乳酸的质量与初始葡萄糖质量进行对比得出L-乳酸/葡萄糖总得率,结果如图5所示。
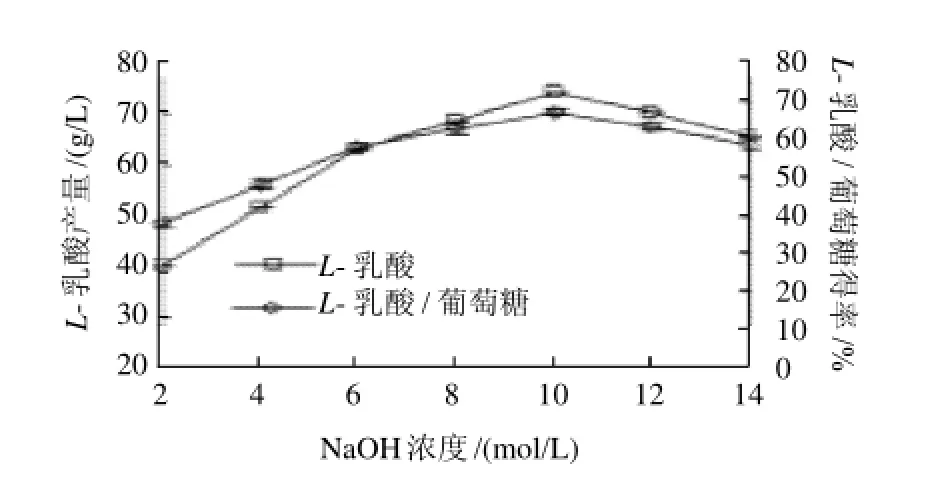
图5 NaOH浓度对L-乳酸产量及L-乳酸/葡萄糖得率的影响Fig.5 Effect of NaOH concentration onL-lactic acid production and the ratio ofL-lactic acid production to initial glucose amount
由图5可知,在2~10mol/L范围内,L-乳酸产量随着NaOH浓度增大而增多,L-乳酸/葡萄糖得率也不断增加;而超过10mol/L时L-乳酸产量下降,可能是随着NaOH浓度的增加,碱性增强,流加时发酵罐内局部碱性很大,对菌体的毒害作用增强,导致部分菌体死亡,有效菌体量减少,从而使L-乳酸产量相应减少,L-乳酸/葡萄糖得率也下降,因此选择10mol/L为最佳浓度,在此浓度下L-乳酸产量为74.34g/L。
2.2.2 NH3·H2O质量分数对L-乳酸产量及L-乳酸/葡萄糖总得率的影响
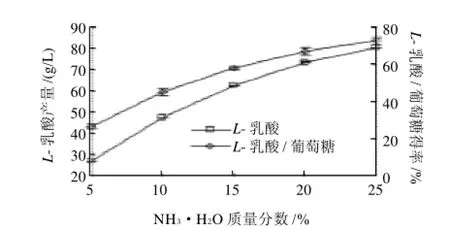
图6 NH3·H2O质量分数对L-乳酸产量及L-乳酸/葡萄糖得率的影响Fig.6 Effect of NH3·H2O concentration onL-lactic acid production and the ratio ofL-lactic acid production to initial glucose amount
在7L发酵罐中对NH3·H2O质量分数进行优化,且由于低质量分数NH3·H2O和高质量分数NH3·H2O加入的量不同使最终L-乳酸产量产生差别,因此将发酵完成时的发酵罐总体积内L-乳酸的质量与初始葡萄糖质量进行对比得出L-乳酸/葡萄糖总得率,结果见图6。
由图6可知,随着NH3·H2O质量分数的增大,L-乳酸产量不断上升,L-乳酸/葡萄糖得率也不断增加,分析原因可能是因为NH3·H2O不仅能中和发酵产生的L-乳酸,还可以作为氮源促进米根霉菌体的生长,L-乳酸的产生导致发酵罐内p H值下降,NH3·H2O流加进入发酵罐,发酵液中NH4+浓度不断增加,NH4+一部分作为氮源供米根霉菌体生长所用,一部分中和L-乳酸产生L-乳酸铵,因此NH3·H2O可能是米根霉发酵产L-乳酸比较理想的中和剂。由于市面所售NH3·H2O最高质量分数为25%,因此选择25% NH3·H2O,此质量浓度下L-乳酸产量为80.61g/L。
2.3 不同中和剂的菌体形态
分别使用10mol/L NaOH和25% NH3·H2O作为米根霉发酵产L-乳酸的中和剂,在7L发酵罐中发酵7 2 h,发酵液澄清透明,米根霉菌体形成菌丝体小球,无任何碳酸钙包埋现象,其中以N H3·H2O作为中和剂时,米根霉的菌体形态较为合适,NaOH作为中和剂时菌球偏小,如表1所示。发酵初期的前24h,米根霉菌体呈絮状,24h后开始形成菌丝体小球,到发酵终点时菌体丝小球直径分别为0.2~1.2mm和1.2~2.2mm,发酵终点米根霉菌丝体小球形态如图7、8所示。

表1 中和剂对米根霉菌丝体生长的影响Table 1 Effect of neutralizers on mycelial growth ofRhizopus oryzae
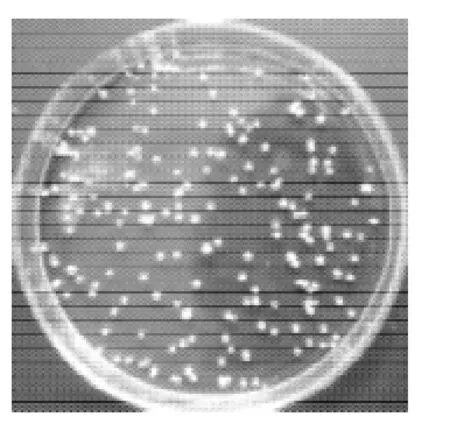
图7 NaOH作为中和剂时的菌球形态Fig.7 Mycelial pellets ofRhizopus oryzaewith NaOH as the neutralizer
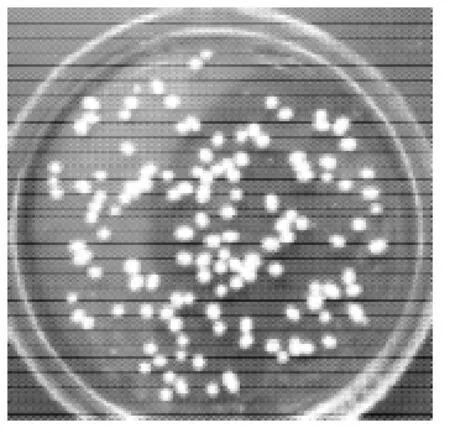
图8 NH3·H2O作为中和剂时的菌球形态Fig.8 Mycelial pellets ofRhizopus oryzaewith NH3·H2O as the neutralizer
2.4 不同中和剂的发酵动力学
2.4.1 以10mol/LNaOH作为中和剂时发酵动力学曲线
测定发酵液中的米根霉生物量、葡萄糖质量浓度和L-乳酸质量浓度,得出以10mol/L NaOH作为米根霉发酵产L-乳酸中和剂的动力学,结果如图9所示。
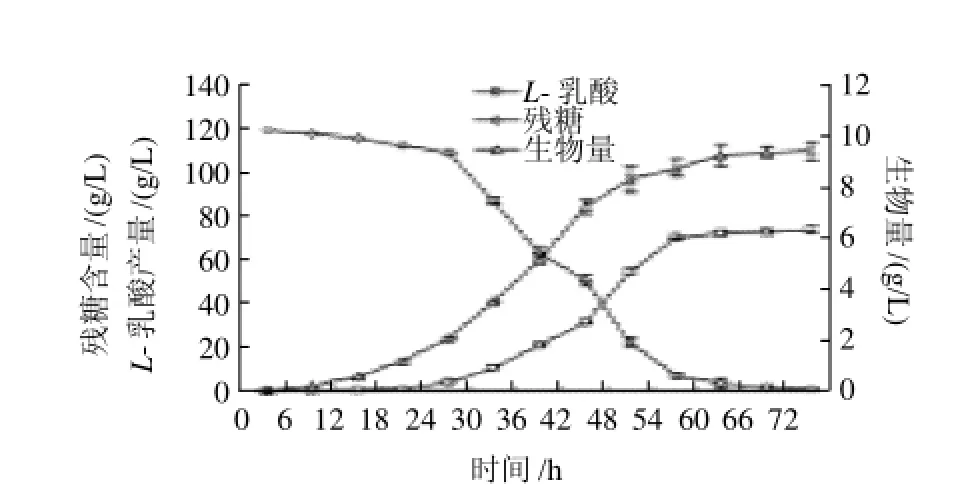
图9 以NaOH作为中和剂的发酵动力学曲线Fig.9 Fermentation kinetic curve with NaOH as the neutralizer
由图9可知,米根霉菌体的生长曲线和L-乳酸的生成曲线都呈S形。发酵初期0~24h,以菌体的生长为主,产酸很少,葡萄糖消耗速度缓慢。24h后进入产酸旺盛期,L-乳酸的合成与米根霉菌体的生长同步,L-乳酸产量增加的趋势与米根霉菌丝体增长的趋势基本一致,葡萄糖的消耗速度加快。54h后菌丝体含量变化不大,耗糖速度和产酸均变缓慢,发酵进入稳定期,72h发酵结束,L-乳酸的产量达到峰值。
2.4.2 以25% NH3·H2O作为中和剂时的发酵动力学曲线
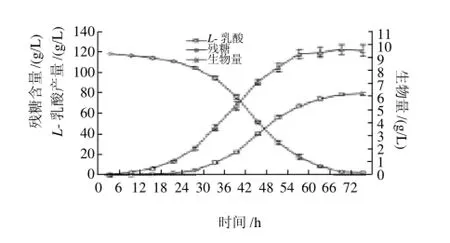
图10 以NH3·H2O作为中和剂的发酵动力学曲线Fig.10 Fermentation kinetic curve with NH3·H2O as the neutralizer
测定发酵液中的米根霉生物量、葡萄糖质量浓度和L-乳酸质量浓度,研究以25%NH3·H2O作为米根霉发酵产L-乳酸中和剂的菌体生长、糖代谢和产酸动力学,结果如图10所示。
由图10可知,米根霉菌体的生长曲线和L-乳酸的生成曲线都呈S形,葡萄糖消耗曲线呈反S形。发酵初期12h,菌体生长缓慢,菌丝体含量与L-乳酸产量很少。24~60h进入米根霉生长与L-乳酸生产旺盛期,菌体迅速生长,葡萄糖的消耗速度加快,L-乳酸产量也随之迅速增加。60h后进入稳定期,L-乳酸增加缓慢,72h发酵结束,L-乳酸产量达最高值。
3 结 论
本研究利用NaOH和NH3·H2O作为米根霉发酵产L-乳酸的中和剂,通过Ca2+添加量、菌体形态、中和剂最佳浓度、动力学测定研究得出:Ca2+在米根霉菌体生长过程中起非常重要的作用,其中CaCO3优于CaCl2,添加了CaCO3后L-乳酸产量平均提高7.3倍;NH3·H2O、NaOH作为米根霉发酵产L-乳酸中和剂的最佳浓度及质量分数分别为25%和10mol/L,在最佳质量浓度下进行7L罐发酵72h,残糖量分别达到2.58g/L和1.37g/L,L-乳酸产量分别达到74.34g/L和80.61g/L。
[1]RATHIN D. Hydroxycarboxylic acids[J]. Encyclopedia of Chemical Technology, 1995, 13: 1042-1062.
[2]RATHIN D. The technology and economy potential of poly (lactic acid) and its ramification[J]. FEMS Microbiology Reviews, 1995, 16: 221-231.
[3]白冬梅, 赵学明, 李鑫钢, 等. 米根霉发酵生产L-(+)-乳酸研究进展[J]. 现代化工, 2002, 22(6): 9-12.
[4]王博彦, 金其荣. 发酵有机酸生产与应用手册[M]. 北京: 中国轻工业出版社, 2007: 337-389.
[5]王蓉, 王远亮, 陈国平, 等. 米根霉发酵生产L(+)-乳酸研究进展[J].重庆大学学报: 自然科学版, 2004(12): 95-97.
[6]赵宏宇, 赵靖, 郑春丽, 等. 米根霉乳酸发酵的研究进展[J]. 天津化工, 2007(1): 7-9.
[7]闫征, 王昌禄, 顾晓波. pH值对乳酸菌生长和乳酸产量的影响[J]. 食品与发酵工业, 2002(6): 35-38.
[8]徐国谦, 储炬, 王永红, 等. 不同的中和剂对L(+)-乳酸发酵的影响[J]. 工业微生物学, 2007(4): 1-5.
[9]闫智慧, 白冬梅, 高静, 等. 氨水中和Lactobacillus delbrueckii subsp. Lactis BME5-18M发酵生成L-乳酸铵的研究[J]. 微生物学通报, 2004 (4): 31-33.
[10]匡群, 孙梅, 施大林, 等. 耐氨米根霉发酵生产L-乳酸的研究[J].生物技术, 2005(4): 65-67.
[11]MIURA S, DWIARTI L, ARIMUR T, et al. Enhanced production of L-lactic acid by mmonia-tolerant mutant strain Rhizopus sp. MK-96-1196 [J]. Journal of Bioscience and Bioengineering, 2004(1): 19-23.
[12]LI Xingang, XU Shimin. Ammonium lactate production by Lactobacillus lactis BME5-18M in pH-controlled fed-batch fermentations[J]. Biochemical Engineering Journal, 2004, 19(1): 47-51.
[13]郑志, 姜绍通, 潘丽军, 等. 反相高效液相色谱法测定发酵液中乳酸的含量[J]. 食品科学, 2003, 24(12): 89-91.
[14]贾士儒. 生物工艺与工程实验技术[M]. 中国北京: 轻工业出版社, 2002: 1-4.
Effect of Different Neutralizers on L-Lactic Acid Production by Rhizopus oryzae
JIANG Shao-tong,ZHANG Qiao-lan*,WU Xue-feng,LUO Shui-zhong,PAN Li-jun
(Key Laboratory for Agricultural Products Processing of Anhui Province, School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Calcium carbonate added as the neutralizer during Rhizopus oryzae fermentation for L-lactic acid production would cause membrane fouling and environmental pressure during the downstream separation. As a consequence, ammonia and sodium hydroxide were separately used as a substitute for calcium carbonate in this study, and the fermentation conditions for L-lactic acid production and the fermentation kinetics were dealt with. Added calcium carbonate during during Rhizopus oryzae fermentation resulted in an average 7.3-fold increase in L-lactic acid production. The optimal concentrations of added ammonia and sodium hydroxide were 10 mol/L and 25%, respectively. Mycelial pellets in diameter ranges between 0.2 mm and 1.2 mm and between 1.2 mm and 2.2 mm were formed after 72 h fermentation under these concentration conditions, and the residual sugar amounts were 2.58 g/L and 1.37 g/L and the L-lactic acid concentrations in the fermentation broths were 74.34 g/L and 80.61 g/L, respectively.
Rhizopus oryzae;L-lactic acid;neutralizer;fermentation kinetics
TQ921.3
A
1002-6630(2010)23-0114-04
2009-12-22
国家“863”计划项目(2007AA10Z361);安徽省自然科学基金项目(090411015)
姜绍通(1954—),男,教授,主要从事农产品生物化工研究。E-mail:jiangshaotong@yahoo.com.cn

