阿托伐他汀对单侧输尿管梗阻大鼠肾小管间质纤维化的保护作用
张国欣 薛兰芬 聂丽敏 王蕾 潘志兰 许静
肾间质纤维化是多种肾脏疾病的共同特征,是进展至终末期肾病的共同通路[1]。本实验通过单侧输尿管结扎术建立肾间质纤维化动物模型,并进行药物干预,通过免疫组织化学、病理组织学检查等方法检查肝细胞生长因子(HGF)在肾小管间质的表达情况及用药后的变化,进一步了解他汀类药物的肾保护作用机制,为肾间质纤维化的防治提供理论依据。
1 材料与方法
1.1 药品与试剂 阿托伐他汀钙片(立普妥,进口注册证号:H2030119,10 mg/片,Godeck GmbH生产,辉瑞制药有限公司分装)。兔抗大鼠HGF多克隆抗体。SP免疫组化试剂盒。以上均购自北京中山生物技术有限公司。
1.2 实验方法
1.2.1 实验动物与分组:清洁级健康雄性 Wistar大鼠54只(购自河北医科大学动物实验中心),体重180~220 g。适应性饲养1周后,随机分为假手术组(A组)、模型组(B组)、阿托伐他汀治疗组(C组),每组18只。每组又因于术后第3、7、14天分批处死而分为N3、N7、N14组,每组6只。
1.2.2 动物模型建立:术前空腹12 h,予 2%戊巴比妥钠(50 mg/kg)经腹腔注射麻醉后。下腹正中切口2.5 cm暴露左侧肾脏,分离左侧输尿管,于中上1/3处结扎并剪断,使左肾完全梗阻,后逐层缝合。A组开腹后只游离输尿管,不结扎。
1.2.3 给药方法:于术前3 d开始灌胃。C组给予阿托伐他汀(10 mg·kg-1·d-1,溶于 0.9% 氯化钠溶液,制成混悬液),A组及B组给予等量0.9%氯化钠溶液灌胃。实验期间大鼠自由进食水。
1.2.4 标本收集与制备:分别于术后第3、7、14天断头处死。留取血标本2 ml,检测血清总胆固醇(TC)。迅速切取左肾,去除包膜,按冠状位纵行剖开,置于10%中性甲醛中固定。48 h后行石蜡包埋,将肾组织切成5μm切片,行HE、Masson及免疫组织化学染色。
1.2.5 生化检查:血标本采用日本Olympus AU-2700全自动生化分析仪测定血TC。
1.3 病理检查
1.3.1 组织固定、脱水、渗蜡、包埋:组织块置于10%中性甲醛中,固定48 h,不同浓度的乙醇梯度脱水各2 h,其中95%2次,无水乙醇脱水3次,各30 min。二甲苯脱乙醇3次,各30 min。石蜡浸入3次,分别为30 min、30 min、1 h。石蜡冷却包埋。
1.3.2 载玻片的处理:载玻片经硫酸洗液浸泡24 h以上,95%乙醇浸泡24 h,蒸馏水洗3~5次,将载玻片整齐排好,在烤箱中烤干。用纯丙酮以1:150稀释粘合剂 APES,将载玻片浸入其中1~2 min,取出低温(37℃)烤干。
1.3.3 切片:应用切片机,厚度为5μm,切片后于37℃恒温箱中过夜。
1.3.4 石蜡切片脱蜡至水:二甲苯脱石蜡2次,各15 min,无水乙醇浸入2次,各10min,95%、80%、70%、60%、50%乙醇浸入各2 min,自来水、蒸馏水反复冲洗。
1.3.5 HE染色:脱蜡至水的切片浸入苏木素3 min,水洗。1%盐酸乙醇分化片刻,水洗。1%氨水溶液蓝化片刻,水洗。0.5%伊红乙醇浸染3 min。70%乙醇1 min,取出甩干,80%乙醇1min,取出甩干,95%乙醇1 min,3个无水乙醇各2 min,3个二甲苯各2 min。最后树胶封片。
1.3.6 Masson染色:切片常规脱蜡至水(同HE染色),置于丽春红染液2 min,入2%冰醋酸水溶液2 min,入5%磷钼酸水溶液煤染2 min,再入2%冰醋酸水溶液2 min,甲基绿染色3 min,自来水冲洗。95%乙醇分色,梯度乙醇脱水,二甲苯透明,中性树胶封片。
绿色为胶原纤维,在高倍镜(×200)下随即选择15个不含肾小球及血管的肾皮质视野,以肾间质面积占一个视野场面积的百分比作为相对间质容积值。
1.3.7 免疫组织化学染色(采用SP法):①5μm石蜡切片常规脱蜡至水(同HE染色)。②新鲜配置的3%H2O2孵育10~15 min,以消除内源性过氧化物酶的活性。③蒸馏水冲洗3次,画蜡边。④抗原修复,采用水煮法。切片放入盛有抗原修复液(0.1 mol/L 的 PBS,pH 值 7.2 ~7.4)的小烧杯中,并将烧杯置于盛有自来水的大烧杯中,电炉上加热煮沸。从小烧杯的温度到达98~99℃起开始计时20 min。⑤用1%BSA(小牛血清白蛋白)封闭,室温孵育10~15 min(封闭组织内电荷),倾去血清,勿洗。⑥滴加1/50稀释的一抗,4℃过夜。⑦PBS冲洗5 min,3遍。⑧滴加生物素标记的二抗,37℃孵育60 min。⑨PBS冲洗 5 min,3遍。⑩滴加 SP复合物,37℃孵育 30~40 min。〇11PBS 冲洗 5 min,3 遍。〇12显色:PBS 4 m l、DAB 5 g、H2O25μl,显色5 min左右(以镜下适度为好)。〇13自来水冲洗5次。〇14苏木素复染1 min,水洗,1%盐酸酒精分化,脱水、二甲苯透明、中性树胶封片。
采用1%BSA代替一抗的组织切片作为阴性对照,已知阳性标本作为阳性对照。光镜下阳性反应部位为棕黄色。应用真彩色医学图像分析系统通过光学显微镜摄入图像,放大200倍,每例切片随机选取15个不含肾小球和小血管的肾皮质视野,测定阳性着色部位的总积分光密度值,并取其平均值为肾小管间质 ICAM-1、P-选择素、NF-κB、ColⅢ表达的阳性面积与着色强度综合评价指标。
1.4 统计学分析应用SPSS10.0统计软件,计量资料以¯x±s表示,组间比较采用单因素方差分析,组内比较采用t检验,对数据进行相关分析并对相关系数r进行显著性t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TC的变化 C组单侧输尿管梗阻(UUO)大鼠在阿托伐他汀的干预下,TC的变化与A组及B组比较差异均无统计学意义(P >0.05)。见表1。
表1 3组总胆固醇水平比较n=6,mmol/L,±s
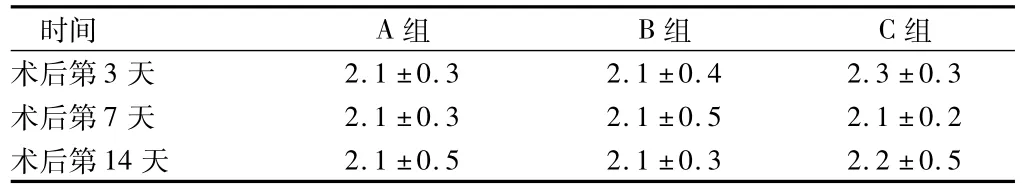
表1 3组总胆固醇水平比较n=6,mmol/L,±s
时间 A组 B组 C组2.1 ±0.3 2.1 ±0.4 2.3 ±0.3术后第7 天 2.1 ±0.3 2.1 ±0.5 2.1 ±0.2术后第14天术后第3天2.1 ±0.5 2.1 ±0.3 2.2 ±0.5
2.2 肾组织形态学改变 经HE、Masson染色,光镜下观察A组从第3天到第14天肾组织未见明显病理改变。B组术后第3天开始出现肾间质水肿、单核细胞浸润,远端肾小管上皮细胞扁平、肾间质增宽的特征,肾小球未见明显异常;术后第7天肾小管明显扩张,肾间质大量炎性细胞浸润,管腔内可见脱落的上皮细胞,偶见萎缩的肾小管;术后第14天梗阻侧肾脏肉眼观察:肾脏体积增大,颜色灰白,内有浑浊的尿液,肾皮质变薄,光镜下可见弥漫的肾小管基底膜增厚皱缩,小管基底膜不同程度断裂,皮质及外髓萎缩的肾小管较多,间质中大量淋巴单核细胞浸润,纤维化明显,偶见肾小球硬化。C组与B组平行相比肾小管间质病变程度明显减轻,肾间质相对面积明显减少(P<0.05)。3组比较差异有统计学意义(P <0.05)。见表2。
表2 3组肾间质纤维化结果半定量分析n=6,±s
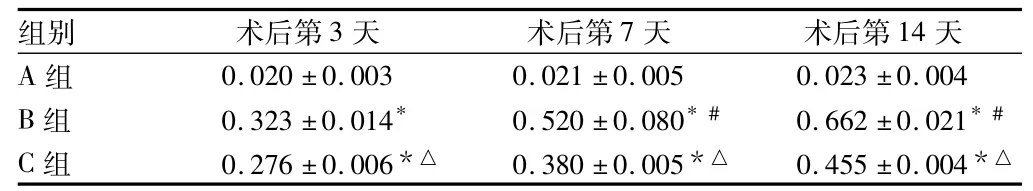
表2 3组肾间质纤维化结果半定量分析n=6,±s
注:与A组比较,*P <0.05;与术后3 d比较,#P <0.05;与B组比较,△P<0.05
组别 术后第3天 术后第7天 术后第14天A组0.020 ±0.003 0.021 ±0.005 0.023 ±0.004 B 组 0.323 ±0.014* 0.520 ±0.080*# 0.662 ±0.021*#C 组 0.276 ±0.006*△ 0.380 ±0.005*△ 0.455 ±0.004*△
2.3 免疫组化结果 HGF在肾小管间质A组各时期均几乎无表达。在B组、C组主要表达于肾小管上皮细胞,肾间质有少量表达,3 d时HGF表达较正常轻度增高,7 d时表达至高峰,14 d时表达减少(P<0.05)。C组与B组同时相点比较,HGF的表达均增高,组间、组内差异均有统计学意义(P<0.05)。见表 3。
表3 3组HGF免疫组化结果n=6±s

表3 3组HGF免疫组化结果n=6±s
注:与A组比较,*P <0.05;与术后3 d比较,#P <0.05;与B组比较,△P <0.05
组别 术后第3天 术后第7天 术后第14天A组29±5 26±9 30±7 B组 42±10* 125±7*△ 35±8*△C组 51±10*# 144±13*# 52±6*#
3 讨论
近年来他汀类药物的非依赖降脂的肾保护作用被不断发现,Yamasthita等[2]研究表明,西立伐他汀通过抑制肾纤维化,降低尿蛋白来延缓由高血压诱导的肾损害。Jandeleit-Dahm等[3]给予5/6肾切除大鼠阿托伐他汀治疗12周,在未影响血脂和肾功能的情况下,发现大鼠尿蛋白减少,肾组织中TGF-β基因表达下调,肾小球及肾小管中单核巨噬细胞浸润减轻。
肾小管间质纤维化是慢性肾脏疾病发展的共同结局。大量形态学定量分析认为它是决定预后的重要因素,其病理过程起初是炎症期,以淋巴、单核细胞为主的炎细胞浸润,肾小管变性损伤,继而肾间质中的成纤维细胞活化,产生大量基质蛋白,间质纤维化[4]。HGF作为近期研究最热的抑制纤维化因子,在肾脏中作用靶点较多,其可与TGF-β1的互逆作用,进而达到抑制肾小管上皮细胞转分化(EMT)[5]。本实验即采用UUO大鼠造成肾间质纤维化,模拟人体内的纤维化过程,研究阿托伐他丁对肾脏的保护作用。UUO术后第3天,肾小管开始扩张,即可观察到HGF表达增加术后第7天,肾小管明显扩张,HGF表达明显增加到术后第14天,HGF表达均明显下降,并伴有细胞外基质(ECM)大量沉积,肾小管萎缩,刷状缘脱落,而肾小球基本未受影响。治疗组较对照组HGF表达增强。
本实验研究结果表明HGF在肾间质纤维化的发生、发展中起着重要的作用。在UUO模型中HGF表达显著增高,抑制了肾间质纤维化,阿托伐他汀促进了HGF的高表达,减轻肾间质炎性细胞浸润及肾间质纤维化,对肾脏有一定的保护作用。阿托伐他汀对HGF的抑制作用是独立于降脂之外的。
1 Wynn TA.Cellular and molecularmechanisms of fibrosis.The Journal of Pathology,2007,214:199-210.
2 Yamashita T,Kawashima S,Miwa Y,et al.A 3-hydroxy-3-methylglutarylco-enzyme A reductase inhibitor reduces hypertensive nephrosclerosis in stroke-prone spontaneously hypertensive rats.JHypertens,2002,20:2465-2473.
3 Jandeleit-Dahm K,Cao Z,Cox AJ,et al.Role of hyperlipidemia in progressive renal disease:focus on diabetic nephropathy.Kidney Int,1999,56(Suppl 71):S31-64.
4 Yang L,Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis.JAm Soc Nephrol,2002,13:96-107.
5 郭华,邹万忠.肾小管间质纤维化与单核巨噬细胞的关系.北京大学学报,2003,35:503-507.

