肝细胞生长因子促进人胚胎干细胞向神经前体细胞分化*
胡智兴, 耿菊敏, 梁道明
(昆明医学院1药理学教研室,2云南省高校生物医学工程中心,4第二附属医院,云南昆明 650500; 3云南省疾病预防控制中心检验中心毒理室,云南昆明 650022)
人胚胎干细胞 (human embryonic stem cells, hESCs)在一定条件下可以诱导神经分化。迄今为止,人们已经建立起 hESCs向神经分化的许多方法,证实了多种内外源性神经诱导物质或因子如视黄酸[1]、碱性成纤维细胞因子 (basic fibroblast growth factor,bFGF)[2]、表皮生长因子 (epidermal growth factor,EGF)[3]、骨形成蛋白 4抑制剂 noggin[4]等,可以诱导 hESCs分化为神经细胞。近年的研究发现,肝细胞生长因子 (hepatocyte growth factor,HGF)可能具有神经诱导作用[5,6],HGF联合无血清培养基添加剂 G5 supplement可以诱导猕猴胚胎干细胞定向分化成高纯度的神经前体细胞 (neural progenitors, NPs),并能整合到大鼠脑部,发生迁移和分化[7]。考虑到不同物种胚胎干细胞基因表达、生长特性,对发育信号的反应等诸多方面均有差异,HGF是否能够诱导 hESCs的神经分化,产生特定脑区的终末分化神经细胞,需要进一步研究。本研究运用人胚胎干细胞,探讨HGF联合 G5 supplement诱导 hESCs定向分化为NPs的作用,并观察所诱导的 NPs对于脑区神经信号的反应性,并为最终诱导特定脑区的神经细胞提供实验依据。
材 料 和 方 法
1 主要材料与试剂
人胚胎干细胞株 BG02购自美国 BresaGen公司;DMEM/F12培养基、knockout血清替代品(knockout serum replacement,KSR)、非必需氨基酸、G5 supplement(成分:胰岛素、转铁蛋白、亚硒酸、生物素、氢化可的松、bFGF、EGF)、层黏连蛋白 (laminin)、音猥因子 (sonic hedgehog,Shh)购自 Gibco;新生牛血清购自 HyClone;明胶 (gelatin)、青霉素、链霉素、丝裂霉素 C、β-巯基乙醇、L-谷氨酰胺、多聚赖氨酸 (poly-D-lysine,PLL)购自 Sigma;巢蛋白(nestin)鼠抗单克隆抗体、β微管蛋白Ⅲ(βⅢ-tubulin)鼠抗单克隆抗体、O4鼠抗单克隆抗体、神经胶质原纤维酸性蛋白 (glial fibrillary acidic protein, GFAP)兔抗多克隆抗体、musashi-1兔抗多克隆抗体、配对盒基因 6(paired box protein 6,Pax6)-兔抗多克隆抗体、HGF、bFGF购自 Chemicon;Trizol RNA试剂盒购自 Invitrogen。
2 方法
2.1 hESCs的培养 hESCs细胞株BG02培养在丝裂霉素 C(5 mg/L)处理的小鼠成纤维细胞饲养层,培养基成分为:DMEM/F12、1 mmol/L谷氨酰胺、0.1 mmol/Lβ-巯基乙醇、1%非必需氨基酸、20%KSR, 4μg/L bFGF和 1×104U/L青霉素,100 mg/L链霉素。hESCs集落生长 5-6 d后,采用机械法对hESCs进行传代。
2.2 hESCs向 NPs分化[6]将 hESCs集落切割成100-200个细胞大小的团块,在撤除 bFGF的 hESCs培养基悬浮培养 4 d,诱导拟胚体 (embryonid bodies, EBs)形成。随机将 EBs分为 4组:(1)正常对照组, EBs培养在神经诱导培养基 (DMEM/F12,1×ITS,2 mmol/L谷氨酰胺);(2)G5组,EBs培养在含 G5 supplement的神经诱导培养基;(3)HGF组,EBs培养在含 10μg/L HGF的神经诱导培养基;(4)HGF +G5组,EBs培养在含 10μg/L HGF和 G5 supplement的神经诱导培养基。各组细胞悬浮培养 7 d,将EBs转移至 PLL/laminin(20 mg/L)包被的 24孔培养板中继续培养 7-10 d,待铺展生长的细胞中出现玫瑰花结样 NPs时,用 0.3 g/L dispase消化,细胞重新接种于 PLL/laminin包被的 24孔培养板。用 nestin,Pax6和 musashi-1进行染色,统计各组 nestin阳性细胞的比例。
2.3 NPs的扩增和分化 NPs悬浮培养于含有 10 μg/L HGF+G5 supplement的神经诱导培养基上。机械法传代,用拉细的玻璃针切割成小团块,每周换液2次。
为了检测NPs的体外分化能力,将神经诱导培养基撤除 G5 supplement和 HGF,将 NPs消化为单个细胞后,接种于 PLL/laminin包被的培养板上,诱导分化 14 d,分别采用神经元特异性标记βIII-tubulin、星形胶质细胞特异性标记 GFAP、少突胶质细胞特异性标记 O4细胞染色,统计各阳性细胞的比例。
2.4 流式细胞仪检测不同诱导时间 nestin阳性细胞的比例 在含 HGF和 G5 supplement的神经诱导培养基中分别诱导 0、4、7、10和 12 d的 EBs转移到PLL/laminin包被的培养板上,贴壁培养 10 d。胰酶消化为单细胞,4%多聚甲醛室温固定 20 min;PBS冲洗,加 0.4%Triton X-100室温透膜处理 15 min; PBS冲洗,加入鼠抗单克隆抗体 nestin(1∶200)37℃孵育 1 h;PBS冲洗,加Ⅱ抗室温孵育 30 min;PBS冲洗,PBS重悬细胞;流式细胞仪 (Becton Dickinson, FACS Vantage S)检测,每次实验检测细胞数大约为1×106个,实验重复 3次。
2.5 RT-PCR检测NPs中脑区标记基因的表达在含 100 mg/L Shh的神经诱导培养基,培养 NPs 14 d。RT-PCR检测神经上皮前体细胞标记基因Pax6、7、前脑前体细胞标记基因 [脑因子 1(brain factor 1,Bf1)、正小齿同源框 1(orthodenticle homeobox 2,Otx2)],后脑、脊索前体细胞标记基因[同源盒基因 (homeobox gene,Hox)b9、HoxC8、HoxC5、Hoxb4、原肠胚形成脑组织同源盒 2(gastrulation brain homeobox,Gbx2)]、中脑 NPs标记[齿状基因 2(engrailed 2,En2)]、腹侧 NPs标记 NK2家族同源框基因 (NK2 homeobox 1,N kx2.1)和 (NK2 homeobox 2, Nkx2.2)的表达。
细胞总 RNA采用 Trizol RNA试剂盒提取。将总RNA(3μg)逆转录成单链 cDNA,加入引物进行RCR扩增。PCR引物的序列以及相应的 PCR条件、产物的大小见表 1。PCR产物在 1.5%琼脂糖凝胶上电泳,溴化乙啶染色后,在紫外下观察。以看家基因 GAPDH为标准,通过电泳条带的强弱程度,评价基因表达量的高低。
2.6 免疫细胞染色
细胞用 4%多聚甲醛在室温下固定 10 min,PBS洗后 0.1%Triton X-100透膜 15 min,加入 10%的羊血清在 37℃封闭 40 min,加入以下Ⅰ抗 4℃过夜:nestin鼠抗单克隆抗体 (1∶200)、βⅢ-tubulin鼠抗单克隆抗体 (1∶200)、O4鼠抗单克隆抗体(1∶100)、GFAP兔抗多克隆抗体 (1∶1 000)、musashi -1兔抗多克隆抗体(1∶200)、Pax6兔抗多克隆抗体(1∶200)。去掉Ⅰ抗后,PBS冲洗 3次,加入Ⅱ抗在37℃下孵育 1 h。以不添加Ⅰ抗而添加Ⅱ抗的细胞作为阴性对照组,检测Ⅱ抗的非特异性结合情况。染色后的细胞用 Hoechst33342标记细胞核,激光共聚焦显微镜(Zeiss,LS M 510 META)进行检测。
3 统计学处理

表1 PCR引物的序列以及产物的大小Table 1 .Genes PCR pr imer sequences and product lengths
结 果
1 hESCs分化成 NPs细胞及鉴定
机械法将未分化的 hESCs集落 (图 1A)切割成团块,悬浮培养于胚胎干细胞培养基中。4 d形成球状 EBs样结构(图 1B),将 EBs团块进行随机分组,转移至 PLL/laminin包被的 24孔培养板上,贴壁生长。第 3-4 d,HGF、G5和 HGF+G5组的 EBs中间开始出现细长的细胞,并排列成玫瑰花样 NPs(图1C)。第 8-10 d,在玫瑰花结中间,出现神经管样NPs(图 1D);而正常对照组基本上以扁平细胞为主,并未出现玫瑰花样NPs(图 1E)。
NPs生长了 10 d后,用 0.3 g/L dispase消化,继续在 PLL/laminin包被的培养板上进行贴壁培养。免疫细胞染色表明这些细胞表达 nestin(图 1F),也表达NPs标志musashi-1(图 1G)和 Pax6(图 1H)。NPs在去掉 HGF和 G5后,接种在包被有 0.1%明胶的 24孔培养板上,细胞形成单层细胞,连续培养 14 d,分化的细胞出现βIII-tubulin+神经元 (图 1 I),表达O4的少突细胞(图 1J)以及 GFAP+的星型胶质细胞(图 1K)。提示所获得的 NPs具有分化为 3个谱系的神经细胞的能力。
随着培养时间的增长,NPs的贴壁能力逐步降低,逐步形成神经球(图 1L),在含 HGF+G5的神经培养基保持增殖能力。在体外培养了 3个月的神经球采用 nestin染色,结果表明,神经球仍然表达 nestin(图 1M),说明 HGF+G5能够长期地支持NPs的生长。
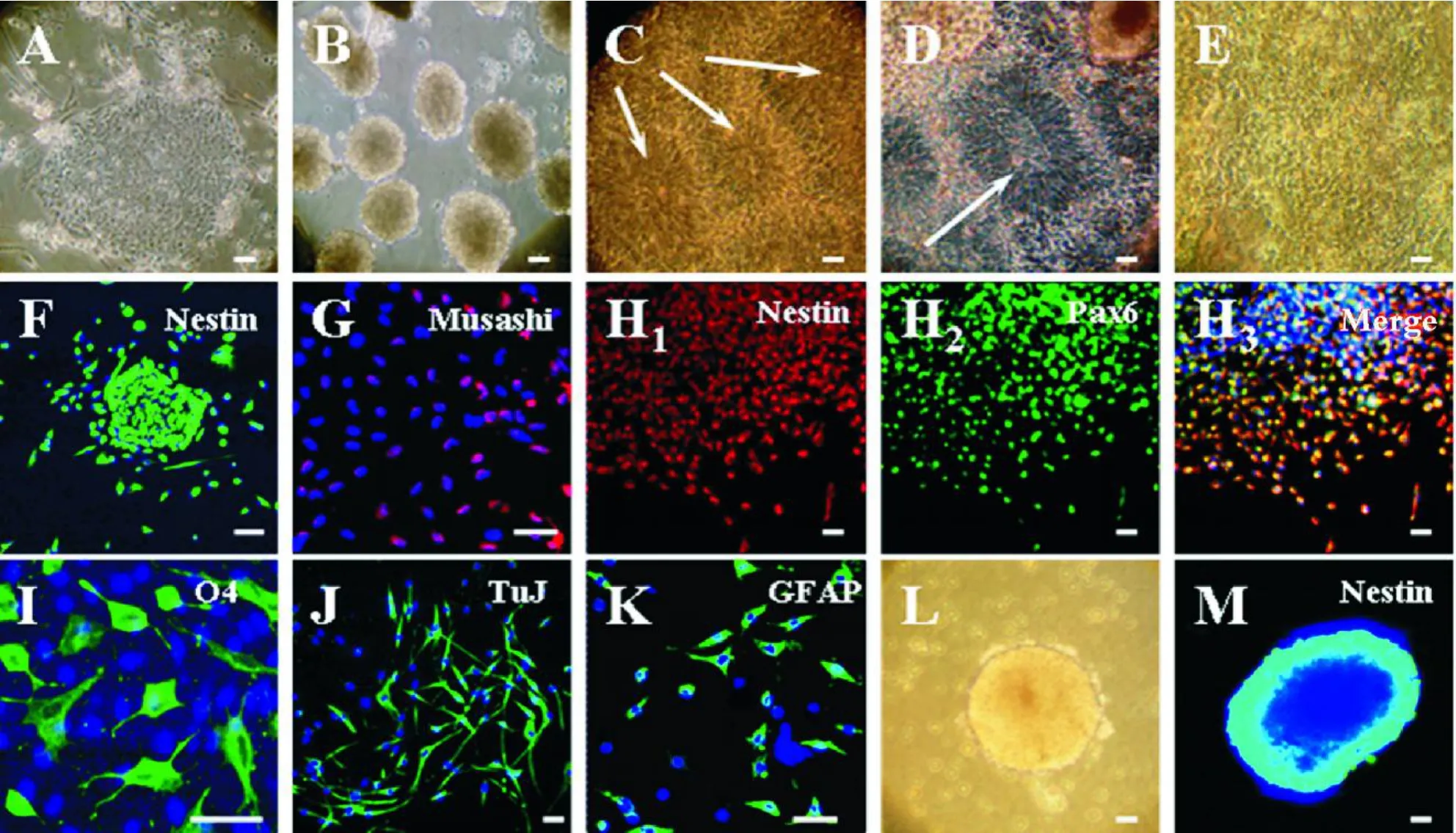
Figure 1.HGF induces human embryonic stem cells(hESCs)to differentiate into neural progenitors(NPs). A:phase contrast microscopic image of human embryonic stem cell line BG02 propagated on mouse embryonic fibroblast cells;B:four-day-old embryoid bodies(EBs)derived from hESCs;C:neural rosette-like structures(arrows)formed in the center of the differentiating cells 10 d after G5 and/or HGF treatment(10 mg/L)treatment;D:neural tube-like structures(arrow)formed on 14 d after G5 and/or HGF(10mg/L)treatment;E:differentiated cells in neural induction medium without G5 and HGF;F:immunofluorescence staining of nestin protein(a NP marker)on NP clump attached on culture plate for 3 d;G:immunofluorescence staining ofMusashi(a neuroepithelium/NP marker)on NPs;H1-H3: immunofluorescence stainingof nestin and Pax6(another neuroepithelium/NPmarker)in neuralprogenitors differentiated from hESCs;I-K:immunofluorescence analysis of three neural lineages differentiated from NPs.NPs differentiated from hESCs were cultured on 0.1%glutin-coated plateswithout growth factors for 7 d to determine the multipotency ofNPs generated. The differentiated cellswere stained for oligodendrocyte markerO4(I),neuron markerβIII-tubulin(TuJ,J),and astrocyte maker GFAP(K);L:NPs cultured in medium supplied with G5 and 10mg/L HGF for 3 mouths could proliferate as neurospheres;M:immunofluorescence staining of nestin on the neurosphere.Blue:Hoechst33342 labeled nuclei.Scale bar:50μm.图 1 HGF诱导人胚胎干细胞分化成神经前体细胞
2 HGF促进 hESCs分化成 NPs细胞
流式细胞仪定量检测各组 nestin+细胞占整个分化细胞的比例。如图 2所示,与正常对照组相比, HGF组和 G5组的 nestin+NPs明显增多 (P<0.05), HGF+G5组NPs的 nestin+比例(87.3%±3.9%)显著高于其它组(P<0.05)。
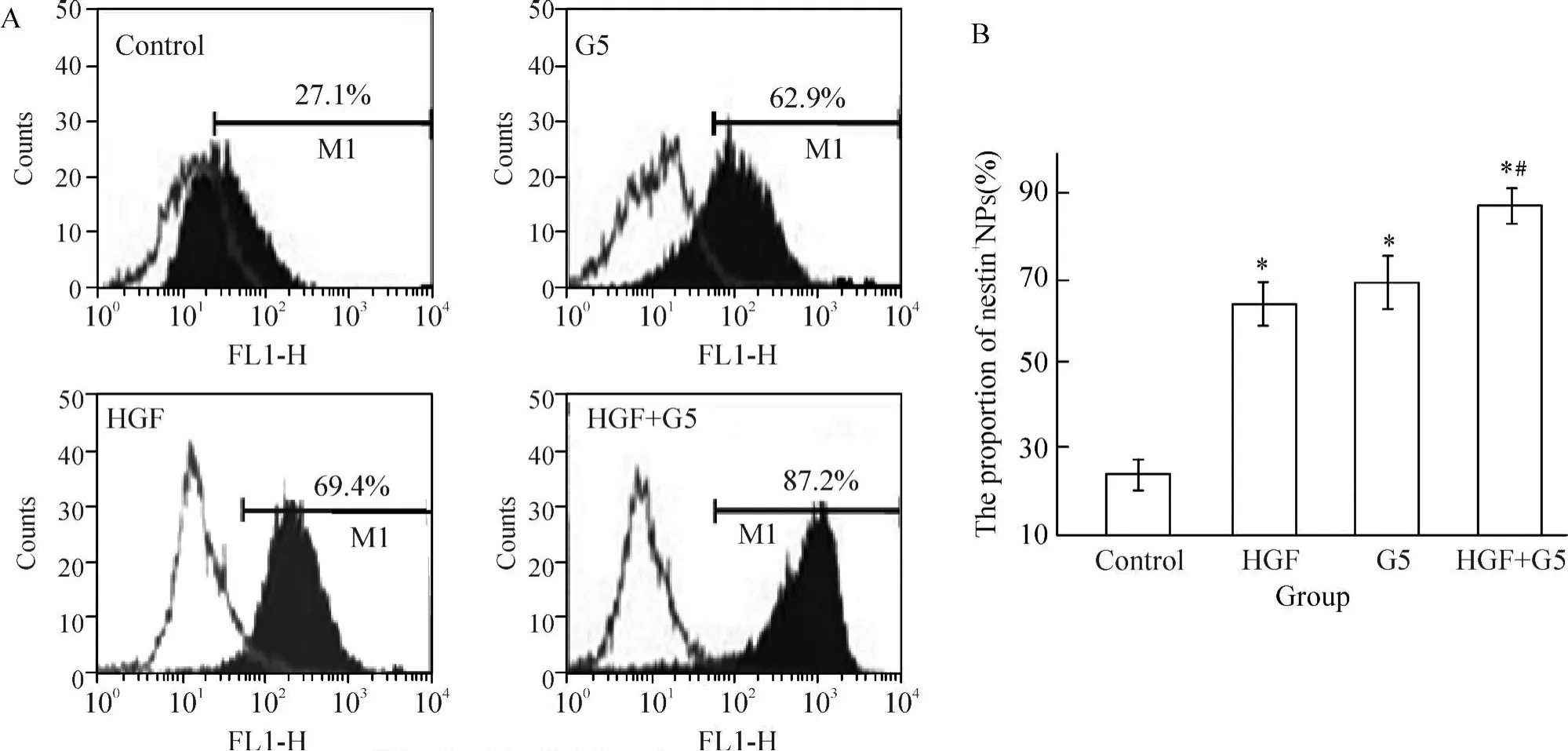
Figure 2.The proportion of nestin positive cells differentiated from hESCs in various treatment groups detected by fluorescent activated cell sorter(FACS).A:FACS results of nestin+cells in NPs of various groups;B:the percentages of the nestin+cells in NPs of various groups.±s.n=6.*P<0.05vscontrol group;#P<0.05vsHGF group or G5 group.图 2 流式细胞仪检测不同处理组人胚胎干细胞分化的 nestin+细胞比例
3 不同日龄 EB的分化特征
将分别悬浮培养 0、4、7、10和 12 d的 EBs转移到 PLL/laminin包被的培养板上,贴壁培养 10 d,培养基为含10 mg/L HGF+G5的神经诱导培养基。流式细胞仪检测 nestin阳性细胞的比例,结果见图 3,表明随着 EBs日龄的增加,nestin阳性细胞的比例增加,7 d时达到最大,进入平台期。
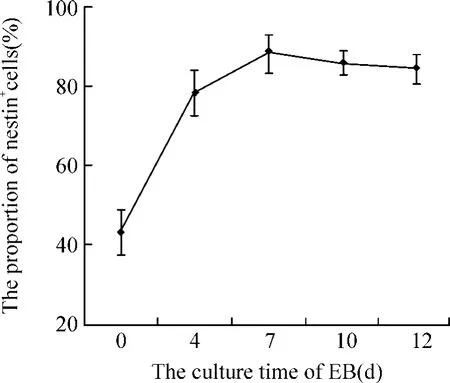
Figure 3.The proportion of nestin positive cells in differentiated cells from embryoid bodies(EBs)in different culture days.EBs cultured in different dayswere further attached on poly-D-lysine/laminin-coated plates for 10 d.The percentages of the nestin+cellswere determined by FACS.±s.n=4.图 3 不同日龄拟胚体分化的 nest in阳性细胞比例
4 NPs的脑区标记及对神经信号分子 Shh的反应性
用 RT-PCR分析NPs脑区标记的表达,结果如图 4,HGF(10 mg/L)+G5诱导的NPs表达神经上皮前体细胞标记 (Pax6、Pax7)、前脑前体细胞标记(O tx2、B f1)、中脑前体细胞标记 (En2),而弱表达后脑、脊索前体细胞标记 (Gbx2,Hoxb4),不表达后脑、脊索前体细胞标记 (HoxC8、HoxC5、Hoxb9),也不表达腹侧 NPs标记 (Nkk2.1和 Nkk2.2)。这提示所获得的NPs具有多个脑区前体细胞的特征,而没有腹侧NPs的特征。而在含有 Shh的神经诱导培养基中培养 14 d后,腹侧 NPs标志N kk2.1和 Nkk2.2表达增强,前脑标志 O tx2、B f1表达减弱,后脑标志 Gbx2、Hoxb4表达增强。表明NPs在 Shh作用下,初步具有后脑、腹侧NPs的特征。
讨 论
HGF是一种多效性生长因子,具有促进细胞增殖、迁移、形态发生等作用。研究表明 HGF及其受体在胚胎及成体神经系统中表达[8],HGF能够促进神经干细胞的自我更新[9],以及神经元存活、再生和功能修复[10]。Schuldiner等[5]的研究表明 HGF能诱导 hESCs分化成神经外胚层细胞,而 HGF联合 G5 supplement可以诱导猕猴胚胎干细胞定向分化成高纯度的NPs[7]。在本实验中,我们应用 HGF和 G5 supplement有效地诱导hESCs分化成高纯度的NPs,并保持NPs的长期增殖培养。NPs可进一步分化成神经元、少突和星型胶质细胞。
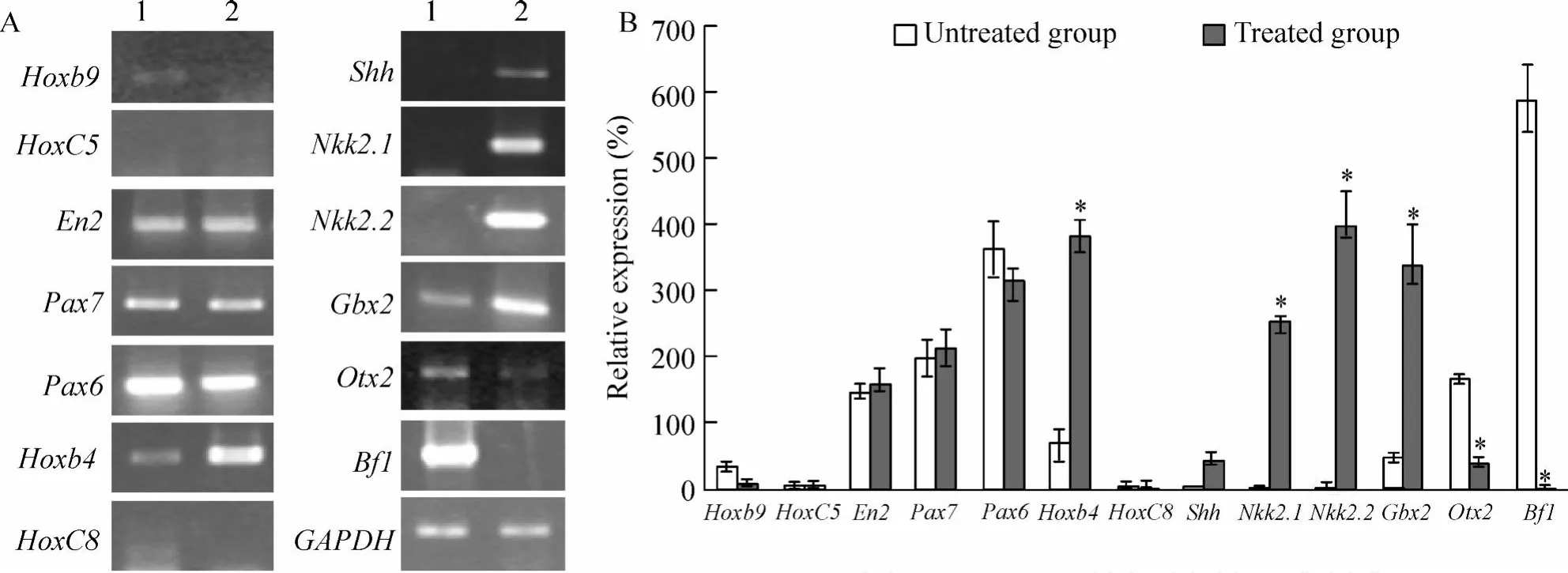
Figure 4.Comparison of brain region marker gene expression levels of neural progenitors treated with Shh,a ventralizingmolecule for 14 d.A:brain region marker genes includingPax6,Pax7,Bf1,O tx2,Hoxb9,HoxC8,HoxC5,Hoxb4,Gbx2,En2, Nkx2.1andNkx2.2were analyzed byRT-PCR.Lane 1:neuralprogenitors cultured inmedium without Shh;Lane 2:neural progenitors cultured inmedium with Shh.B:the relative levelof brain regionmarker genes in neuralprogenitors cultured in medium without Shh(untreated group)and neural progenitors cultured in medium with Shh(treated group).±s.n=4.*P<0.05vsuntreated group.图 4 RT-PCR检测神经前体细胞脑区标记基因的表达
诱导 EBs形成是 hESCs分化最常用的方法,优点是具有空间三维结构,与胚胎发育进程相仿[11]。本实验发现 EBs的日龄对NPs的诱导有影响,7d的EBs所诱导 nestin+细胞的比例最大。这可能是由于随着时间增加,EBs直径增加,内部细胞由于缺乏养分和因子而死亡。此外,以前将猕猴胚胎干细胞诱导分化为神经细胞时[7],采用了含血清的神经诱导体系,而我们采用无血清诱导神经细胞分化。无血清、成分明确的神经诱导培养体系是研究神经细胞分化机制以及细胞替代治疗所必须的,因而本研究所使用的神经诱导体系可为今后的研究提供细胞来源。
本研究中分化得到的细胞表达 NPs特征标记(nestin+、Pax6+、musashi+),与以往的报道相符[12],且细胞表达前脑前体细胞标记 (O tx2、B f1)、中脑前体细胞标记 (En2)、后脑、脊索前体细胞标记(Hoxb4),提示 HGF和 G5 supplement所诱导的 NPs具有多个脑区的特征,而 Yan等[13]用 bFGF诱导的神经上皮细胞只具有前脑前体细胞特征。这是否说明 HGF和 G5 supplement所诱导的 NPs具有更广泛的脑区特征,还有待于今后的研究。此外,神经系统的发生包含了若干个由信号分子精密控制的连续步骤,其中第一步就是外胚层分化成神经上皮细胞,然后神经上皮细胞在特定的神经信号分子的作用下,分化为特定脑区的前体细胞,继而分化为终末分化的细胞。我们把腹侧化神经信号分子 Shh添加到神经诱导培养基中,结果细胞表达腹侧化基因 (N kk2.1和Nkk2.2),前脑标记表达下调,而后脑标记表达上调。提示诱导得到的NPs能对神经信号分子产生反应,有可能产生特定脑区的终末分化神经细胞。将NPs分化成高纯度的终末分化细胞是下一步工作重点。
本研究中采用了 G5 supplement,主要活性成分为 EGF和 bFGF。以前的研究表明 EGF和 bFGF在神经系统的发育过程中起着重要的作用,已用于NPs的诱导分化和增殖[14,15]。我们的结果表明 HGF+ G5能够更加有效诱导 hESCs的神经分化,nestin阳性细胞的比例高于 G5组,说明 HGF和 G5 supplement之间有协同作用。然而这种协同作用到底是如何诱导 hESCs向神经细胞分化,有待于深入的研究。
[1] Lee JP,JeyakumarM,Gonzalez R,et al.Stem cells act through multiple mechanisms to benefitmice with neurodegenerative metabolic disease[J].Nat Med,2007,13 (4):439-447.
[2] Kunath T,Saba-El-LeilMK,AlmousailleakhM,et al. FGF stimulation of the Erk1/2 signalling cascade triggers transition of pluripotent embryonic stem cells from self-renewal to lineage commitment[J].Development,2007, 134(16):2895-2902.
[3] Kang S M,Cho MS,Seo H,et al.Efficient induction of oligodendrocytes from human embryonic stem cells[J]. Stem Cells,2007,25(2):419-424.
[4] Chambers S M,Fasano CA,Papapetrou EP,et al.Highly efficient neural conversion of human ES and iPS cells by dual inhibition of S MAD signaling[J].Nat Biotechnol, 2009,27(3):275-280.
[5] Schuldiner M,Yanuka O, Itskovitz-Eldor J,et al. Effects of eight growth factors on the differentiation of cells derived from human embryonic stem cells[J].Proc Natl Acad SciUSA,2000,97(21):11307-11312.
[6] 刘安民,罗 铭,蔡望青,等.转肝细胞生长因子的脐带间质干细胞移植促进大鼠脑出血后髓鞘再生[J].中国病理生理杂志,2009,25(10):1936-1940.
[7] Li T,Zheng J,Xie Y,et al.Transplantable neural progenitor populations derived from rhesus monkey embryonic stem cells[J].Stem Cells,2005,23(9):1295-1303.
[8] Trapp T,Kogler G,El-Khattouti A,et al.Hepatocyte growth factor/c-MET axis-mediated tropism of cord blood-derived unrestricted somatic stem cells for neuronal injury[J].J Biol Chem,2008,283(47):32244-32253.
[9] Nicoleau C,Benzakour O,Agasse F,et al.Endogenous hepatocyte growth factor is a niche signal for subventricular zone neural stem cell amplification and self-renewal[J]. Stem Cells,2009,27(2):408-419.
[10]ShimamuraM,Sato N,SataM,et al.Expression of hepatocyte growth factor and c-Met after spinal cord injury in rats[J].Brain Res,2007,1151(2):188-194.
[11]Reubinoff BE,Pera MF,Fong CY,et al.Embryonic stem cell lines from human blastocysts:somatic differentiationin vitro[J].Nat Biotechnol,2000,18(4):399-404.
[12]Zhang SC,WernigM,Duncan ID,et al.In vitrodifferentiation of transplantable neural precursors from human embryonic stem cells[J].Nat Biotechnol,2001,19 (12):1129-1133.
[13]Yan Y,YangD,Zarnowska ED,et al.Directed differentiation of dopaminergic neuronal subtypes from human embryonic stem cells[J].Stem Cells,2005,23(6):781-790.
[14]Kudoh T,Concha ML,Houart C,et al.Combinatorial Fgf and Bmp signalling patterns the gastrula ectoder m into prospective neural and epidermal domains[J].Development,2004,131(15):3581-3592.
[15]Mason I.Initiation to end point:the multiple roles of fibroblast growth factors in neural development[J].NatRev Neurosci,2007,8(8):583-596.

