猪瘟病毒Erns蛋白在毕赤酵母中的表达及鉴定
李艳蕊 ,李学伍 ,王 丽,刘 磊,张改平
(1.甘肃农业大学,甘肃 兰州 730070;2.河南省农业科学院农业部动物免疫学重点实验室,河南省动物免疫学重点实验室,河南 郑州 450002)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起猪的一种以高热和出血为特征的高度接触性传染病,是危害养猪业的重大传染病之一,被世界动物卫生组织(OIE)列入A类疾病名录[1],我国也将猪瘟列为一类动物疫病。CSFV是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的成员,其基因组为长约12.3 kb的线状单股正链RNA,含有单一的开放阅读框架(ORF),编码3 898个氨基酸残基,有4种结构蛋白(衣壳蛋白C和囊膜糖蛋白Erns、E1、E2)以及8种非结构蛋白(Npro、p7、NS2、NS3、NS4A、NS4B、NS5A 和 NS5B)[2-3]。其中 Erns、E2 是病毒诱导机体产生中和抗体的两个主要保护性抗原,同时也是病毒吸附进入敏感细胞的必须蛋白。Erns不具有跨膜区,而是以一种未知机制连接在病毒粒子表面,本身既是包膜结构蛋白,又是一种核苷酸酶[4]。尽管针对Erns的单抗也能中和病毒,但Erns在天然宿主中的体液免疫保护作用机制仍不清楚[5-6]。目前,国内外完成的对猪瘟病毒的研究主要集中在应用不同的载体来表达E2蛋白作为诊断及免疫[7],而Erns应用研究则相对较少。
毕赤酵母表达系统是目前比较成熟的真核表达系统之一,本研究通过毕赤酵母表达系统对CSFV Erns蛋白进行体外重组,旨在为研制以此蛋白为诊断抗原的CSFV ELISA定型诊断试剂盒奠定基础。同时对于研究CSFV的结构与功能也有重要的作用。
1 材料与方法
1.1 菌种及质粒
E.coli JM109、P.pastoris GS115和 P.pastoris整合型分泌表达质粒pPIC9K由河南省农业科学院农业部动物免疫学重点实验室保存。
1.2 试剂及工具酶
酵母完全培养基(YPD)、选择培养基(MD)、甲醇选择培养基(MM)、诱导培养基(BMGY)和甲醇诱导培养基(BMMY)按Invitrogen公司说明书配制;Plasmid Miniprep kit和 Agarose Gel DNA Purification Kit Ver.2.0以及各种限制性内切酶EcoRⅠ、NotⅠ、SalⅠ和 T4 DNA 连接酶、Ex taq 酶购自TaKaRa公司;Tryptone、Yeast为OXOID产品;YNB为Solarbio产品;
DL2000 DNA Marker、λ-EcoT14 Idigest Marker、λ-Hind Ⅲdigest Marker、低分子质量蛋白质Marker购自TaKaRa公司;四甲基氨基甲烷(TEMED)、D-山梨醇等购自Promega公司;过氧化物酶标记的二抗等为Sigma公司产品;所用引物由上海生工生物工程技术服务有限公司合成。
1.3 引物的设计及合成
根据GenBank中登录的猪瘟Erns基因序列,设计合成特异性引物,并在5′端加EcoRⅠ位点,3′端加 NotⅠ位点。引物序列如下:Erns 5′:5′-GGGGTACCGAGATAAAAGTTAATCCTCCTCAG-3′(引入EcoRⅠ酶切位点及保护性碱基),Erns 3′:5′-CCCAAGCTTCTATCCATG GACTTTG-3′(引入NotⅠ酶切位点及保护性碱基);根据甲醇酵母乙醇氧化酶1(AOX1)基因两端序列设计的引物序列如下 :5′AOX1:5′-GACTGGTTCCAATTGACAAGC -3′;3′AOX1:5′-GCAAATGGCATTCTGACATCC-3′。引物由上海生工生物制品公司合成。
1.4 PCR扩增Erns基因及基因片段的回收
以Teasy-Erns质粒为模板,PCR反应条件如下94℃ 2 min;94℃ 1 min,50℃ 1 min,72℃ 1 min,共30个循环;72℃延伸10min。4℃保存PCR产物,并经琼脂糖凝胶电泳进行鉴定。从琼脂糖凝胶中切下目的Erns片段,用Agarose Gel DNA Purification Kit Ver.2.0试剂盒回收。
1.5 p PIC9 K-Erns重组质粒的构建及鉴定
将Erns基因及pPIC9K质粒载体均用EcoRⅠ酶和NotⅠ酶双切,琼脂糖电泳,回收酶切片段;将双切后的Erns基因片段及pPIC9K片段用T4 DNA连接酶进行连接;连接产物转化感受态E.coli JM109(AMP+),用含 AMP+的 LB 平板筛选阳性重组子。通过酶切、PCR和测序等方法鉴定阳性克隆,命名为pPIC9K-Erns。
1.6 电穿孔转化及PCR方法筛选重组子
将重组表达质粒pPIC9K-Erns和空质粒p PIC9 K 用 SalⅠ酶切线性化,在 1.5 kV、20 μF、400 Ω的条件下将其转化到Pichi apastoris GS115酵母感受态中,取400μL铺于MD平板上,28℃培养3 d。挑选生长良好的单菌落接种于2 mL YPD培养过夜后,取新鲜的菌液3μL进行PCR[8],所用引物为 5′AOX1:5′-GACTGGTTCCAATTGACAAGC-3′;3′AOX1:5′-GCAAATGGCATTCTGACATCC-3′。
1.7 His+Mut+和His+Muts表型的鉴别
挑取筛选到的重组子单菌落分别接种MD和MM平板,28℃培养3 d。在2种平板上均生长良好的菌落为His+Mut+表型菌落。在MD平板上生长迅速,而在MM平板上生长较缓慢的即为His+Muts表型菌株。
1.8 目的蛋白的诱导表达
选取PCR鉴定正确的重组菌接种至含10 mL YPD培养基(1%酵母提取物、2%蛋白胨、2%葡萄糖)的试管中,30℃、200 r/min振荡培养过夜;次日以1%的比例(V∶V)接种至含100mLBMGY培养基(1.34%YNB、4×10-7生物素、10%甘油、1% 酵母提取物、2%蛋白胨、5%甘油)的500 mL三角瓶中,30℃、200 r/min振荡培养约24 h;离心并将菌体重悬于 BMMY 培养基(1.34%YNB、4×10-7生物素、1%酵母提取物、2%蛋白胨、0.5%甲醇)中,28℃,200 r/min振荡诱导表达4 d,每隔24 h补加100%甲醇至终浓度为0.5%,按时间段取样进行分析。
1.9 外源基因表达产物的SDS-PAGE分析
将工程酵母菌在BMMY培养基中诱导培养一定时间后,离心分别收集沉淀和上清,并将培养上清用硫酸铵沉淀法初步纯化,用2倍上样缓冲液与沉淀和纯化的上清蛋白等量混合进行SDS-PAGE试验以分析目的蛋白的表达。
1.10 蛋白印迹(Western-blot)检测
将SDS-PAGE的电泳产物转移至硝酸纤维素膜上,用5%脱脂乳封闭。分别用CSFV阳性猪血清、原核表达Erns蛋白单抗作为一抗,进行Western-blot检测。
2 结果与分析
2.1 Erns基因扩增产物的鉴定
PCR扩增产物经琼脂糖凝胶电泳,得到约681 bp左右的条带(图1)。
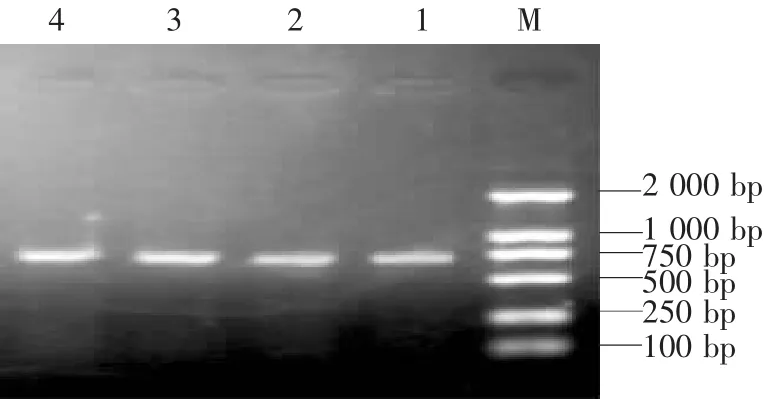
图1 PCR扩增Erns基因
2.2 pPIC9K-Erns阳性重组质粒的筛选
将双酶切后的目的片段和表达载体片段连接后转化E.coli JM109,在含有AMP+的LB平板上随机挑取5个菌落直接进行PCR,电泳显示菌落2、4、5、6有与目的基因相符的条带,1为阴性对照,说明 2、4、5、6 可能为阳性重组子(图 2)。
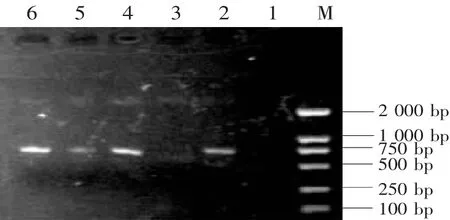
图2 重组质粒特异性引物PCR鉴定
选两个提取质粒进行双酶切鉴定,电泳结果显示2有两个条带,其一为载体片段(约9 kp左右),其二为与目的基因相符的条带(681 bp),而1则为假阳性质粒(图3),将构建好的重组质粒送上海生工生物制品公司测序,结果证明Erns基因已正确插入pPIC9 K的多克隆位点上。
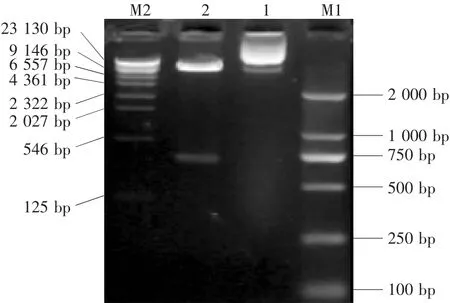
图3 重组质粒双酶切鉴定
2.3 pPIC9K-Erns重组酵母菌株的筛选及PCR鉴定
DNA测序结果显示,重组质粒pPIC9K-Erns序列和读码框架皆正确。pPIC9K-Erns经SalⅠ酶切线性化后,转化Pichia p astoris GS115酵母感受态细胞,在MD平板上长出19个His+转化子,小量培养后,提取基因组DNA,同时提取空白对照GS115 的基因组,作为模板,以 5′AOX1 和 3′AOX1为引物进行PCR,电泳检测在1 173 bp左右有条带出现,与 Erns基因(681 bp)加载体序列(492 bp)的大小(1 173 bp)相当,同时以设计的其自身引物Erns 5′和Erns 3′为引物,得到与目的基因相符条带(681 bp),表明pPIC9K-Erns已整合进酵母染色体中。对阳性菌株用MM和MD培养基鉴定其表型,结果均为 His+Mut+。
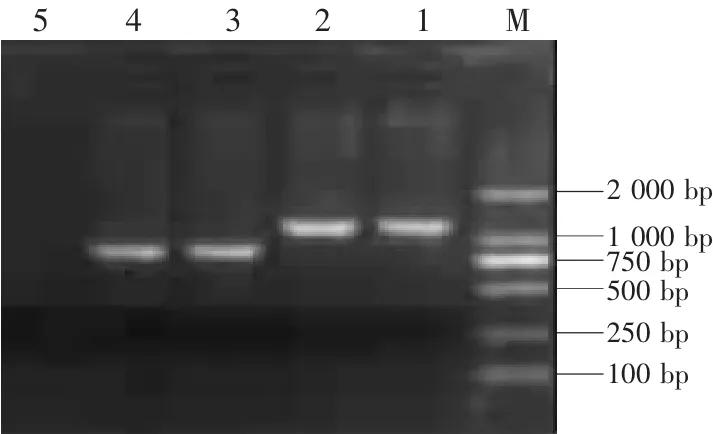
图4 重组酵母的PCR鉴定
2.4 Erns基因表达产物的SDS-PAGE分析及Western-blot检测
将筛选的转化子分别接种BMGY和BMMY培养基诱导表达后,将表达上清透析、浓缩后进行SDS-PA GE。结果显示,GS115/p PIC9K-Erns转化子3和4的诱导产物在50 kD处出现与预计的以同源二聚体形式存在的Erns大小相符的条带(见图5),而1和2及阴性对照5则没有这一条带。
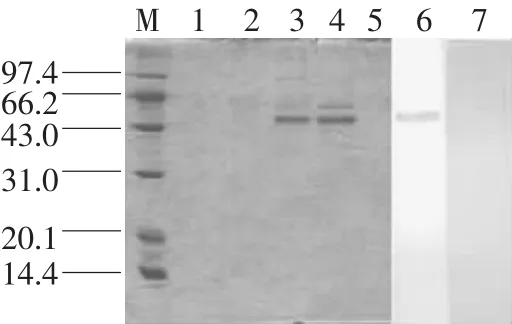
图5 表达产物的SDS-PAGE电泳及Western-blot分析
Western-blot结果显示(见图5),重组蛋白Erns可被CSFV多抗血清识别(第6条带),而阴性对照则不显色(第7条带)。证明本试验所得的表达产物可检测CSFV的抗体。
3 讨 论
表达系统是基因工程及生物制药研究和应用的重要工具,要求其经济、高效,并且安全。巴斯德毕赤酵母(Picha pastoris)作为甲醇营养型酵母的一种,能够在以甲醇作为单一碳源的培养基上生长,既具有原核生物易于培养、繁殖快、便于基因工程操作的特点,又具有真核生物的蛋白质加工、折叠、翻译后修饰的优点,同时其遗传比较稳定、能够高密度发酵、蛋白的表达量高、且易于纯化,因此,毕赤酵母现已成为现代分子生物学研究最重要的工具和模型,是表达外源基因比较理想的宿主[9-10]。目前已有400多种外源蛋白在毕赤酵母表达系统中成功表达[11-12],该系统是目前最成功的外源蛋白表达系统之一。
猪瘟病毒的结构蛋白为C和包膜糖蛋白Erns、E1、E2。除Erns、E2蛋白外,猪瘟的其他任何结构蛋白均不能产生中和抗体[13]。Erns由227个氨基酸残基(Glu268-Ala494)组成,以分子质量为97 ku的同源二聚体存在。Erns可诱导产生猪瘟的中和抗体,免疫猪可诱导产生对致死量CSFV的保护性免疫[14]。此外,编码Erns的核酸比E2保守性更高,因而其不仅可作为防控猪瘟的一种靶蛋白,也可配合E2亚单位疫苗免疫的检测来区分自然感染或人工免疫,开发应用前景比较好。余兴龙等用大肠埃希菌表达的CSFV重组E2蛋白为抗原,建立了检测CSFV抗体的间接EL ISA方法[15]。韩雪清、满朝来等人均建立了E2蛋白的酵母表达株,获得了比较大的表达产量,并对其表达条件进行了优化[16-17]。Erns目前的表达均集中于原核,其表达量较小,且不能进行后加工,难以进行进一步分析。
本研究通过构建重组质粒pPIC9K-Erns,成功转化和筛选到两株多拷贝的工程酵母菌株,通过甲醇诱导培养分泌表达的Erns蛋白量很高,并且pPIC9K载体表达蛋白带有His标签,为后期的亲和层析纯化蛋白创造了有利条件。Western-blot分析结果表明,表达的Erns蛋白能识别天然猪瘟多克隆抗体,具有生物学活性,下一步试验将大量诱导表达Erns蛋白,收集表达产物,经过变性、复性和纯化,以期得到高产量的纯化Erns蛋白,进一步研究Erns蛋白的功能与结构。
[1] 中国农业科学院哈尔滨兽医研究所.动物病毒学[M].北京:中国农业出版社,1999.
[2] Meyers G,Rumenapf T,Thiel H J.Molecular cloning and nucleotide sequence of the genome of hog cholera virus[J].Virology,1989,171:555-567.
[3]Moormann R JM,Warmerdam PA M,Meer B V D,et al.Molecular cloning and nucleotide sequence of hog cholera virus strain Brescia and mapping of the genome region encoding envelope protein E1[J].Virology,1990,177:184-198.
[4] Hulst M M,Panoto F E,Hoekman A,et al.Inactivation of the Rnase activity of glycol-protein E(rns)of Classical swine fever virus results in a cytopathogenic virus[J].JVirol,1998,72(1):151-157.
[5] Stark R,Meyers G,Rumenapf T,et al.Processing of pestivirus polyprotein:cleavage site between autoprotease and nucleocapsid protein of Classical swine fever virus[J].JVirol,1993,67(12):7088-7095.
[6] Windisch JM,Schneider R,Stark R,et al.Rnase of Classical swine fever virus:bioch-emical characterization and inhibition by virus neutralizingmonoclonal antibodies[J].JVirol,1996,70(1):352-358.
[7] 吴健敏,任兆钧,余兴龙,等.猪瘟病毒E2蛋白重组T4噬菌体的构建及免疫学特性[J].中国兽医学报,2004,24(6):2-5.[8] 郑 敏,金宁一,李 昌,等.口蹄疫病毒3ABC基因截短体在毕赤酵母中的表达及鉴定 [J].高等学校化学学报,2008,29(1):104-108.
[9] Freyre FM,Vazquez JE,Ayala M,et al.Very high expression of an anti-carcinoembryonic antigen single chain Fv antibody fragment in yeast Pichia pastoris[J].Journal of Biotechnology,2000,76:157-163.
[10]Janowicz Z A,Melber K,Merckelbach A,et al.simultaneous expression of the Sand L surface antigen of hepatistis B and formation ofmixed particle in methylotrophic yeast Hansenula polymorpha[J].Yeast,1999,7:431-433.
[11]Cereghino J L,Cregg JM.Heterolohous protein express in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiol Rev,2000,24:45-66.
[12]Macauley Patrick S,Fazenda M L,McNeil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[13]Van Riji P A,Bossers A,Wensvoort G,et al.Classical swine fever virus(CSFV)enevelope glycoprotein E2 containg one structural antigenic unit protects pigs from let hal CSFV challenge[J].J Virol,1996,77(11):2337-2745.
[14]高华峰,李富祥,张念祖,等.猪瘟病毒Erns基因的克隆及原核表达[J].动物医学进展,2007,28(2):22-24.
[15]余兴龙,涂长春,李作生,等.以重组mE2蛋白为抗原建立检测猪瘟病毒抗体间接EL ISA方法的研究[J].中国预防兽医学报,1999 ,21(3):220-222.
[16]韩雪清,刘湘涛,任芳丽,等.猪瘟病毒E2蛋白在酵母中分泌表达条件的优化[J].畜牧兽医学报,2003,34(6):567-572.
[17]满朝来,李一经.猪瘟病毒分离株E2基因的克隆与酵母表达系统转移载体的构建[J].中国兽医杂志,2004,40(5):3-5.

