猪流感病毒H1N1广东分离株HA基因的克隆与进化分析
骆建才,刘义志,尚辉琴,冀 君,谢青梅*
(1.深圳市农牧实业有限公司,广东深圳518023;2.华南农业大学动物科学学院,广东广州510642)
猪流感(Swine influenza,SI)是由甲型(A型)流感病毒引起的猪的一种急性传染病。猪流感病毒(Swine influenza virus,SIV)的血凝素(hemagglutinin,HA)蛋白是流感病毒的膜外蛋白,可与靶细胞表面的唾液酸结合,帮助病毒颗粒黏附于细胞表面,使病毒得以侵入细胞。血凝素蛋白与病毒易感的宿主范围和宿主对病毒感染产生的免疫反应有直接联系,其裂解性、受体特异性和糖基化是决定流感病毒感染性和致病性的重要因素[1]。流感病毒以其基因快速突变、表面抗原频繁变异而不断引起新的流行。HA的受体结合位点(receptor binding site,RBS)对宿主细胞受体的结合能力的特异性对于流感病毒感染的宿主范围起重要作用[2]。HA基因是病毒基因组中变异最快的,对于HA基因的研究在分子流行病学调查、毒株与亚型、疫情监测等方面具有重要的意义。近来年很多学者对不同地区不同时间的SIV的HA基因进行了研究分析。刘大飞等[2]对分离自广东的一株H1N1亚型SIV研究表明,其HA基因可能来源于类人谱系的流感病毒;范锋等[3]从无锡某猪场分离得到的H1N1亚型SIV研究表明,分离株属于古典型H1N1 SIV;李敏等[4]从广东不同猪场分离得到4株H3N2亚型SIV,证明HA基因属于近代类人H3N2亚型流感病毒;温纳相等从广东某猪场分离到9株猪流感病毒,4株为H1N1亚型,5株为H3N2亚型;赵朴等[5]成功构建了pMe-BacA-HA转移载体,为开发HA亚单位疫苗奠定了基础。
我国华南地区具备孕育流感病毒的自然条件和环境,在病毒起源和分子流行病学研究上,是世界新流感病毒亚型出现和流感暴发的疫源地[6-8],因此广东地区流感毒株在未来流感病毒变异和流行中的作用值得深入研究。本研究对广东地区2009年5—11月及2008年部分H1N1猪流感病毒的HA基因进行克隆和进化分析以及编码的蛋白氨基酸重要的功能位点进行比对,在一定程度上反映广东省H1N1亚型猪流感病毒的分子变异特征,为广东及全国的猪流感疫情监测和防控提供依据。
1 材料与方法
1.1 材料
1.1.1 毒株 毒株分离于广东一些猪场,分别命名为A/swine/Guangdong/02/2008/H1N1、A/swine/Guangdong/07/2008/H1N1、A/swine/Guangdong/09/2008/H1N1、A/swine/Guangdong/07/2009/H1N1、A/swine/Guangdong/05/2009/H1N1、A/swine/Guangdong/06/2009/H1N1、A/swine/Guangdong/09/2009/H1N1、A-swine/Guangdong/11/2009/H1N1。
1.1.2 载体和主要试剂 RNA提取试剂Trizol LS Reagent为GIBCO公司产品,AMV反转录酶及相关试剂、Taq聚合酶为Promega公司产品;pGEM-Teasy载体和Agarose Gel DNA Purification Kit为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 引物的设计合成 参照文献用流感病毒通用引物扩增HA基因,即HA-F:AGCAAAAGCAGGGGAAAA;HA-R:TCTCATGTCTCTGAAATCCT,包括全长的HA基因。引物由北京奥科生物技术有限责任公司合成。
1.2.2 病毒RNA的提取 参照Trizol LS Reagent说明书进行,提取RNA后直接用于RT-PCR。
1.2.3 HA基因的RT-PCR扩增 按常规RTPCR方法扩增HA基因,反应条件为:50℃反转录30 min;94℃预变性3 min;94℃40 s,55℃40 s,72℃2 min,循环30次;最后72℃10 min。反应结束后取5 μ L产物在10 g/L的琼脂糖凝胶电泳,凝胶系统上观察目的片段。
1.2.4 HA基因的克隆与鉴定 PCR产物纯化回收,连接于T载体上。连接产物直接用于转化DH5α感受态细胞。用PCR筛选阳性重组质粒,同时送阳性菌液到北京奥科生物技术有限责任公司测序鉴定。
1.2.5 HA基因序列比较和功能进化分析 应用Blast和DNA Star分析软件对测序基因片段进行整个阅读框架的核苷酸序列和推导的氨基酸序列进行同源性比较。
2 结果
2.1 HA基因的RT-PCR扩增
经10 g/L琼脂糖凝胶电泳鉴定,扩增到的HA基因片段约1 757 bp,包括HA基因完整阅读框(ORF)1 701 bp(图1),与预期一致。
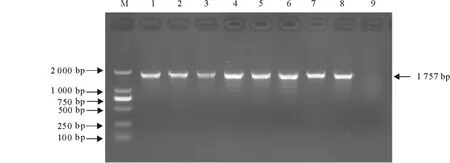
图1 HA基因RT-PCR产物电泳结果Fig.1 Electrophoretic analysis of HA gene RT-PCR products
2.2 HA同源性及遗传演化分析
HA氨基酸序列同源性分析表明,与经典SIV株同源性在92.3%~97.9%之间,与2009年人H1N1流感病毒同源性在80.4%~92.4%之间;与欧洲类禽SIV分离株同源性在80.4%~84.1%之间。从进化树可以看到,本次分离得到的8株H1N1猪流感病毒的HA基因与A-swine-Shanghai-3-2005-H1N1聚在一块形成一支,并以高Bootstrap值支持(100%),与类禽猪流感病毒的HA进化关系较远;经典的5株猪流感HA有4株聚在一块形成一支,其中A-swine-Maryland-23239-1991-H1N1与本次分离得到的12株HA及A-swine-Shanghai-3-2005-H1N1进化关系较近,聚在另外一大支上,以高Bootstrap值支持(96%);类禽猪流感病毒的3株单独聚在一起形成一支Bootstrap值为100%;与2009年甲型H1N1流感病毒和经典猪流感病毒分离株亲缘关系较近(图2)。
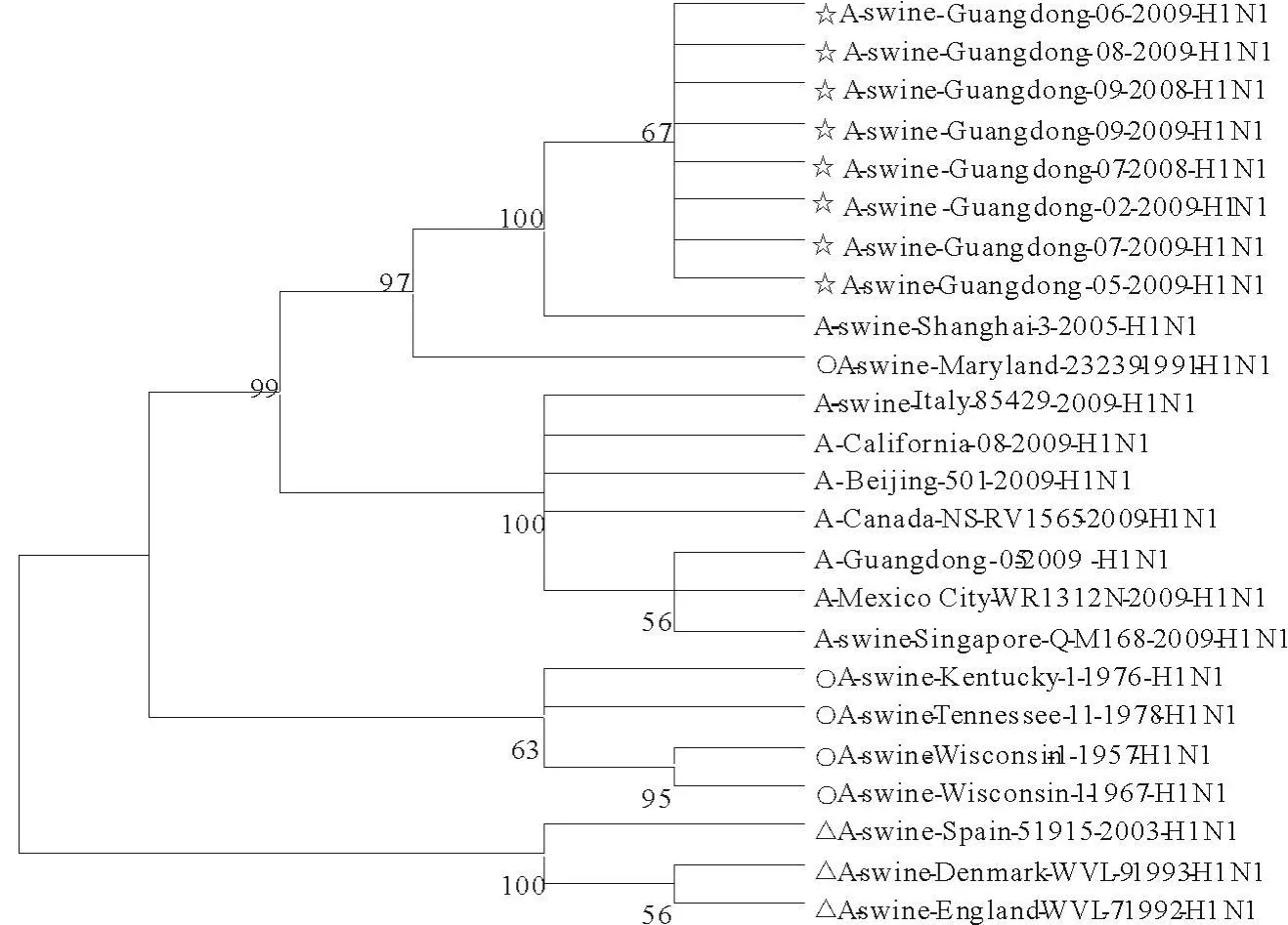
图2 H1N1猪流感病毒HA基因的遗传进化树Fig.2 Phylogenetic tree from the HA gene of H1N1 subtype swine influenza virus
2.3 HA基因编码蛋白氨基酸序列变异分析
对本次分离得到的8株HA基因的推导氨基酸序列进行分析,均含有8个潜在的N-糖基化位点,且糖基化位点相同。对其切割位点处的氨基酸序列分析发现其序列为IPSIQSR↓G。
通过比较8株HA基因的抗原表位,发现其抗原表位无大的变异;与2009年甲型H1N1流感病毒及类禽猪流感病毒的HA蛋白抗原表位进行比较,发现有5处变异(图3)。分离株HA与类禽猪流感病毒HA比较发现,在50位~60位,150位~160位,180位~190位,250位~260位,290位~300位氨基酸发生变化,导致其抗原表位发生了明显变异;与2009年甲型H1N1流感病毒HA比较发现,在50位~60位,80位~70位,130位~140位,180位~190位,250位~260位氨基酸发生变化,导致其抗原表位发生了明显变异。

图3 HA蛋白潜在的抗原决定簇及其特定区域位于蛋白表面的可能性比较Fig.3 Comparison of the antigenic determinant and surface probability plot of HA protein
3 讨论
同源性比较及进化关系表明:本研究的分离毒株同源性很高(平均约99.8%以上),进化关系很近,都聚在一支上。表明2008年—2009年之间广东省内流行的H1N1 SIV未发生明显的变异;与经典SIV进化关系很近且同源性较高(最高为97.9%),与类禽SIV进化关系较远,本研究毒株仍为经典SIV;与/swine/Shanghai/3/2005/H1N1进化关系很近,位于同一支上且同源性高(平均约为99.6%),可以推测本研究毒株与2005年上海毒株可能起源于同一毒株,2008年—2009年广东省内流行的H1N1 SIV可能源于2005年上海毒株。
HA蛋白是SIV最主要的表面蛋白,也是宿主免疫系统最主要的靶抗原,因此对HA基因氨基酸的研究极其重要。本研究对8株分离株的HA蛋白的裂解位点、糖基化位点和受体结合位点进行了分析。猪流感病毒的HA基因存在着裂解位点(PCS)、糖基化位点和受体结合位点(RBS)等重要的氨基酸位点[9],HA糖蛋白的抗原特性直接影响病毒的感染性、致病性、宿主特异性、病毒在机体内的增殖传播及病毒的组织嗜性。Matrosovich M等[10]研究发现,HA1和HA2裂解位点处糖基化位点的增加会降低流感病毒与细胞受体的亲和力和病毒释放能力,裂解位点处多1个碱性氨基酸的插入和糖基化位点的缺失均能使HA对蛋白酶切割的敏感性增强,而使致病力提高。本研究毒株HA基因的抗原表位无大的变异。8株分离毒株均含有8个潜在的N-糖基化位点,且糖基化位点相同。对其切割位点处的氨基酸序列分析发现其序列为IPSIQSR↓G。没有发现糖基化位点和裂解位点的变化,说明本次获得的分离株对宿主的致病力没有发生大的变化,还是属于低致病性毒株。
有研究报道,HA序列的第226位氨基酸决定病毒的宿主特异性,当SIV第226位的氨基酸为蛋氨酸(M)时,病毒就具有感染禽的的潜力。本次8个分离毒株的第226位的氨基酸为缬氨酸(V),未发生变异,因而不具有感染禽类的危险。
本研究通过对8株H1N1亚型SIV HA基因克隆的基础上对其遗传演化关系进行了分析,并对HA基因编码的蛋白氨基酸重要的功能位点进行比对,在一定程度上揭示了广东省流行的H1N1亚型猪流感病毒仍然属于经典SIV,并未发生大的变异。
[1] Shu B,Balish A,Garten R,et al.Confirmation of the first Hongkong case of human infection by novel swine origin influenza(H1N1)virus diagnosed using ultrarapid,real-time reverse transcriptase PCR[J].J Clin Microbiol,2009,47(7):2344-2346.
[2] 刘大飞,刘 明,刘春国,等.H1N1亚型猪流感病毒广东分离株全基因克隆及遗传演化分析[J].病毒学报,2008,24(5):358-363.
[3] 范 锋,倪谷音,毛爱民,等.猪流感病毒H1N1分离株HA基因的克隆与序列分析[J].动物医学进展,2008,29(8):48-51.
[4] 李 敏,向 华,宣 华.4株H3N2亚型猪源流感病毒HA基因序列测定与特性分析[J].中国兽医学报,2009,29(11):1424-1428.
[5] 赵 朴,郑玉姝,贾贝贝,等.猪流感病毒H1基因的克隆及杆状病毒转移载体的构建[J].生物技术通报,2009(9):97-100.
[6] 蒙雪琼,陈义祥,刘 棋,等.检测H1和H3亚型猪流感病毒多重RT-PCR方法的建立[J].中国兽医杂志,2009,45(4):18-19.
[7] 刘中勇,朱道中,李少璃,等.逆转录环介导等温扩增技术检测H3亚型猪流感病毒[J].动物医学进展,2009,30(7):1-5.
[8] 谢家新,殷建华,李淑华,等.2009年新型甲型H1N1流感病毒血凝素基因进化分析[J].第二军医大学学报,2009,30(6):613-617.
[9] 寇 铮,胡松年,李天宪.甲型H1N1流感病毒流行株基因组进化分析[J].科学通报,2009,54(12):1652-1656.
[10] Matrosovich M,Zhou N N,Kawaoka Y,et al.The surface glycoproteins of H5 influenza viruses isolated from humans,chickens and wild aquatic birds have distinguish-able properties[J].J Virol,1999,73(2):1146-1155.