培养方法对发菜细胞中多糖和蛋白含量影响的研究
陈雪峰, 王 岳
(陕西科技大学生命科学与工程学院, 陕西 西安 710021)
0 前言
发菜(NostocFlagelliforme)是发状念珠藻的简称,隶属蓝藻门,主要生长在干旱、半干旱地区的部分荒漠草原和荒漠地带,是一种经济价值很高的食用性蓝藻[1].发菜在其生长过程中会向胞外分泌大量的多糖物质,发菜多糖具有很高的亲水性,有利于发菜在干旱环境中生长,并能对其起到保护作用[2].日本微细藻类综合研究所和富山医科药科大学的药理试验结果表明,发菜多糖对单纯疱疹病毒等具有明显的抗病毒活性[3].近年来,发菜成为了一种引人注目的新型产多糖资源,而有关发菜中蛋白质的研究也逐渐增多.
本实验通过选择不同润湿性的固体基质以及不同的培养方法,对发菜细胞生长状况及不同培养过程中分泌的荚膜多糖、胞外多糖含量及蛋白质生成进行了研究,以期为发菜培养和发菜细胞中有效成分的提取分离提供基础数据.
1 材料与方法
1.1 材料
1.1.1 发菜细胞
野生发状念珠藻于2002年采于宁夏贺兰山东麓,发状念珠藻细胞种由天津科技大学工业微生物教育部重点实验室保藏2年.将发菜原植体经光合活性恢复,匀浆法分离单体细胞,纯化后,收集细胞,重新悬浮于新鲜BG11培养基中,备用.
1.1.2 固体培养基质
选取粗沙(粒径>0.83 mm)、玻璃渣(粒径>0.83 mm)和PA6(尼龙6)3种不同润湿性的固体基质,用水洗涤干净,烘干,添加量以平铺至Ф90 mm培养皿5 mm高度为宜,即粗沙和玻璃渣每培养皿用量60 g,PA6每培养皿30 g.
1.1.3 培养液
考虑到发菜生长环境比较恶劣,并且自身具有固氮能力,选取BG110(不含氮)培养液进行培养.
1.2 方法
1.2.1 固体基质接触角的测试
润湿性是固体表面极为重要的性质,所谓润湿性是指流体在固体表面扩展或粘附的趋势[4].固体表面的润湿性一般用表观接触角来衡量.
接触角(Contact Angle,CA)测定在德国Dataphysics公司生产的OCA20光学视频接触角测量仪上进行,注射针中液体注射速度为0.5μL/s,注射体积为3.0~5.0μL.测定温度在室温下进行,25 ℃,水为去离子水.
样品制备:测试材料至少要提供1 cm2平面才能进行测试.取相同来源的玻璃片一块替代玻璃渣进行接触角测试,取相同来源的具有光滑平面的同一卵石块替代沙粒测试接触角,PA6用甲酸溶解少许涂在蒸发皿上制成薄膜,粘贴在玻璃片上进行接触角测试.样品测试前均洗涤干净无污染物.
1.2.2 发菜细胞的培养
将备用的发菜细胞洗涤、离心后,用BG110作培养液稀释至一定浓度作为接种菌液.
(1)发菜细胞的液体培养.取5 mL稀释液分别滴加于小三角瓶中,并补加BG110培养液至15 mL.
(2)发菜细胞的固体培养.取5 mL接种液分别滴加于粗砂、玻璃渣和PA6培养皿内,并补加BG11培养液至15 mL.将液体培养和固体培养发菜加盖置于光照培养箱内培养,光照强度为90μmol·m-2·s-1,光暗比为12∶12,温度白天25 ℃,夜晚10 ℃.每2日补少量水于固体基质材料,保持表面湿润.
1.2.3 生物量的测定
采用叶绿素含量法,间接测定发菜细胞生物量[5],蓝细菌液中的叶绿素含量按下式计算[6]:Chla(μg/培养皿或三角瓶)=40×13.9×A665×V甲醇/V样.
1.2.4 发菜多糖测定
将液培发菜直接过滤,分别收集滤液和发菜细胞;3种固培发菜均用蒸馏水将发菜细胞从固体基质上清洗下来,清洗液直接过滤,分别收集3种滤液和发菜细胞.
分别将收集的4种发菜细胞干燥、粉碎后,取相同体积干粉M,用热水浸提,收集滤液,浓缩,醇沉所得多糖为荚膜多糖;将收集的4种滤液分别浓缩、醇沉后所得多糖为胞外多糖.
分别将醇沉后的8种多糖热水复溶后至相同体积V,透析,以苯酚-硫酸法[7]逐一测定其吸光度,以下式计算其多糖含量:发状念珠藻多糖含量G(以葡萄糖计,mg/mL)=C×V×0.9.式中,C为标准葡萄糖溶液浓度;V为测得吸光度所对应的标准葡萄糖溶液的体积;0.9为校正系数.

1.2.5 发菜蛋白质的测定
分离发菜细胞,干燥粉碎后得发菜细胞干粉,称取一定量的发菜干粉进行蛋白测定.
总蛋白质含量的测定方法:按GB/T5009.5-2003食品中蛋白质的测定[8]方法进行操作.
2 实验结果
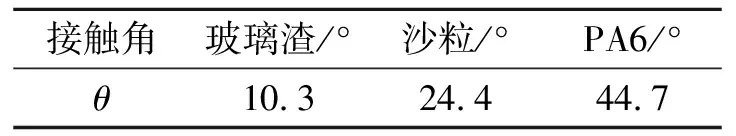
表1 不同固体基质材料的接触角
2.1 固体基质材料的润湿性
所谓接触角,是指液体在固体表面上形成液滴,达到平衡时,在气、液、固3相交界处气/液界面和固/液界面之间的夹角,用θ表示,液体在固体上的接触角越小,润湿性能越好[9].由表1可以看出,所选定的3种固体基质材料都具有亲水性,润湿性大小依次是玻璃渣>沙粒>PA6,即玻璃渣的润湿性最好,沙粒次之,PA6最差.
2.2 不同培养条件下发菜细胞的生长情况
不同培养条件下发菜细胞的生长情况如图1所示,发菜细胞在液体培养的条件下生长速率最高,60 d增长了177%,远远高于所有固体培养.在固体培养中,发菜细胞在粗沙固体基质上的生长速率最高,60 d增长了136%;在PA6上次之,60 d为53%;在玻璃渣上最低,60 d为-73%,呈现负增长.
图1 不同培养条件下发菜细胞 生长情况(60 d)
2.3 不同培养条件下发菜细胞多糖分泌情况
不同培养条件下发菜细胞多糖分泌情况如图2所示:发菜细胞荚膜多糖在液培中分泌量最高,多糖提取率为5.5%,在粗沙上次之,为5.2%,在PA6上再次之,为3.9%,在玻璃渣上最低,为2.7%;发菜细胞胞外多糖的分泌情况与荚膜多糖分泌情况相反,在玻璃上最高,为4%,在PA6上次之,为1.6%,在粗沙上再次之,为0.79%,在液培中最低,为0.53%;在玻璃上培养的发菜细胞中多糖提取率最高,为6.7%,在液培中次之,为6.03%,在粗沙上再次之,为5.99%,在PA6上最低,为5.5%.

图2 不同培养条件下发菜细胞多糖分泌情况(60 d)
图3 不同培养条件下发菜细胞中蛋白质的含量(60 d)
2.4 不同培养条件下发菜细胞蛋白质的生成
发菜在不同培养条件下蛋白生成量如图3所示: 发菜细胞中蛋白含量在液培条件下含量最高,要明显高于其他所有固体培养,为38.7 g,在PA6上次之,为20.3 g,玻璃上再次之,为18.9 g, 粗沙上蛋白含量最少,为15.1 g.
3 讨论
发状念珠藻虽然分布于干旱、半干旱地区的部分荒漠草原和荒漠地带,但其生长也需要水,只是与其他生物相比承受缺水的能力更强.在接种量、光照、温度等生长条件相同时,液体培养的发菜细胞由于水分充足其生长速率高于固体培养,这说明在今后的发状念珠藻人工扩大培养方面应该更多地采用液态培养方式.采用液态培养能够大规模、工业化培养发状念珠藻,一方面可以获得所需要的目的代谢产物(如发菜多糖、藻蛋白)满足人类需要,另一方面可以获得大量的发状念珠藻种以进行荒漠地带的生态恢复和沙漠治理.发状念珠藻在固体培养下,其对水分的需求具有干湿节律,发状念珠藻从周围吸收水分满足生长和生理活动,但是在生理上水分过量会导致发状念珠藻细胞损伤[10].在野生环境中,不断供水反而引起发状念珠藻的负增长[11],因此,在雨后迅速失水对发状念珠藻是很重要的.发菜细胞生长对缺水也很敏感[12],轻度水分胁迫即引起细胞生长减慢、细胞壁合成及蛋白质合成的下降.玻璃渣固体基质材料很高的润湿性可对发菜引起水分的过度供给,从而导致发状念珠藻的负增长;PA6固体基质材料较弱的润湿性可对发菜细胞产生轻度水分胁迫,从而导致发状念珠藻生长缓慢,粗沙固体基质材料适中的润湿性能提供较为合适的水分供给,因此发状念珠藻生长正常,保持了较好的生长速率.在发状念珠藻的固体培养中,发菜细胞生长所依附的固体基质表面性质——润湿性也是一个需要考虑的重要影响因素.在今后的野外栽培中,也要把栽培环境的固体基质润湿性作为一个因素考虑.
在不同的培养条件下,发菜细胞多糖分泌情况也有很大差异.发菜荚膜多糖的含量多少与发菜细胞的生长情况密切相关,发菜细胞在液体培养条件下增长最快,其中所含有的荚膜多糖也最多,接种在玻璃渣上的发菜细胞生长呈衰弱趋势,其荚膜多糖含量也最少.另一方面,发菜在生长过程中也向细胞外分泌胶状多糖物质,成为胞外多糖,包裹于发状念珠藻细胞及藻丝体外,可保护发菜细胞不受干旱、高温、紫外辐射等不利环境的危害.胞外多糖作为细胞与环境直接接触的桥梁,对发状念珠藻在抵抗外界环境的胁迫方面具有重要的作用.发菜细胞在不利的生长环境下因要克服不适条件,需要分泌更多的胞外多糖以保护自身不受伤害.在适合其生长的液培条件下,胞外多糖的分泌量要少于固体培养的发菜细胞.固体基质的润湿性同样影响着胞外多糖的分泌,固体基质润湿性过低,不利于发状念珠藻获取水分,发状念珠藻就要分泌较多的胞外多糖,利用多糖具有的强亲水性帮助其从环境中以较快的速度获取水分;固体基质润湿性很强,虽有利于发状念珠藻从环境中获取水分,不会受到干旱环境的胁迫,但由于固体水分过多也能阻碍发状念珠藻生长,发状念珠藻分泌更多的胞外多糖保持水分的平衡供给.这说明发状念珠藻对不利的固体材料润湿性具有一定的自我调节机制,这种调节机制通过胞外多糖分泌量调整来完成,可见发菜细胞自身的生长情况以及生长环境都是影响发菜多糖含量的重要因素.陈雪峰[13]等初步研究了液培发菜荚膜多糖和胞外多糖的结构特性与活性,发现其荚膜多糖及胞外多糖的结构和活性均有较大差异,这为今后对固培发菜细胞中多糖的进一步研究奠定了基础.
在不同的培养条件下,发菜细胞的良好生长有利于发菜中蛋白质的积累.在其他生长条件相同时,水分充足的液体培养的发菜细胞中蛋白质含量要明显高于其他固体培养,这说明发菜细胞也可作为藻蛋白的一种新来源,在今后发状念珠藻蛋白质的获取上可以更多地采用液态培养方式.
[1]唐进年,赵 明,张盹明,等. 发菜的生物学特性及资源保护[J]. 中国野生植物资源, 2000,19(5):20-24.
[2]Kenji Kanekiyo, Jung-Bum Lee, Kyoko Hayashi. Isolation of an antiviral polysaccharide nostoflan from a terrestrial cyanobacteriumNostocflagelliforme[J]. Journal of Natural Products, 2005, 68(7):1 037-1 041.
[3]Kanekiyo K., Lee J.B., Hayashi K.,etal. Isolation of an antiviral polysaccharide, Nostoflan, from a terrestrial cyanobacterium,Nostocflagelliforme[J]. J. Nat. Prod.,2005, 68: 1 037-1041.
[4] Calhoun J C.Criteria for determining rock wettability [J]. Oil & Gas J, 1951, 50(1): 151-153.
[5] Mack inney G. Absorption of light by chlorophyll solutions[J]. Biol Chem, 1941, 140: 315-322.
[6] Hall D. O., Rao K. K..Photosynthesis(5thed)[M]. Cambridge: the Press Syndicate of Cambridge, 1994:43.
[7]白雪娟. 发状念珠蓝细菌细胞培养液中多糖含量测定方法的比较研究[J]. 食品工业科技,2004,25(11):146-149.
[8]GB/T5009.5-2003食品中蛋白质的测定[S],2003.
[9] 赵振国. 接触角及其在表面化学中的应用[J].化学研究与应用,2000,8(4): 370-374.
[10]梅俊学,程子俊.供水和光照对发状念珠蓝细菌生理活性的影响[J].西北师范大学学报(自然科学版).1989,(1):75-77.
[11]崔志有.内蒙古四子王旗地区发状念珠蓝细菌的分布[J].植物生态学与地植物丛刊,1985,9(3):223-229.
[12] 刘友良.植物水分逆境生理[M].北京:农业出版社,1992,54-138.
[13]陈雪峰,贾士儒,王 岳,等. 发菜多糖的红外光谱分析与抗氧化活性的研究[J]. 食品与发酵工业,2009,(6):47-50.

