肾透明细胞癌组织中Id4因子的表达变化及意义
吴 剑,史子敏,朱安义,洪振东,雷 瑛,李里香
(南昌大学第二附属医院,江西南昌 330006)
肾透明细胞癌(下称肾癌)的发生与其异常的细胞周期、细胞增殖有关。分化抑制因子(Id因子)参与促进细胞增殖、抑制细胞分化、肿瘤形成及肿瘤血管形成、肿瘤侵袭转移等过程,与肿瘤预后密切相关[1]。Id4因子为 Id转录因子成员之一,目前有关Id4因子在肾癌发病机制中作用尚不清楚。2007年6月 ~2010年 4月,我们采用免疫组化法检测肾癌组织中Id4因子表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选取我院存档的肾癌石蜡标本30例。30例患者中,男 16例,女 14例;年龄 22~74岁,平均50.7岁;均为初次患病,均经病理证实。病理分级:Ⅰ级 9例,Ⅱ级 8例,Ⅲ级 8例,Ⅳ级 5例; TNM分期:T1期13例,T2期9例,T3期6例,T4期2例。另取癌旁5 cm外组织(癌旁组)10例和其他原因切除的正常肾组织(正常组)10例为对照。
1.2 Id4因子检测方法 兔抗人Id4因子单克隆抗体及免疫组化试剂盒均购自武汉博士德生物工程有限公司。均行免疫组化SABC法染色,按试剂盒说明书操作,PBS代替一抗作为阴性对照。细胞质和(或)核呈棕黄色、棕褐色为Id4因子阳性细胞。高倍镜下每张切片随机选取 5个视野,每视野计数100个肿瘤细胞,共 500个,计算每张切片阳性细胞百分比。阳性细胞数 <10%为阴性,10%~50%为阳性,>50%为强阳性;阳性、强阳性均为阳性。
1.3 统计学方法 采用SPSS17.0统计软件,数据分析用χ2检验和Fisher四格表确切概率法,α= 0.05。
2 结果
2.1 三组Id4因子表达变化 肾癌组中Id4因子阳性表达率为 70%(21/30),分别高于癌旁组的30%(3/7)和正常组的20%(2/8),P均<0.05;癌旁组和正常组比较,P>0.05。详见表1。
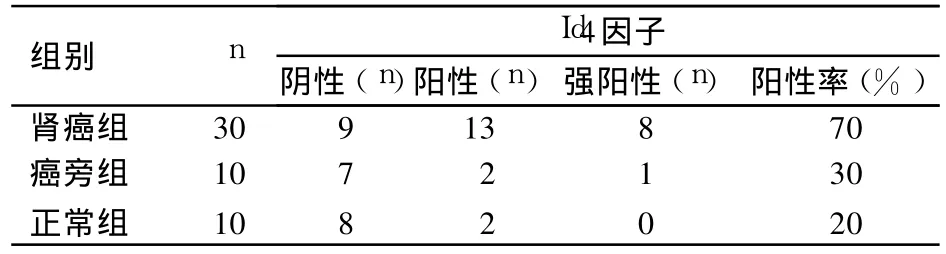
表1 三组Id 4因子表达情况
2.2 Id4因子表达与肾癌病理分级、TNM分期的关系 随肾癌的病理分级、TNM分期的增高,Id4阳性表达率增加,但P>0.05。详见表2。

表2 Id 4表达与肾癌病理分级、TNM分期的关系
3 讨论
大部分Id因子家族成员被认为具有致癌作用,如在乳腺癌组织中 Id3因子高表达,起促癌作用[1,2]。Id4因子广泛表达于人体正常组织中,在成人正常组织如甲状腺、胰腺、大脑、睾丸等均呈高表达,在肾脏组织中呈低表达或不表达,而在胚胎组织如脑、肾脏、肺等组织中呈高表达。有研究表明[3], Id4因子与促进细胞增殖、抑制细胞分化和细胞凋亡等有关,对组织器官起调控作用。
Id4因子既有致癌又有抑癌作用,在不同来源、不同性质、不同程度的肿瘤组织中表达程度不同, Id4因子由于异常高表达或启动子异常甲基化导致沉默等,与肿瘤及肿瘤血管形成、肿瘤侵袭转移等过程密切相关。如在神经系统肿瘤[4]、卵巢癌[5]、小鼠乳腺癌细胞[6]中,Id4因子呈高表达,与其细胞增殖、分化异常有关,起促癌作用;而在大部分血液系统恶性肿瘤[7,8]、人类乳腺癌[9,10]、前列腺癌[11]、结肠癌[12]、食管癌[13]等肿瘤组织中,Id4因子呈低表达状态,起抑癌作用,且与肿瘤不良预后有关,增加肿瘤转移潜在风险。
本实验结果显示,在肾癌中,Id4因子表达强度显著高于癌旁及正常肾组织,提示 Id4因子在肾癌发病机制中起重要作用,与癌细胞增生活跃、分化异常可能有关,可能起促癌作用。另有学者[14]发现Id4因子可受突变的p53和核转录因子E2F1协同调控激活,通过突变型p53-E2F1-Id4转录轴参与血管生成因子的转录,促进肿瘤新生血管形成。因此, Id4因子在肾癌的肿瘤血管形成是否发挥作用,且与E2F1是否有关联,有待进一步研究。
总之,Id4因子在肾癌组织中表达上调,可能在其发病机制中起重要作用。
[1]Norton JD.ID helix-loop-helix proteins in cell growth,differentiation and tumorigenesis[J].JCell Science,2000,113(22):3897-3905.
[2]张德才,张景华,汪萍,等.Id3、C2erbB 22、PCNA在乳腺癌中的表达及意义[J].山东医药,2009,24(49):66-68.
[3]Rigolet M,Rich T,Gross-Morand MS,et al.cDNA cloning,tissue distribution and chromosomal localization of the human Id4 gene [J].DNA Research.1998,5(5):309-313.
[4]Jeon HM,Jin X,Lee JS,et al.Inhibitor of differentiation 4 drives brain tumor-initiating cellgenesis through cyclin E and notch signaling[J].Genes Development,2008,22(15):2028-2033.
[5]Beger C,Pierce LN,KrugerM,et al.Identification of Id4 as a regulator of BRCA1 expression by using a ribozyme-library-based inverse genomicsapproach[J].PNAS,2001,98(1):130-135.
[6]Shan L,Yu M,Qiu C,et al.Id4 regulatesmammary epithelial cell growth and differentiation and is overexpressed in rat mammary gland carcinomas[J].Am JPathology,2003,163(6):2495-2502. [7]Yu L,Liu C,Vandeusen J,et al.Global assessment of promoter methylation in amousemodel of cancer identifies Id4 asa putative tumor-suppressor gene in human leukem ia[J].Nat Genet,2005, 37(3):265-274.
[8]Wang H,Wang XQ,Xu XP,et al.Id4methylation predicts high risk of leukem ic transformation in patients with myelodysplastic syndrome[J].Leuk Res,2010,34(5):598-604.
[9]Umetani N,MoriT,Koyanagi K,et al.Aberrant hypermethylation of Id4 gene promoter region increases risk of lymph nodemetastasis in T1 breast cancer[J].Oncogene,2005,24(29):4721-4727.
[10]Noetzel E,Veeck J,Niederacher D,et al.Promoter methylationassociated loss of Id4 expression is amarker of tumour recurrence in human breastcancer[J].BMCCancer,2008,8(8):154.-167. [11]Carey JP,Asirvatham AJ,Galm O,et al.Inhibitor of differentiation 4(Id4)isa potential tumor suppressor in prostate cancer[J]. BMC Cancer,2009,9(9):173-185.
[12]Borinstein SC,Conerly M,Dzieciatkowski S,et al.Aberrant DNA methylation occurs in colon neoplasms arising in the azoxymethane colon cancermodel[J].Mol Carcinog,2010,49(1):94-103.
[13]Sm ith E,De Young NJ,Pavey SJ,et al.Similarity of aberrant DNAmethylation in Barrett'sesophagus and esophageal adenocarcinoma[J].Mol Cancer,2008,7(1):75-87.
[14]Fontemaggi G,Dell'Orso S,Trisciuoglio D,etal.The execution of the transcriptional axismutant p53,E2F1 and Id4 promotes tumor neo-angiogenesis[J].Nat Struct Mol Biol,2009,6(10):1086-1093.

