广西地区宫颈癌患者HPV感染情况分析
叶 健,党裔武,刘琼东,魏 薇,徐春兰,陈 罡,李云娟,罗殿中
(1广西壮族自治区人口和计划生育委员会,南宁 530021;2广西医科大学病理教研室)
宫颈癌的发病率很高[1]。人类乳头状瘤病毒(HPV)具有将正常细胞永生化的能力和高度种属特异性以及特殊嗜上皮性,有 200多种基因型,其中40多种与生殖道疾病相关[2]。根据其致病能力强弱,HPV可以分为高危型和低危型,其中高危型HPV持续感染导致宫颈癌已是不争的事实。近年来发现,采用基因芯片技术检测HPV分型具有敏感性高、特异性强以及高通量等特点,但此技术多应用于新鲜组织或新鲜脱落细胞检测,应用于石蜡包埋标本的检测报道少见。近期我们采用基因芯片技术对广西地区的 163例宫颈癌石蜡包埋组织标本进行HPV亚型检测,探讨该技术应用于HPV临床诊断的可行性以及广西地区宫颈癌患者HPV感染情况及其亚型分布规律。
1 资料与方法
1.1 临床资料 选取广西医科大学第一附属医院病理科 2006~2009年存档的宫颈癌石蜡包埋组织标本共163例,其中鳞癌131例(鳞癌组),腺癌 32例(腺癌组)。163例患者的年龄为 21~73(47.9± 4.3)岁,标本取材前均未行放化疗,均经过HE复查筛选。所有患者均为广西本地患者,祖辈 3代居住于广西。
1.2 HPV检测方法 采用基因芯片技术检测石蜡包埋宫颈癌组织标本中18种高危型HPV(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、83、MM4)和5种低危型HPV(HPV6、11、42、43、44)。HPV分型检测试剂盒为深圳亚能生物技术有限公司产品。阳性对照为该公司提供的HPV52和HPV56合并感染的 2例组织切片,空白对照以蒸馏水替代DNA提取液。严格按试剂盒说明书操作。宫颈癌石蜡组织标本4μm切片5片置EP管底,加入裂解液100μl,100℃水浴10min后立即 13 000 r/m离心10min,取中层DNA液5μl,加入含有通用引物的20μl PCR反应体系进行扩增。扩增条件:50℃15min、95℃10min、94℃30 s、42℃90 s、72℃30 s,40个循环后72℃延伸5 min。将固定了23种探针的膜条标记后与PCR产物一起放入6 ml杂交液A[2×柠檬酸钠缓冲液(SSC),0.1%十二烷基硫酸钠(SDS)]中,100℃变性10 min,后置于51℃杂交箱进行杂交至少 1.5 h,杂交后将膜条置51℃预温的洗涤液B(0.5×SSC+0.1%SDS)漂洗5min,用过氧化物酶溶液(1∶2 000)于室温轻振摇30 min,A液摇洗2×5 min,0.1 M柠檬酸钠液洗涤1~2 min,显色 10~30 min后肉眼判读结果。
每张膜条的内对照(PC)位点出现蓝色圆点即显示该结果为有效结果。本研究的阳性对照为HPV52和HPV 56阳性,阴性对照未见显色。受检样本的阳性在对应的HPV亚型探针位点出现蓝色圆点。
1.3 统计学方法 采用SPSS13.0统计软件,率的比较采用 χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 基因芯片膜条结果 见图1。
2.2 163例宫颈癌组织中HPV感染率 163例宫颈癌组织标本中,HPV阳性155例,感染率为95.1%。其中鳞癌组为98.5%(129/131),腺癌组为81.3% (26/32),两组比较,P=0.000(χ2=12.9)。
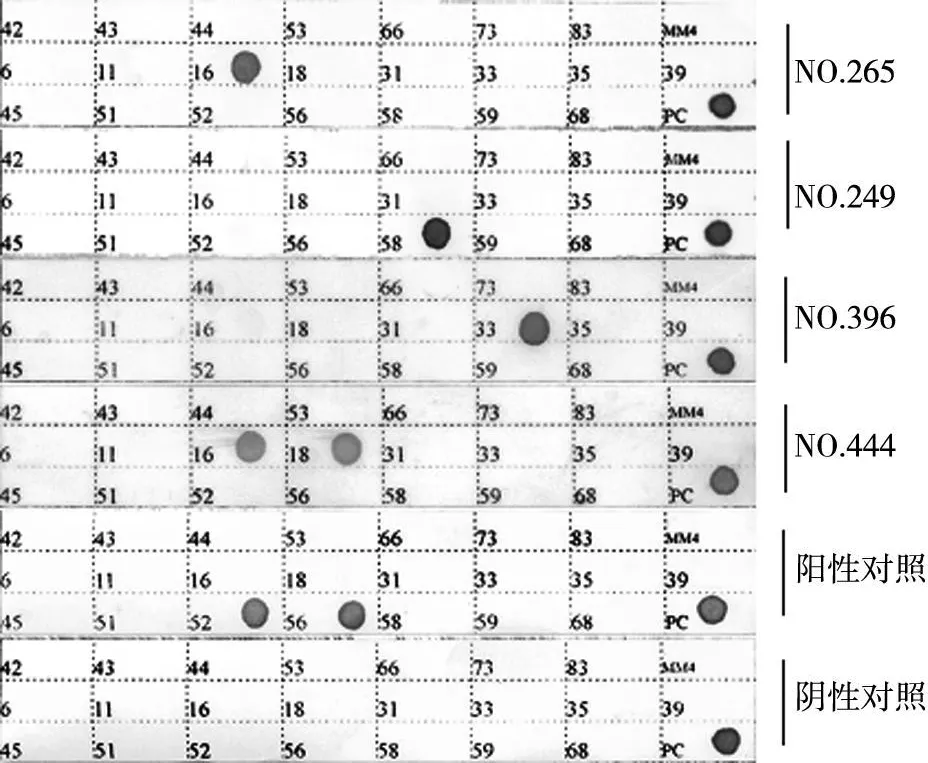
图1 基因芯片膜条结果
2.3 宫颈癌组织中HPV高、低危亚型分布 所有HPV检出病例中未见单一低危型HPV感染,共有3例为低、高危型复合感染,余均为高危型HPV单一感染或者是双重感染。23种 HPV亚型中,共检出16种亚型:HPV6、11、16、18、31、33、35、39、45、52、56、58、59、66、68、73。其中 HPV 16为最常见的感染亚型,HPV 16阳性鳞癌组为103例(78.6%),腺癌组为7例(21.9%),两组比较,P=0.000(χ2= 37.7);HPV18为宫颈癌中第2常见的感染亚型,鳞癌组HPV 18阳性15例(11.5%),腺癌组19例(59.4%),两组比较,P=0.000(χ2=35.8);HPV 16和HPV18之后的感染亚型由高至低依次为鳞癌组:HPV59阳性7例(5.3%),HPV58、HPV33、HPV 31阳性各4例(3.1%),HPV 52、HPV68阳性各3例(2.3%);腺癌组:HPV52阳性2例(6.3%),HPV 35阳性1例(3.1%)。在检出HPV阳性的155例中有128例为单一型感染(82.6%),27例为双重感染(17.4%),未见三重及以上的多重感染,其中鳞癌组单一感染 106例(82.2%),双重感染 23例(17.8%);腺癌组单一感染22例(84.6%),双重感染4例(15.4%),两组比较,P>0.05。在检出的16种HPV亚型中,除 HPV6、11、39、56、68、73为双重感染外,其他亚型均存在单一感染和双重感染。
3 讨论
基因芯片技术集基因扩增和核酸杂交技术于一体,针对HPV E1基因设计通用引物,对目的基因进行PCR扩增,然后与固定在尼龙膜上的23种HPV亚型探针杂交,通过显色直接肉眼判读结果。该方法原理及操作简单,仅需要普通的PCR仪和杂交箱等常用仪器设备即可。但它具有敏感性高,特异性强的特点,且能够一次对常见的23种HPV亚型进行分型,与 PCR需多个独立反应相比,基因芯片对HPV多重感染检测尤显其独到的优势,节约了检测的成本和检测时间,降低了检查费用,若将该技术与临床病理形态学相结合,对宫颈癌的预测以及愈后的评估都具有重要的价值。基因芯片目前大多应用在宫颈脱落细胞HPV检查,被誉为宫颈癌筛查的首选HPV分型检测方法。本研究结果证实,基因芯片技术对宫颈癌石蜡包埋组织中HPV分型检测具有优势,可以作为宫颈癌病理诊断的辅助手段。
本研究结果发现,广西地区 163例宫颈癌石蜡组织中HPV感染率为95.1%,其中鳞癌组感染率为98.5%,腺癌组为81.3%。所有感染病例均可见HPV高危亚型,除了 3例为高、低危亚型复合感染以外,余均为HPV高危亚型单一或双重感染,未见单纯的HPV低危亚型感染。因此,宫颈鳞癌的发生与高危型HPV感染更为密切。与Chen等[3]和Milde-Langosch等[4]的报道相一致。因此我们认为广西地区宫颈癌的发生与HPV感染关系密切。
有研究显示[5],HPV 16是宫颈鳞癌和腺癌的一个重要致病因子,而HPV 18是与腺癌的关系更为密切。本研究发现HPV16和HPV18是广西地区宫颈癌患者HPV感染的最常见亚型。其中宫颈鳞癌与HPV16感染更密切,感染率达78.6%,明显高于腺癌的21.9%(P<0.05);而HPV18与宫颈腺癌更密切,在腺癌中感染率达59.4%,而在鳞癌中HPV18阳性率为11.5%(P<0.05)。因此,HPV16与宫颈鳞癌的发生、HPV 18与宫颈腺癌的发生关系密切。
仅次于HPV16和HPV18的感染亚型在鳞癌组依次为HPV59(5.3%)、HPV58(3.1%)、HPV33 (3.1%)、HPV 31(3.1%)、HPV 52(2.3%),腺癌组依次为HPV52(6.3%)、HPV35(3.1%),两者相比未发现明显规律。这与国内外的一些报道有偏差。非洲、欧洲、南非、北美地区的研究报道[6],HPV16和HPV18同为宫颈癌中最常见的感染型,而位居第3、4位的是 HPV45、31、33;在亚洲,HPV 52、58比HPV45、31或 33更为常见[7,8]。有研究发现[9],辽宁省1 444例宫颈疾病患者中,HPV16、18、58、33、31为最常见感染型。本研究结果中位居第 3位(鳞癌组)的HPV59与众不同,可能正好反映了广西地区宫颈癌患者HPV亚型分布特点,但是由于本研究样本相对较少,不排除本结果所存在的偏差和局限性,不一定能够代表广西区域的整体情况,仅作为一项基础研究,为日后大样本的研究提供参考。
HPV单一感染或多重感染是否与宫颈癌发生相关,报道结果不一致的。陶萍萍等[10]的研究显示,HPV多重感染与宫颈病变呈正相关性,随着宫颈病变级别增加,多重感染率呈增加趋势,此提示机体免疫机制清除病毒不利,是病毒持续感染的危险因素,提示病情进展,更易发展为宫颈癌。另有学者的研究结果却显示[11],随着宫颈病变级别增加, HPV多重感染率趋于下降,且宫颈鳞癌HPV感染倾向于单一高危型。本研究结果显示,全部HPV感染病例均为单一感染和双重感染,且以单一感染为主,未见三重及以上的多重感染,鳞癌组和腺癌组的单一感染和双重感染未见明显规律。HPV各亚型的感染可能与机体免疫密切相关,不同亚型在抵抗机体免疫清除可能存在有相互竞争作用,使其致病能力较强的HPV亚型持续感染,导致宫颈癌的发生。
综上所述,本研究证实基因芯片技术可对宫颈癌石蜡包埋组织切片进行HPV分型检测,具有简便、高通量的特点,可预测宫颈疾病的发生与发展。
[1]Pankin DM,Pisan IP,Ferlay J.Estinates of the world wide incidence of 25major cancers[J].Int Cancer,2007,80(6):827-841.
[2]McLaughlin-Drubin ME,Mǜnger K.Oncogenic activitiesof human papillomaviruses[J].Virus Res,2009,143(2):195-208.
[3]Chen W,Zhang X,Molijn A,et al.Human papillomavirus typedistribution in cervical cancer in China:the importance of HPV 16 and 18[J].Cancer Causes Control,2009,20(9):1705-1713.
[4]Milde-Langosch K,Riethdorf S,L ning T.Association of human papillomavirus infection with carcinoma of the cervix uteri and its precursor lesions:theoretical and practical implications[J].Virchows Arch,2000,437(3):227-233.
[5]Bulk S,Berkhof J,Bulkmans NW,et al.Preferential risk of HPV 16 for squamous cell carcinoma and of HPV18 for adenocarcinoma of the cervix compared to women with normal cytology in the Netherlands[J].Br JCancer,2006,94(1):171-175.
[6]Munoz N,Bosch FX,de-Sanjose S,et al.Epidem iologic classification ofhuman papillomavirus typesassociated with cervical cancer[J].NEJM,2003,348(6):518.
[7]Bao YP,Li N,Sm ith JS,et al.Human papillomavirus type distribution in women from Asia:a meta-analysis[J].Int J Gynecol Cancer,2008,18(1):71-79.
[8]曾莉,郭遂群,云径平,等.广东地区宫颈癌HPV 52型L1基因突变分析[J].广东医学,2007,28(6):906-907.
[9]Liu X,Zhang S,Ruan Q,et al.Prevalence and type distribution of human papillomavirus in women with cervical lesions in Liaoning Province,China[J].Int JGynecol Cancer,2010,20(1):147-153.
[10]陶萍萍,卞美璐,李敏,等.HPV多重感染与宫颈病变关系探讨[J].妇产科临床杂志,2006,7(2):94-96.
[11]Chang DY,Chen RJ,Lee SC,etal.Prevalence of single andmultiple infection with human papillomaviruses in variousgrades of cervicalneoplasia[J].JMed Microbiol,1997,46(1):54-60.

