大鼠心脏插管留置术的探讨
梁成结,钟欢妹,罗灿峤,杨文敏
(1.广州医学院实验动物研究中心;广州 510182;2.增城市人民医院检验科;广州 510095;3.中山大学医学院病理教研室;广州 510089;4.广州市儿童医院 510120)
大鼠心脏插管留置术过程中极易出现如下几个难题,致使实验无法完成:(1)由于所插颈外静脉入口比所用的导管口径还要小,所以要求初学者进行“大管插细管”尤其感到困难。(2)所用的导管应插多深?(3)留置导管设备固定后很易被大鼠破坏。④最关键的是留置管固定后:若方法不当,所固定的管和弹簧极易被大鼠咬断或破坏。即使“插管留置术”固定方法得当,若加药方法不当也可能出现:术后几个小时或超过24h,插入的导管往往只能成为加药的通道,而不能成为抽血的通道,致使检验所需血样本不易获得。
以上5点:只要有一点出现问题,就意味着实验无法进行。本文通过深入探讨这个实验,希望能为“大鼠心脏插管留置术”摸索出一套可行的具体方法,增加其成功率!
1 材料和方法
1.1 材料
1.1.1 实验动物:无特定病原体(SPF)级雄性SD大鼠20只,体重250~300g,由广东省医学实验动物中心提供,动物合格证号0037291、0038975。
1.1.2 实验器材:一次性使用连续硬膜外麻醉导管(广州蓝波医疗器械设备有限公司);消毒手术包;消毒动物血管夹;腰椎穿刺针;三通管[1];弹簧:长40~50cm;直径:0.42cm;弹簧的钢丝直径:0.05cm(广州市越秀区新标力弹簧经管部提供)。非吸收性外科手术缝线规格:2/0(原7#),扩张强度(N)≤14.10。
1.1.3 实验药品:2%戊巴比妥钠(40mg/kg);肝素液125U/mL。
1.2 方法
1.2.1 插管操作方法:20只大鼠全部进行心脏导管插入操作,心脏导管插入管完成后分成2组(导管穿弹簧正内孔组和导管穿弹簧侧边入内孔组)。
操作过程如下:2%戊巴比妥钠(40mg/kg)腹腔注射麻醉,仰卧固定,常规备皮消毒,无菌条件下分离并暴露右颈外静脉约1cm长,用手术缝线结扎颈外静脉远心端,尽量结扎最远端,以便有更长的颈外静脉暴露,便于操作。然后用手稍按心脏位,使心脏血返流到所结扎的血管,反复按心脏几次,返流血最充盈时用动脉夹夹住颈外静脉近心端。血管充盈后静置约5~8min,再用眼科剪剪一V型小口,迅速把直径约1.0mm的一次性使用连续硬膜外麻醉导管插入颈外静脉(插入血管后,配合操作松开动脉夹)约3cm左右进入右心房(经解剖证实),用注射器抽到回血后,结扎固定导管于血管上。顺导管方向,用腰椎穿刺针把导管从大鼠颈背引出,缝合消毒颈下解剖口,导管内注满生理盐水和抗凝剂(图1)。
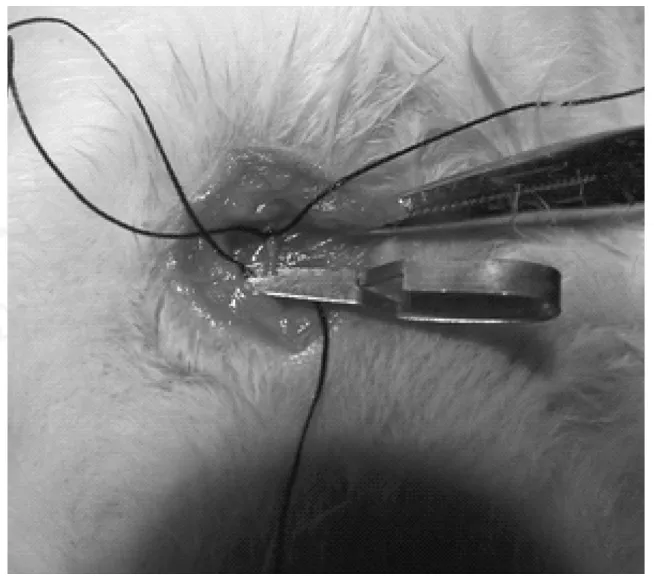
图1 颈外静脉Fig.1 The external jugular vein
1.2.2 插管动物的分组:将完成插管的20雄性大鼠随机分成:导管穿弹簧正内孔组、导管穿弹簧侧边入内孔组,每组10只。导管穿弹簧正内孔:即是导管固定后由颈背部引出,从弹簧内孔中间穿入弹簧内(如图2B所示);导管穿弹簧侧边入内孔组:即是导管固定后由颈背部引出,导管从弹簧一端(离端约0.4处稍分离两弹簧环形成一个“小口”)侧边“小口”进入弹簧穿行(如图2A所示)。
1.2.3 导管穿弹簧正内孔组和导管穿弹簧侧边入内孔组操作:完成心脏导管插管手术后,为了固定导管不被大鼠咬断或用爪拔出,通常用小弹簧把导管套住,再与三通管等相关设备连接。
导管穿弹簧正内孔组:这组动物在完成上述导管插入操作后,将从颈背引出的导管正穿入弹簧内孔,如图2B所示。用用较粗非吸收性外科手术缝线把弹簧与体表皮肤缝合固定,使弹簧与大鼠体表近平行相贴,这样导管穿入弹簧口处就会有一段导管外露。
导管穿弹簧侧边入内孔组:这种固定方法(如图2A所示),在“图2A”箭头处形成弹簧“一长一短”两段,用较粗非吸收性外科手术缝线(规格同上)把弹簧“一长一短”两段紧贴体表皮肤缝合固定。这种方法固定时要把“一长一短”弹簧缝合固定住皮肤,使弹簧更多面积与体表相贴,受力面积更大,更加紧贴皮肤,而且体表弹簧接口处导管不会外露。

图2 两组大鼠导管与弹簧连接比较Fig.2 Comparison of the two routes of catheter insertion into the steel spring.A:Lateral insertion into the spring;B:Direct insertion into the spring.
以上两组模型操作“导管”固定后由颈背部引出,穿过弹簧,弹簧一端固定于颈背部皮肤,另一端固定于饲养笼外的支架上,导管外端接注射帽等设备,术毕用125U/mL肝素液0.2mL保留冲洗导管,封管备用[2]。
2 结果
由表1可见,完成心脏导管插管手术后,导管与弹簧等设备固定时的效果:“导管穿弹簧侧边入内孔组”明显比“导管穿弹簧正内孔组”理想,实验期间“导管穿弹簧侧边入内孔组”设备无一遭到破坏,可顺利采血与加药。经过反复实验证明:这套心脏插管留置术方法是高效可行的。
3 讨论
在研究脓毒症,在进行临床前药理(如抗菌抗内毒素、肾上腺素等)研究中,在进行药代动力学、药效学及疾病发生机制等多方面的研究,经常需要对动物进行多次给药、采血等操作。这种情况,“导管大鼠模型”是最好的解决办法。本实验实际也属于“导管大鼠模型”范畴,本实验的研究目的就是探讨出一套“具体可行”的制作“导管大鼠模型”方法,使更多人掌握这项技术并少走弯路。导管大鼠模型是近年国外开展应用的动物实验模型,具有快捷稳定、使用时间长,具有药品用量少、动物需求量少,数据偏差小,实验结果重复性好、节约时间等优点。[3]
由于专门介绍如何“大鼠心脏的导管插管留置术”的文章太少,甚至查不到。所以有必要对该术式的细节进行探讨。
首先,导管从颈外静脉插入右心房,其深度约为导管自身3刻度格左右(每格1cm),即约3cm左右。由于插入导管的深度与大鼠体重有关,通常大鼠的体重在250~300g时,所插入要求的深度大约是3cm,同时这样体重大鼠的血管相对也粗些——导管易插入,实验操作也相对容易。当然大鼠的体重与年龄由实验需要而定,当大鼠体重在200g以下时,血管相对小些,心脏导管插入难度加大,所插入深度也相对浅些。因而对于不同体重的大鼠,行导管插入术之前须经解剖实验确定插入的深度。
其次,插入导管前必须充盈静脉血管约5~8min(操作方法即文章的前面的“插管操作方法”)。这是由于颈外静脉血管相对小而导管大,导管很难插入。实验证明这种短时充盈血管的方法可使导管较易插入右心房,而且值得注意的是:用眼科剪剪开颈外静脉血插入口时,一定要迅速把导管插入血管,否则血管会很快收缩,导管难以插入。
再次,两组大鼠导管固定方法的优缺点比较:
导管穿弹簧正内孔组:这种弹簧固定法(如图2B所示),弹簧与大鼠紧贴体表固定时,受力面不够大,且接口处导管有一小段外露,固定程度远没有“一长一短”缝合固定好。有些人处理弹簧与导管连接时,通常还有两种情况:1)弹簧与大鼠体表有个较大的夹角,受力点集中在一点上,严重影响大鼠的自由活动,同时固定不良,极易被大鼠破坏;2)只用弹簧简单套住导管无缝线固定,则弹簧极易随着大鼠活动而移位,导管外露,从而易被大鼠抓坏或咬坏。这三种情况:设备极易受到大鼠咬坏或用爪抓坏(咬断导管或把导管拔出);或弹簧接触点受力不均,影响大鼠活动等,可至实验无法进行下去。

表1 两组大鼠导管固定时不同方法比较Tab.1 Comparison between the two groups of rats with different methods of catheter fixation
导管穿弹簧侧边入内孔组操作:这种方法(如图2A)可使弹簧紧贴体表,导管不外露,导管进入弹簧接口处使弹簧形成的“一长一短”两端与体表皮肤缝合固定非常牢固,弹簧导管设备不容易被大鼠破坏。经过多次实验,设备未曾被大鼠咬坏或抓坏。由于弹簧紧贴大鼠体表,受力面积大且较均匀,最大程度减少大鼠对弹簧等设备在体表连接的不适,所以大鼠自由活动性好。
最后,当留置导管多次采血时,在每次抽完血后,必须用生理盐水抗凝剂配液冲洗导管,否则就会出现采血不畅的现象。这是由于每次抽完血后,导管内必留有血液,若无进行生理盐水抗凝剂配液冲洗导管,导管内血液极易出现凝固,赌塞导管通道。
综上所述:本实验提倡的“导管穿弹簧侧边入内孔组”,操作起来每一步思路及注意事项都非常清楚,常人很快就会操作,具有成功率高等优点。但本实验在导管插入心脏前的准备工作所需时间还有待缩短。
[1]杨文敏,曾其毅.肾上腺素对内毒素致大鼠炎症性肝损害的保护作用[J].中国循证儿科杂志2007,12(04):276-281.
[2]王宁,郑江,郭毅斌,等.心导管留置术对大鼠脏器功能影响的实验研究[J].第三军医大学学报,2006,(14):1473-1475.
[3]Beno DW,KimuraRE.Nonstressed rat model ofacute endotoxemia that unmasks theendotoxin-inducedTNF-alpha response[J].Am J Physiol,1999,276(2 Pt2):H671-H678.
[4]徐叔云.药理学实验方法[M].北京:人民卫生出版社.1991:546.

