抑制肿瘤生长活性的内皮生长抑制剂EDI-8t
周庆玮,杜鹏,钱悦,张倩,冯宝山,丁红珍,甘人宝,张辉
上海普洛康裕药物研究院有限公司,上海 201314
抑制肿瘤生长活性的内皮生长抑制剂EDI-8t
周庆玮,杜鹏,钱悦,张倩,冯宝山,丁红珍,甘人宝,张辉
上海普洛康裕药物研究院有限公司,上海 201314
对内源性的内皮生长抑制剂的序列来源分析后,用RT-PCR方法从人脐带中获得了417 bp的cDNA,并克隆到毕赤酵母表达载体pPIC9,然后转化毕赤酵母GS115获得重组表达菌株。表达菌株通过甲醇诱导表达后,将发酵液通过分离纯化获得重组蛋白纯品,命名为EDI-8t。体外实验结果表明,这个胶原蛋白VIII来源的rhEDI-8t蛋白能特异性地抑制牛主动脉内皮细胞的增殖和迁移,并能引起内皮细胞的凋亡。动物体内实验结果表明,rhEDI-8t蛋白样品可有效抑制裸鼠皮下肝癌肿瘤的生长,抑制效果和参照品endostatin相同。但在小鼠黑色素瘤肺转移模型中,rhEDI-8t显示了高于参照品的抑癌效果。
内皮细胞生长抑制剂,EDI-8t,肿瘤
肿瘤可以看作是一个异常生长的无序器官,也需要血管为之提供养分,运走代谢废物,否则肿瘤就不能迅速地生长[6-7]。肿瘤的生长和迁移与血管生长密切相关,研究结果表明,肿瘤直径达到1~2 mm时如果没有相应的血管生成提供养料便停止生长[8];血管生长对于肿瘤的转移也很重要,为肿瘤细胞离开原发癌组织进入循环系统提供了有效的路径;对于具有转移性的癌来说,减少其血管生成可减少进入循环系统的细胞数目进而减少转移癌的数目[9]。因此可以通过抑制血管生成来抑制实体瘤的生长,这为治疗肿瘤提供了一种新的思路,常被形象地称作“饿死癌细胞”的疗法[10]。这种新思路相比以前的各种肿瘤治疗方法具有许多优点,它具有广谱的治疗范围,对绝大多数肿瘤的生长都有效,且不容易产生抗药性[11]。
根据已发现的来源于胶原蛋白非胶原结构域的血管生成抑制剂,我们推测胶原蛋白VIII的NC1结构域可能也具有血管生成抑制活性。因此我们设计了引物,利用 RT-PCR方法,扩增出胶原蛋白 VIII的 NC1结构域的 cDNA,克隆入真核表达载体pPIC9,诱导表达后利用Ni-NTA亲和柱纯化出重组蛋白,并命名为内皮细胞生长抑制剂-8t (EDI-8t) (图1)。EDI-8t全长435 bp,编码145个氨基酸 (含6×His tag) (图2),分子量16 kDa,含2个半胱氨酸,可形成 1对二硫键。我们的研究结果表明,rhEDI-8t蛋白在体外可特异性地抑制内皮细胞的增殖和迁移,并可诱导内皮细胞发生凋亡;在体内,重组蛋白相比对照组可显著减缓裸鼠体内肿瘤的生长速度。
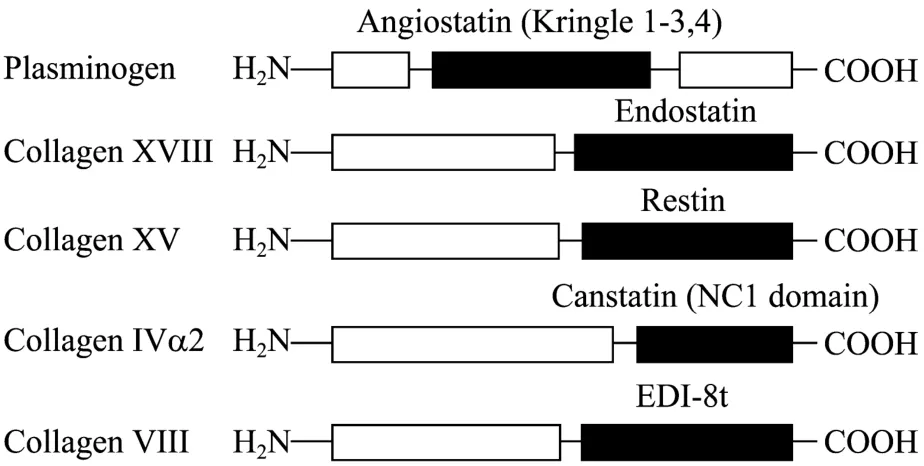
图1 内源蛋白来源的新生血管抑制剂Fig. 1 Endothelial genesis inhibitor derived from endogenous protein.

图2 EDI-8t DNA序列 (A) 和氨基酸序列 (B)Fig. 2 DNA sequence (A) and the amino acid sequence (B) of EDI-8t.
1 材料与方法
1.1 引物
用于扩增编码EDI-8t基因片段的引物序列:引物1,ATCGCTCGAG AAAAGAGAGGCTGAAGCT GGCAAGAATGGAGGGCCA (下划线部分为引入的Xho I酶切位点);引物2,ATCGAATTC ATTAGTGA TGGTGATGGTGATGCATGGGATACAATAAATA (下划线部分为引入的EcoR I酶切位点),斜体部分为引入的6×His tag。以上引物均由上海生工生物工程有限 (Sangon) 公司合成。DNA测序由上海英骏生物技术有限公司完成。
1.2 酶与试剂
限制性内切酶、T4 DNA连接酶购自TaKaRa公司;DNA分子量标准、Taq酶及反转录试剂盒购自天根公司;RNA抽提试剂Trizol购自Gibco BRL公司;毕氏酵母转化及表达试剂盒购自 Invitrogen公司;镍离子亲和柱购自Pharmacia公司;酵母氮碱(含硫酸铵/无氨基酸) 购自 Difco公司;酵母抽提物购自Oxoid公司;蛋白胨购自Nihon Seiyaku公司;其余试剂均为国产分析纯。Endostatin标准品购自PEPROTECH公司。动物实验阳性对照品:恩度 (Endostar,重组人血管内皮抑制素注射液,15 mg/3 mL/支,山东先声麦得津生物制药有限公司生产),购自上海市肿瘤医院。
1.3 菌株、质粒、细胞株和实验动物
大肠杆菌Top10F′、毕氏酵母 GS115以及表达载体pPIC9均购自 Invitrogen公司。牛主动脉内皮细胞BAEC、小鼠成纤维细胞Balb/3T3及肝细胞癌HepG2细胞株为本室自存。肝癌细胞BEL-7404、小鼠黑色素瘤细胞B16由上海医药工业研究院药理室保存。BALB/C裸鼠 (SPF级)、C57BL/6小鼠购自上海斯莱克实验动物责任有限公司。
1.4 重组表达载体构建
取新鲜人脐带,用Trizol法抽提总RNA。以此为模板,用天根公司反转录试剂盒和引物1、2进行RT-PCR。PCR产物用Xho I和EcoR I双酶切后,和同样酶切处理的pPIC9载体用T4 DNA 连接酶连接,16℃过夜,连接产物转化Top10F′感受态细胞,涂板氨苄平板,37℃培养过夜。筛选阳性克隆后经测序验证,获得阳性重组质粒。
1.5 重组载体在毕赤酵母中的表达和分离纯化
将上述重组质粒pPIC-EDI-8t用Bgl II酶切后抽提,电转化毕赤酵母表达菌株GS115,将转化产物涂布MD平板,30℃培养3~5 d。PCR鉴定重组表达菌株,获得阳性克隆后通过摇瓶筛选获得重组表达菌株。
摇瓶诱导的培基和条件参照表达试剂盒说明书。发酵条件如下:挑取在YPD平板上活化的转化子单克隆接入种子培养基 (每升含13.4 g酵母氮碱,10 mL甘油,0.4 mg生物素,100 mL 1mol/L磷酸缓冲液 (pH 6.0),酵母粉10 g,蛋白胨20 g),30℃培养过夜,按 7%转接入发酵培养基中 (每升中含18.2 g K2SO4,7.45 g MgSO4,0.93 g CaSO4,26.7 mL 85% H3PO4,4.13 g KOH,40 g甘油,用28%氨水调节 pH至 5.0,加入 4.35 mL PTM1溶液) (每升PTM1中含65 g FeSO4·7H2O,6 g CuSO4·5H2O,20 g ZnSO4,3 g MnSO4,5 mL H2SO4,0.2 g HBO3,2 g NaMoO4,0.8 g KI,0.2 g生物素)。发酵过程中温度控制在30℃,pH为5.0,通气量在1~1.5 vvm。培养约17 h后开始流加甲醇和LB,流加速度通过甲醇电极和溶氧振荡控制,保持甲醇浓度在3~8 g/L,诱导约60 h后放罐。发酵液经离心弃沉淀后,用截留分子量为100 K和10 K的超滤膜进行超滤浓缩,超滤液调NaOH调pH至8.0,加入Tris-HCl,NaCl至终浓度为20 mmol/L和0.5 mol/L,过滤后上Ni Sepharose 6 Fast Flow进行柱层析,收集20 mmol/L Tris-HCl (pH 8.0),0.5 mol/L NaCl,250 mmol/L咪唑洗脱组分,稀释10倍后,用Q sepharose Fast Flow进行纯化,缓冲液为 50 mmol/L,硼砂-氢氧化钠(pH 10.0),收集 1 mol/L NaCl洗脱组分,再用Sephadex G-25进行脱盐,缓冲液为 10 mmol/L的Tris-HCl (pH 8.9)。收集组分用C8反相HPLC分析纯度。
1.6 重组蛋白体外活性研究
1.6.1 抑制内皮细胞生长检测
3~5代的牛主动脉内皮细胞 (BAEC) 培养于DMEM+10% FBS中。按3 000 个细胞/孔接种于96孔板中,待2~3 h细胞贴壁后,吸去培养基。加入100 μL含2% FBS的DME,分别加入样品和对照品至不同的待测浓度。37℃孵育1 h,补加含有碱性成纤维细胞生长因子的DMEM+2% FBS 100 μL使bFGF终浓度为5 μg/L,37℃培养3 d。每孔加入10 μL 10 g/L的MTT (噻唑蓝),37℃放置4 h,吸去180 μL培养基,加入50 μL二甲基亚砜,振荡溶解后测定A570。
1.6.2 促内皮细胞凋亡的检测
将内皮细胞以一定的比例接种到 60 mm培养皿,等细胞贴壁后用DMEM+2% FBS的培养基培养24 h。吸去培养基,加入含 20 μg/mL蛋白样品(Endostatin) 的培养基,DMEM+10% FBS培养24 h。PBS清洗细胞1次,胰酶消化细胞;离心取细胞,PBS清洗 1次;离心取细胞,加入 1×结合缓冲液,再离心,在细胞中加入200 μL的1×结合缓冲液。加入1 μL的ApoAlert Annexin V-FITC (终浓度为0.5 μg/mL),在黑暗处放置10 min后加入10 μL PI (500 μg/mL)。流式细胞仪测定及数据处理由中国科学院生化细胞研究所流式细胞仪实验室完成。
1.6.3 促内皮细胞迁移的检测
将6孔Transwell上的膜用明胶包被1 h,把牛主动脉细胞按1.0×105接种在上层培养皿,培养2 h等待细胞贴壁。然后在上层培养基中加入重组蛋白(20 μg/mL) (n=2),对照组加入等体积PBS,在下层培养基中加入bFGF (10 μg/mL)。37℃培养12 h后将膜取出,PBS清洗2遍,加入甲醇固定15 min,再用PBS清洗1遍,利用棉签刮去膜上表面的细胞,这样只剩下迁移到膜下层的细胞,再利用Gimsa染料染色30 min,大量水冲洗后在显微镜下拍照、观察计数。
1.7 重组蛋白体内活性研究
1.7.1 人体肝癌BEL-7404裸鼠实验
取液氮冻存的人体肿瘤肝癌BEL-7404细胞株,复苏后,置于37℃、5% CO2条件下培养。经传代培养后,取对数生长期的细胞,用生理盐水制备成浓度为1×107~2×107细胞/mL的细胞悬液,接种于裸鼠右腋皮下。无菌条件下取体内生长旺盛人体肿瘤肝癌BEL-7404第2代异种移植模型的肿瘤组织,制备成约2 mm3瘤块,于裸鼠右腋皮下接种一块,待肿瘤生长至约100 mm3后,随机分组。所应用的饲料、垫料、笼具及接触的器械等均高压消毒后使用,裸鼠置于层流架中饲养。rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照 it×24qd (皮下连续注射 24 d) 方案给药,空白对照组注射对照溶剂 (10 mmol/L PB)。观察和测试肿瘤大小及荷瘤鼠体重,每 4天用卡尺测量各裸鼠肿瘤的短径 (a)及长径 (b),按(a2×b)/2公式计算肿瘤体积。根据测量计算的肿瘤体积计算出相对肿瘤体积 (RTV),RTV=Vt/V0。其中V0为随机分组 (即d0) 时的肿瘤体积,Vt为每一次测量 (即 dn) 时的肿瘤体积。实验结束时,处死各组动物,剖取肿瘤称重,按下列公式计算肿瘤抑制率及相对肿瘤增长率:
肿瘤抑制率 (%)=(对照组平均瘤重−给药组平均瘤重)/对照组平均瘤重×100%。
相对肿瘤增殖率 (%)=(给药组 RTV/对照组RTV)×100%。
1.7.2 B16小鼠黑色素瘤肺转移模型实验
取液氮冻存的B16小鼠黑色素瘤培养细胞株,复苏后,置于37℃、5% CO2条件下培养。经传代培养后,无菌条件下取对数生长期的B16小鼠黑色素瘤培养细胞,制备成约2.5×105/mL细胞悬液,于C57BL/6小鼠尾静脉接种0.2 mL/鼠。rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照 it×27qd (静脉连续注射27 d) 方案给药,空白对照组注射对照溶剂 (10 mmol/L PB)。实验结束时,处死各组动物,剖取各组小鼠的肺脏,计测每鼠肺脏所转移的集落数,以各组肿瘤平均集落数,按下列公式计算肿瘤抑制率:
肿瘤抑制率 (%)=(对照组平均集落数−给药组平均集落数)/对照组平均集落数×100%。
以上 2个肿瘤模型实验由上海医药工业研究院完成。
2 结果
2.1 重组载体的构建
根据已发现的来源于胶原蛋白非胶原结构域的血管生成抑制剂,我们推测胶原蛋白VIII的NC1结构域可能也具有血管生成抑制活性。设计了引物,提取脐带 RNA后通过 RT-PCR获得的 rhEDI-8t cDNA,如下图3所示。用Xho I和EcoR I酶切后,与经同样酶切处理的pPIC9载体连接,获得重组表达,经测序表明序列正确 (数据未显示)。
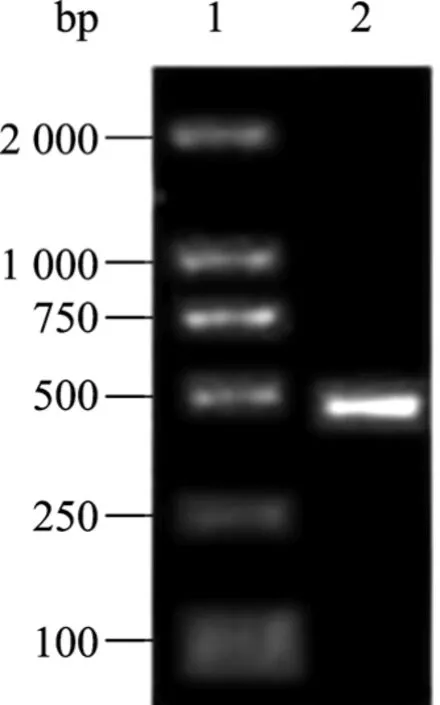
图3 RT-PCR获得的EDI-8t cDNAFig. 3 Isolation of EDI-8t cDNA by RT-PCR. 1: DNA molecular marker. 2: EDI-8t cDNA.
2.2 重组蛋白的发酵和纯化
将上述重组质粒转化毕赤酵母表达菌株GS115,获得重组表达菌株。经甲醇诱导发酵后,将发酵液离心,超滤,在碱性条件下进行镍柱亲和层析、阴离子交换、凝胶过滤,最终得到的目的蛋白如图 4所示。经分子量测定结果表明表达的目的蛋白中含极少量的二聚体,和Western blotting结果一致 (数据未显示)。

图4 rhEDI-8t蛋白纯品的SDS-PAGE电泳图Fig. 4 SDS-PAGE analysis of purified rhEDI-8t.
发酵上清样品经纯化后,用C8反向柱分析EDI-8纯度。A液:0.1% TFA;B液:0.1% TFA+100%甲醇,梯度0~100%,时间20 min,结果如下图5所示,按峰面积积分计算纯度为97.9%。
2.3 体外活性研究
用牛主动脉内皮细胞 (BAEC) 来测定 EDI-8t样品的生物活性[12],发现20 μg/mL rhEDI-8t加药培养72 h后,BAEC细胞形态发生明显变化,大量细胞回缩变圆 (结果未显示);加药后还可特异性抑制bFGF诱导的 BAEC细胞的生长 (图 6A),抑制活性和endostatin标准品相同。但rhEDI-8t蛋白对成纤维细胞Balb/c 3T3和肝癌细胞BEL7404的生长没有影响 (图6B)。说明和endostatin一样,EDI-8t只特异性地作用于内皮细胞,对其他正常细胞的生长没有影响。
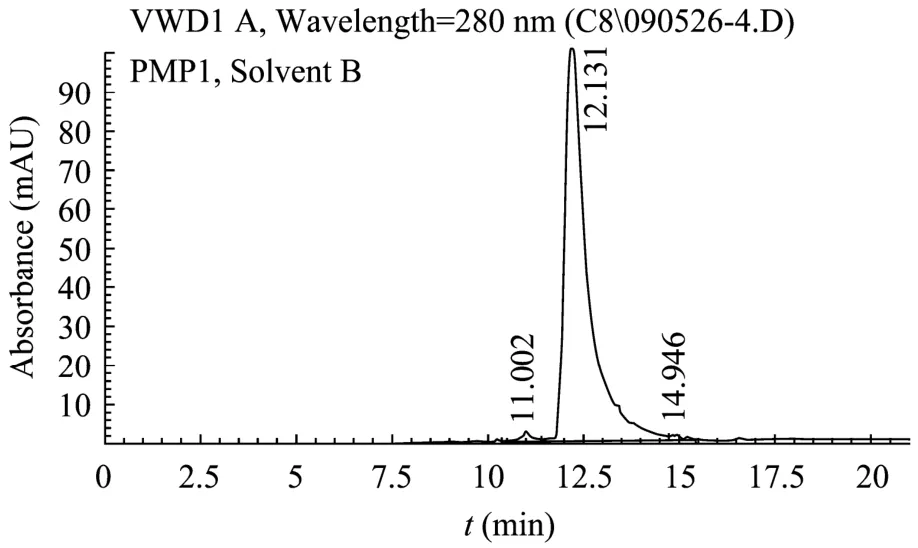
图5 rhEDI-8t纯化样品的HPLC纯度分析图Fig. 5 Purity of rhEDI-8t analyzed by HPLC.
另外,我们用Transwell实验测定了 EDI-8t对内皮细胞迁移的影响,孔内加入细胞和EDI-8t样品(对照组孔内只加细胞),孔下方加入bFGF,在bFGF的诱导下内皮细胞将通过孔膜上的孔迁移到膜的下方。如图7所示,EDI-8t可显著抑制内皮细胞的迁移,6.25、25 μg/mL EDI-8t加药培养18 h后,相对空白对照组加药组迁移的细胞量大大减少。
用流式细胞仪检测细胞凋亡率,发现相比空白对照组20 μg/mL加药后细胞大量发生凋亡,凋亡率由5.7%增加到41.38% (图8)。
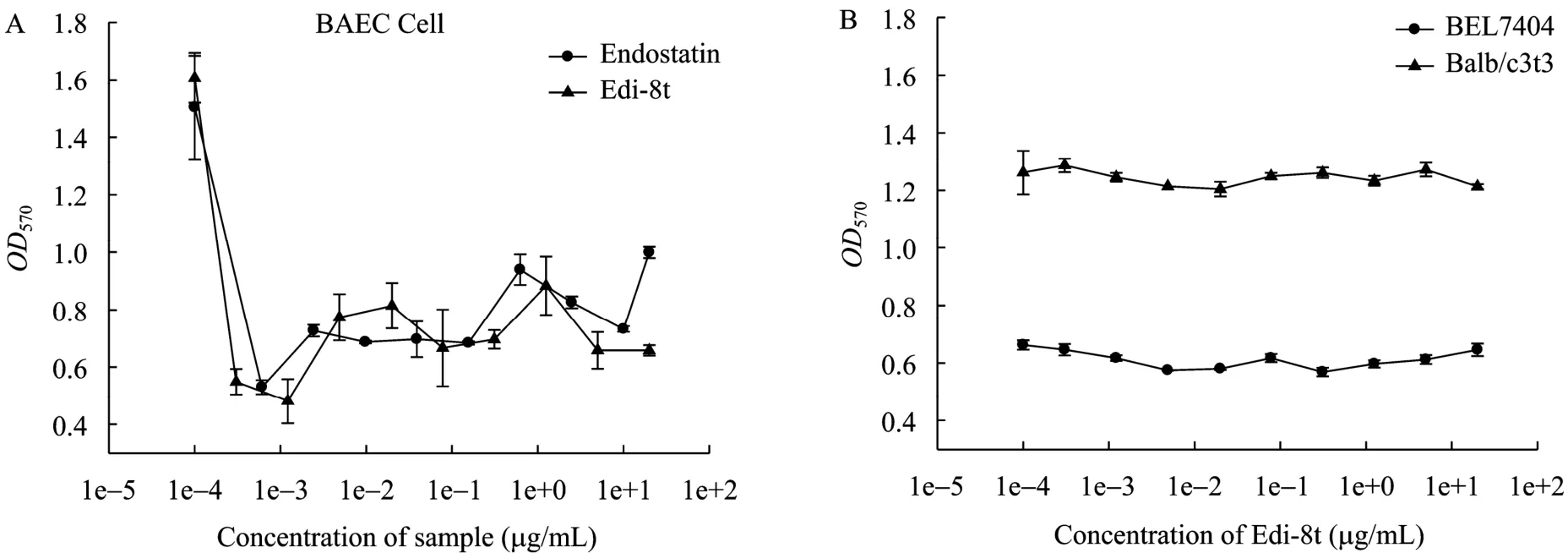
图6 rhEDI-8t蛋白对内皮细胞 (A) 和成纤维细胞、肝癌细胞 (B) 生长的影响Fig. 6 Effect of rhEDI-8t on the growth of endothelial cell (A) fibroblast cell and liver cancer cell (B).
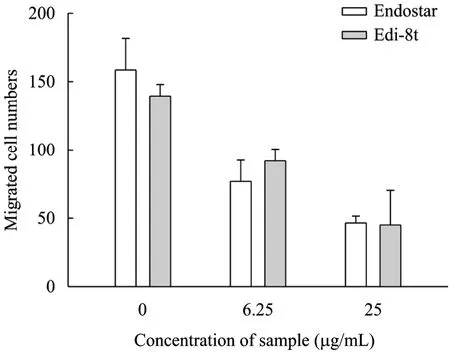
图7 rhEDI-8t蛋白纯品对内皮细胞迁移的抑制Fig. 7 rhEDI-8t inhibited the migration of endothelial cell.
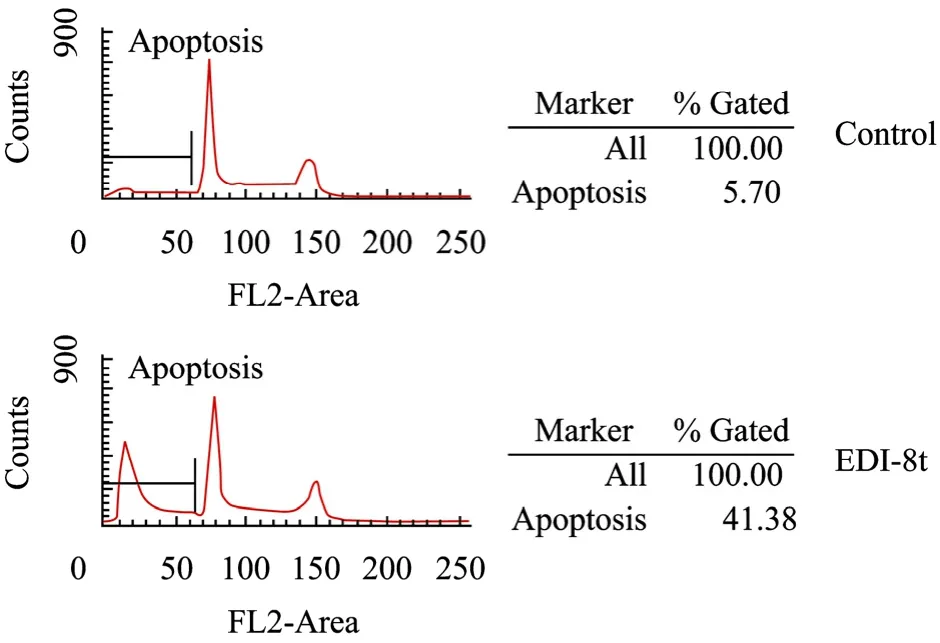
图8 rhEDI-8t蛋白纯品促使内皮细胞发生凋亡Fig. 8 rhEDI-8t cause apoptosis of endothelial cell.
2.4 体内活性的研究
2.4.1 rhEDI-8t对异种移植于裸鼠的人体肿瘤肝癌生长的影响
rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照 it×24qd方案给药,对移植于裸鼠的人体肝癌 BEL-7404的相对肿瘤增殖率分别为24.67%、33.11%、41.98%。阳性对照组恩度(重组人血管内皮抑制素注射液) 以20 mg/(kg·d) 剂量,按照 it×24qd方案给药,相对肿瘤增殖率为30.84%。实验结果详见表1和图9。
rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照it×24qd方案给药,对移植于裸鼠的人体肝癌 BEL-7404的肿瘤抑瘤率分别为53.81%、51.08%、24.46%。阳性对照组恩度以20 mg/(kg·d)剂量,按照it×24qd方案给药,抑瘤率为51.65%。实验结果详见表1、图9。
实验过程中肿瘤动态变化见表 2、图 10。rhEDI-8t样品的溶剂对照组的瘤重 (解剖时平均瘤重 (1.39±0.19) g) 与PBS对照组的瘤重 (解剖时平均瘤重 (1.40±0.23) g) 无明显差异。
2.4.2 rhEDI-8t对动物肿瘤B16黑色素瘤肺转移生长的影响
以50、20、5 mg/(kg·d) rhEDI-8t的剂量对动物肿瘤B16黑色素瘤静脉接种肺转移的实验显示了一定的抗肿瘤疗效,其肺肿瘤集落的抑制率分别为35.08%、27.02%、19.24% (表3)。而阳性对照组恩度以20 mg/(kg·d) 剂量对肺肿瘤集落的抑制率仅为9.8%。

图9 rhEDI-8t样品人体肿瘤肝癌BEL-7404抗肿瘤疗效肿瘤实像Fig. 9 Tumors from the nude mouse transplanted with human liver cancer call BEL-7404 after therapy.
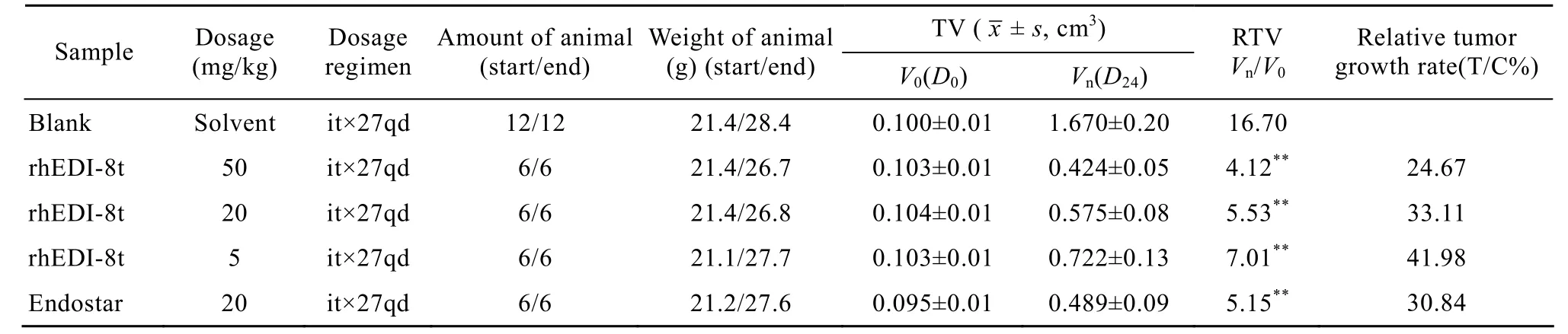
表1 rhEDI-8t样品对移植于裸鼠的人体肿瘤肝癌BEL-7404的抗肿瘤疗效 (以肿瘤相对增长率统计)Table 1 Effect of rhEDI-8t on the growth of human liver cancer call BEL-7404 transplanted to nude mouse (by tumor relative growth rate)
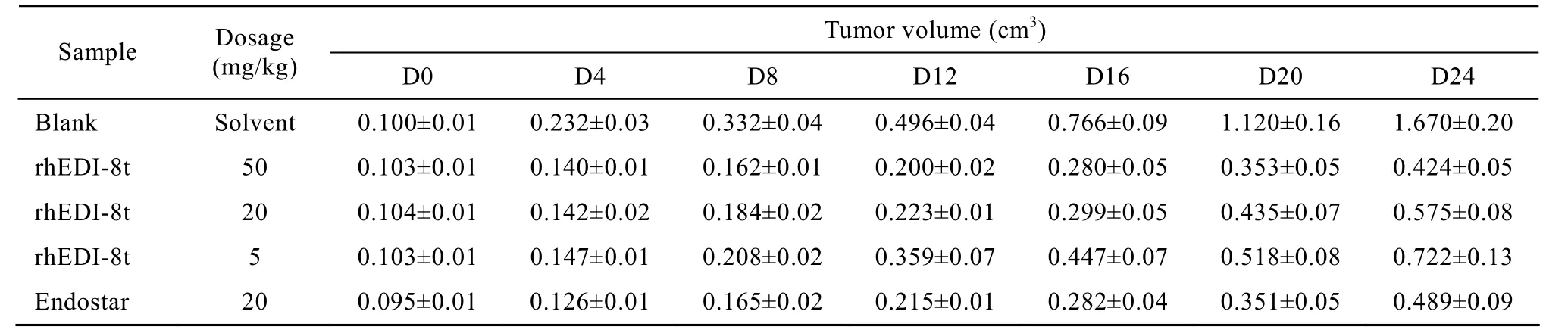
表2 rhEDI-8t样品对移植于裸鼠的人体肿瘤肝癌BEL-7404的抗肿瘤疗效中肿瘤动态变化Table 2 Effect of rhEDI-8t on the growth of human liver cancer call BEL-7404 transplanted to nude mouse (by tumor volume)
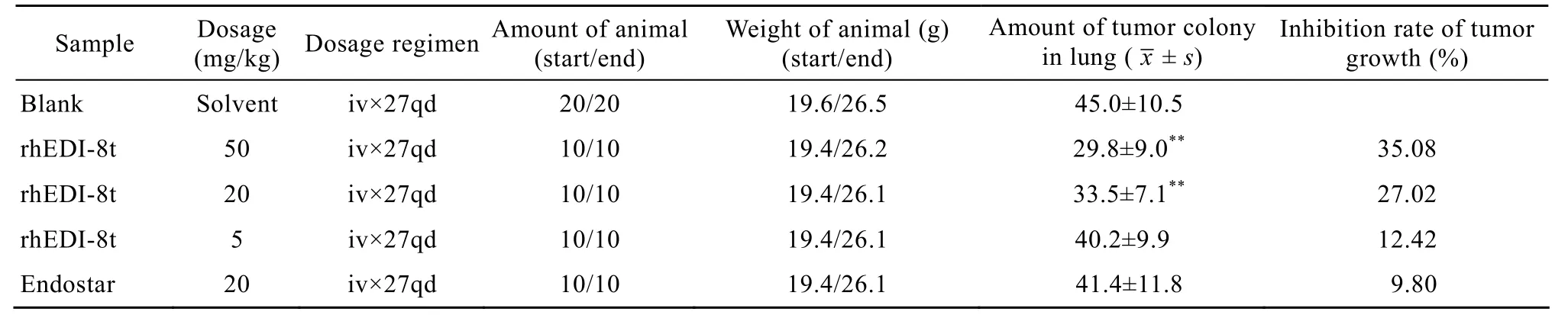
表3 rhEDI-8t样品对动物肿瘤B16黑色素瘤静脉接种肺转移的试验 (以肺肿瘤集落计算)Table 3 Effect of rhEDI-8t on the transfer of tumor in metastatic model of melanoma in mice (by amount of colonies produced in the lung)
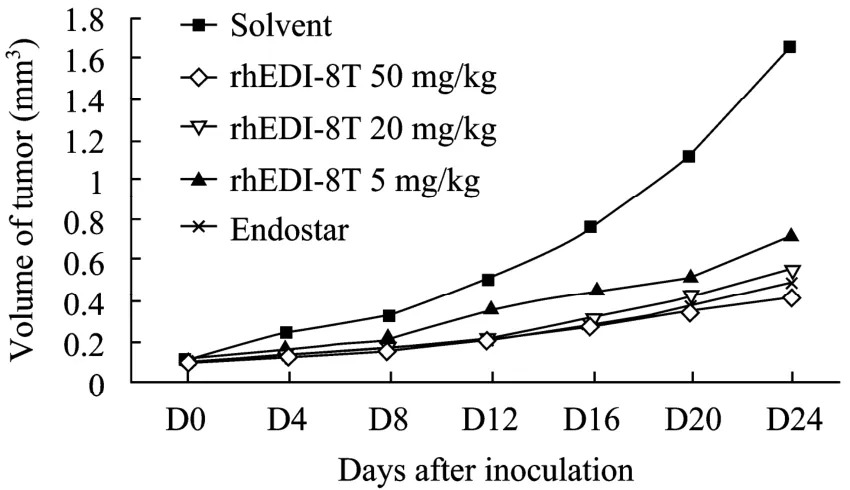
图10 rhEDI-8t蛋白纯品对裸鼠表皮接种的肝癌细胞生长速度的影响Fig. 10 Effect of rhEDI-8t on the growth rate of human liver cancer call BEL-7404 transplanted to nude mouse.
3 结论
根据已发现的来源于胶原蛋白非胶原结构域的血管生成抑制剂,我们推测胶原蛋白VIII的NC1结构域可能也具有血管生成抑制活性。据此通过RT-PCR方法获得了基因片段,命名为 EDI-8t,并克隆到毕赤酵母表达载体。毕氏酵母作为新近发展起来的表达宿主,具有发酵上清液中杂蛋白少、可以高菌密度发酵、遗传学稳定等优点[13]。我们将重组表达载体转化毕赤酵母后诱导分泌表达,将发酵液通过分离纯化获得蛋白纯品。经过连续多批次样品纯度分析均大于95% (数据未显示),分离纯化工艺非常稳定。体外实验中我们最初使用市售药恩度(Endostatin) 作为对照蛋白,但是没有检测到恩度对内皮细胞生长的影响 (数据未显示),因而我们选择了Peprotech公司生产的endostatin标准品最为对照蛋白。我们发现重组蛋白能特异性地抑制内皮细胞的生长和迁移,并引起内皮细胞凋亡,抑制效果与endostatin相当。
初步的体内实验结果表明:rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照it×24qd方案给药,对移植于裸鼠的人体肿瘤肝癌BEL-7404的生长有明显抑制作用,阳性对照恩度以20 mg/(kg·d)剂量,按照it×24qd方案给药,也同样显示了明显的抑瘤作用。在这个模型中,EDI-8t显示了与对照品恩度相当的抑癌活性。但在小鼠肿瘤B16黑色素瘤肺转移模型中,EDI-8t显示了和对照品恩度截然不同的抑癌活性。rhEDI-8t样品以50 mg/(kg·d)、20 mg/(kg·d)、5 mg/(kg·d) 剂量,按照 iv×27qd方案给药,显示了具有一定量效关系的抑癌活性,且抑制效果明显高于对照品恩度。这些数据显示rhEDI-8t蛋白可有效抑制裸鼠体内肝癌肿瘤的生长,尤其是可明显抑制肺部转移肿瘤的生长,抑制率高于市售同类药物恩度。尽管动物实验结果显示了 EDI-8t高于恩度的抗癌活性,但是 EDI-8t相比细胞毒药物DDP的抗癌活性还是相差不少 (数据未显示)。目前临床上一般将恩度与化疗药物 (如顺铂) 或放疗联和使用治疗肿瘤病人,联合用药相比单用可大大增加临床治疗效果[14-18]。
以上结果表明,rhEDI-8t具有良好的体内外活性,动物实验的结果优于同类上市药物恩度,具有潜在的临床应用价值和药用开发潜力,为以后进一步研究EDI-8t蛋白的应用提供了方向。
致谢:上海医药工业研究院药理试验室李炳生老师、陆宏祺老师协助完成论文中的动物实验,对此深表感谢!
REFERENCES
[1] O'Reilly MS, Holmgren L, Shing Y, et al. Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a lewis lung carcinoma. Cell, 1994, 79(2): 315−328.
[2] O'Reilly MS, Boehm T, Shing Y, et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth. Cell, 1997, 88(2): 277−285.
[3] Ramchandran R, Dhanabal M, Volk R, et al. Antiangiogenic activity of restin, NC10 domain of human collagen XV: comparison to endostatin. Biochem Biophys Res Commun, 1999, 255(3): 735−739.
[4] Kamphaus GD, Colorado PC, Panka DJ, et al. Canstatin, a novel matrix-derived inhibitor of angiogenesis and tumor growth. J Biol Chem, 2000, 275(2): 1209−1215.
[5] Sage EH. Pieces of eight: bioactive fragments of extracellular proteins as regulators of angiogenesis. Trends Cell Biology, 1997, 7(5): 182−186.
[6] Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med J, 1995, 1(1): 27−30.
[7] Madri JA, Williams SK. Capillary endothelial cell cultures: phenotypic modulation by matrix components. J Cell Biol, 1983, 97(1): 153−165.
[8] Folkman J. What is the evidence that tumors are angiogenesis dependent? J Natl Cancer Inst, 1990, 82(1): 4−6.
[9] Zetter BR. Angiogenesis and tumor metastasis. Annu Rev Med, 1998, 49: 407−424.
[10] Folkman J. Tumor angiogenesis: therapeutic implications. J N Eng J Med, 1971, 285(21): 1182−1186.
[11] Twardowski P, Gradishar WJ. Clinical trials of antiangiogenic agents. Curr Opin Onco, 1997, 9(6): 584−589.
[12] Xin L, Zhang L, Xu R, et al. Expression of human angiostatin in Pichia pastoris and the detection of its anti-angiogenic activity. Acta Biochimica Et Biophysica Sin, 2001, 33(3): 291−295.辛利, 张励, 徐韧, 等. 人血管抑素在毕氏酵母中的表达及其活性测定. 生物化学与生物物理学报, 2001, 33(3): 291−295.
[13] Romanos M. Advances in the use of Pichia pastoris for high-level gene expression. Curr Opin Biotech, 1995, 6(5): 527−533.
[14] Luo XH, Liu W. Endostar. 2006, 15(21): 1893−1895.罗兴洪, 刘武, 恩度. 中国新药杂志. 2006, 15(21): 1893−1895.
[15] Wang JY, Sun Y, Liu YY, et al. Results of randomized, multicenter, double-blind phase Ⅲ trial of rh -endostatin (YH-16) in treatment of advanced non-small cell lung cancer patients. Chin J Lung Cancer, 2005, 8(4): 283−290.王金万, 孙燕, 刘永煜, 等. 重组人血管内皮抑素联合NP方案治疗晚期NSCLC随机、双盲、对照、多中心Ⅲ期临床研究. 中国肺癌杂志, 2005, 8(4): 283−290.
[16] Shi HL, Xu LY, Liu Z. Phase Ⅱ clinical trial of homemade human rh-endostatin in the treatment of patients with stageⅢ B-Ⅳ non-small cell lung cancer. Chin J Lung Cancer, 2004, 8(7): 325−328.史鹤玲, 徐丽艳, 刘哲, 重组人血管内皮抑制素(YH-16) 注射液治疗晚期非小细胞肺癌期临床研究. 中国肺癌杂志, 2004, 8(7): 325−328.
[17] Yang L, Wang JW, Cui CX, et al. Rh-endostatin (YH-16) in combination with vinorelbine and cisplatin for advanced non-small cell lung cancer:a multicenter phaseⅡ trial. Chin New Drugs J, 2005, 14(2): 204−207.杨林, 王金万, 崔成旭, 等. 重组人血管内皮抑制素YH-16联合用药治疗晚期非小细胞肺癌的多中心 II期临床试验. 中国新药杂志, 2005, 14(2): 204−207.
[18] Wen LC, Zh LZ. The observation of short-term effects of YH-16 combined with concurrent three dimensional conformal radiotherapy on locally advanced non-small cell lung cancer. J Basic Clin Oncol, 2009, 22(3): 218−220.温林春, 章龙珍. 恩度联合放疗治疗局部晚期非小细胞肺癌的疗效观察. 肿瘤基础与临床, 2009, 22(3): 218−220.
Endothelial genesis inhibitor-8t (EDI-8t) against tumor growth
Qingwei Zhou, Peng Du, Yue Qian, Qian Zhang, Baoshan Feng, Hongzhen Ding, Renbao Gan, and Hui Zhang
Shanghai Apeloa Pharmaceutical Research Institute, Shanghai 201314, China
On the basis of the origin comparison of known endothelial genesis inhibitors, a 417-bp cDNA fragment was amplified from umbilical cord by RT-PCR and cloned into the expression vector pPIC9, followed by transformation into Pichia pastoris GS115. The resulted yeast was induced with methanol to express recombinant protein. The resulted protein was purified from culture broth and designated as EDI-8t. The in vitro study showed that EDI-8t, originated from collagen VIII, could specifically inhibit the growth and migration of bovine aortic endothelial cells (BAEC) stimulated by basic fibroblast growth factor (bFGF). The protein also exhibited the activity to cause cell apoptosis. In vivo EDI-8t showed the identical activity comparing with endostatin to inhibit the growth of liver tumor transplanted into nude mice. Interestingly, EDI-8t showed higher activity than endostatin to inhibit tumor growth in metastatic model of melanoma mice.
endothelial genesis inhibitor, EDI-8t, tumor
胶原蛋白 (Collagen) 是组成各种细胞外间质的聚合物,主要以不溶性纤维蛋白的形式存在。在人体的组成中,胶原带白约占蛋白质总量的33%。1997年美国哈佛医学院的Folkman教授发现了第一个胶原蛋白来源的内皮细胞生长抑制剂angiostatin[1],随后另一个胶原蛋白来源的内皮细胞生长抑制剂endostatin也被从尿液中提取[2]。Angiostatin和endostatin这2个内皮抑制剂分子的发现和动物实验的成功掀开了这个领域的研究热潮。随后一系列胶原蛋白来源的内皮细胞抑制剂被发现,如来源于胶原蛋白 XV的 Restin[3]、来源于胶原蛋白 IV的canstatin[4]等。在已知的内源性的血管生长抑制剂中,约有50%是蛋白降解片段 (图1),它们的前体蛋白并不抑制血管形成,但是参与加工它们产生内生抑制剂的蛋白却大多也是参与血管生成的组分,这可能也是调节生理稳态的一种方式[5]。这些内源性的血管生长抑制剂均能专一性地抑制内皮细胞的生长,但是对正常细胞如成纤维细胞和肿瘤细胞的生长没有抑制活性。
May 10, 2010; Accepted: June 28, 2010
Hui Zhang. Tel: +86-21-68010002; Fax: +86-21-68010008; E-mail: huizhang@apeloa.com

