牛脂肪间充质干细胞的分离、培养与鉴定
任宇,吴海青,马玉珍,2,仓明,王瑞,刘东军
1 内蒙古大学 哺乳动物繁殖生物学与生物技术重点实验室,呼和浩特 010021
2 内蒙古自治区医院,呼和浩特 010017
牛脂肪间充质干细胞的分离、培养与鉴定
任宇1,吴海青1,马玉珍1,2,仓明1,王瑞1,刘东军1
1 内蒙古大学 哺乳动物繁殖生物学与生物技术重点实验室,呼和浩特 010021
2 内蒙古自治区医院,呼和浩特 010017
为了给组织工程提供种子细胞,对牛间充质干细胞 (Adipose-derived stem cells,ADSCs) 进行体外分离培养。首先应用胶原酶消化法分离牛ADSCs,进行体外培养、连续传代,并观察细胞的形态变化,通过细胞计数绘制生长曲线,细胞压片进行染色体分析,采用细胞免疫荧光化学方法检测细胞表面标记,利用成骨分化和成脂分化检测其分化能力。结果显示牛ADSCs体外培养时细胞形态呈成纤维细胞样,增殖稳定;Vimentin、CD49d、CD13表达呈阳性,CD34表达呈阴性;成骨诱导条件下的细胞碱性磷酸酶活性高,茜素红染色呈阳性;成脂诱导条件下细胞周围脂滴明显,油红-O染色呈阳性。结果证明牛 ADSCs体外生长稳定、增殖速度快、定向分化能力强,简易的体外分离培养及诱导方法为其在组织工程中的应用奠定了基础。
脂肪间充质干细胞,体外分离培养,细胞鉴定,细胞分化
1 材料与方法
1.1 材料
1.1.1 实验材料
成年牛颈部脂肪组织由内蒙古大学实验动物研究中心提供。
1.1.2 主要试剂
DMEM/F12 培养基、PBS、胰蛋白酶、双抗、胎牛血清 (以上药品均由Hyclone公司提供);Ⅰ型胶原酶、β-甘油磷酸钠、地塞米松、抗坏血酸、Alizarin Red、BSA、牛胰岛素、生物素、泛酸、罗格列酮、IBMX、Oil Red-O (以上药品均由Sigma公司提供);ALP检测试剂盒 (北京中生生物技术公司) 等。
1.2 方法
1.2.1 牛ADSCs的分离
采用胶原酶解法分离:脂肪组织用PBS冲洗2次,无菌条件下用手术刀切碎脂肪组织,分装入50 mL离心管中。加入与脂肪组织等体积的PBS (含有 1% BSA,0.1%Ⅰ型胶原酶),37℃摇床中振荡酶解60 min,每隔20 min收集一次细胞,1 200 r/min离心5 min,除去上层脂肪组织。最后将3次收集的细胞移至同一离心管内,1 200 r/min离心5 min后弃上清液,基本培养基重悬沉淀,即得到牛脂肪间充质干细胞。
1.2.2 原代培养及传代培养
按2×105/cm2的接种密度,在60 mm培养皿中加入5 mL基本培养基,于37℃、5% CO2浓度、饱和湿度条件进行培养。48 h后更换培养基,以后隔天换液,当贴壁细胞的生长达到80%汇合时,加入 0.25%胰蛋白酶消化,传代培养。将扩增后的不同代次牛ADSCs,按0.5×106/mL置于冰冻保存管,加入冰冻保护剂 (10% DMEM,10% DMSO,80% FBS),置冰冻盒中−80℃冰箱保存24 h后,转入液氮保存。
1.2.3 牛ADSCs鉴定
牛ADSCs以1×105/mL的密度接种于铺于24孔板内的盖玻片上,待细胞生长至80%以上汇合时,4%多聚甲醛室温固定 30 min,加入渗透液 (0.1% TritonX-100) 室温渗透1 h,加入封闭液 (PBS+2% BSA+2%山羊封闭血清+2%脱脂奶粉+0.15 MGlycine) 37℃封闭 2 h,然后分别滴加 1∶200 Vimentin (小鼠抗大鼠多克隆抗体,武汉博士德生物)、CD49d (兔抗大鼠多克隆抗体,武汉博士德生物)、CD34 (兔抗大鼠多克隆抗体,武汉博士德生物)和CD13 (兔抗大鼠多克隆抗体,武汉博士德生物),37℃温育2 h。清洗一抗后,1∶50加入山羊抗FITC标记二抗37℃温育2 h,最后PBS+BSA清洗二抗PI染色15 min,同时以PBS代替一抗和牛成纤维细胞作为阴性对照,共聚焦显微镜 (BX61,奥林巴斯,日本) 观察细胞染色情况。
1.2.4 生长曲线
传代培养的第5、10代细胞用普通培养液制成单细胞悬液,调整细胞浓度为1×104/mL,接种于24孔培养板,每孔1 mL,第2天起每天取3孔细胞计数。以时间 (d) 为横坐标,细胞数量(×104/mL)为纵坐标,绘制生长曲线。
1.2.5 染色体分析
取第5、10代处于指数生长期的牛ADSCs,加入含0.1 μg/mL秋水仙素 (Sigma) 的DMEM-F12培养4 h。0.25%胰酶消化收集细胞,逐滴加入37℃预热的0.075 mol/L KCl 5 mL,37℃低渗处理20 min。低渗结束后加入新配制固定液 (甲醇∶冰醋酸= 3∶1) 1 mL,预固定1 min后1 000 r/min离心10 min,弃去上清液,加固定液悬浮细胞后静置30 min,再离心,固定2次,每次30 min。离心后加固定液1.5 mL制成细胞悬液。用微吸管取细胞悬液滴于−20℃冰冻的载玻片上,空气干燥,1∶9姬姆萨(Sigma) 磷酸缓冲液染色 15 min,清水洗涤后显微镜下观察。
1.2.6 成骨分化诱导
培养24 h细胞贴壁后,置换成骨诱导培养基进行培养,每3天更换一次新鲜分化培养基 (DMEM/ F12+10% FBS+1%双抗+10 mmol/L β-甘油磷酸钠+20 nmol/L地塞米松+50 μg/mL抗坏血酸) 进行成骨诱导。对照组继续加入常规培养基每3天更换一次新鲜培养基,与诱导组在同一条件下培养,21 d后进行相应检测。
1.2.7 成脂分化诱导
培养24 h细胞贴壁后,培养板中加入成脂诱导培养基 (DMEM/F12+3% FBS+1%双抗+33 μmol/L生物素+17 μmol/L泛酸+1 μmol/L胰岛素+1 μmol/L地塞米松+0.5 mmol/L IBMX+5 μmol/L罗格列酮+ 5%兔血清) 培养3 d,然后换为无罗格列酮和IBMX的维持培养基继续培养,每 3天更换一次新鲜分化培养基。对照组继续加入常规培养基每3天更换一次新鲜培养基,与诱导组在同一条件下培养,21 d后进行相应检测。
1.2.8 成骨细胞鉴定
茜素红染色:诱导培养 21 d的细胞,用150 mmol/L NaCl冲洗3次,在4℃下用70%乙醇固定1 h,室温下用2%茜素红 (NaOH调pH 4.1~4.3)染色10 min,相差显微镜检测钙盐沉积情况。
碱性磷酸酶(Alkaline phos phatase,ALP)染色:将成骨诱导培养21 d的细胞PBS冲洗2次,4℃下用 100%乙醇固定1 h,加入NBT/BCIP溶液温育后检测ALP活性。
PCR鉴定骨钙素 (Osteocalcin) 的表达:TaKaRa RNAiso reagent裂解成骨细胞,氯仿抽提总RNA溶于DEPC水中,利用反转录试剂盒将RNA反转录为cDNA进行 PCR。引物由大连宝生物公司合成 (表1)。PCR 参数:94℃ 4 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;72℃ 10 min,4℃保存。
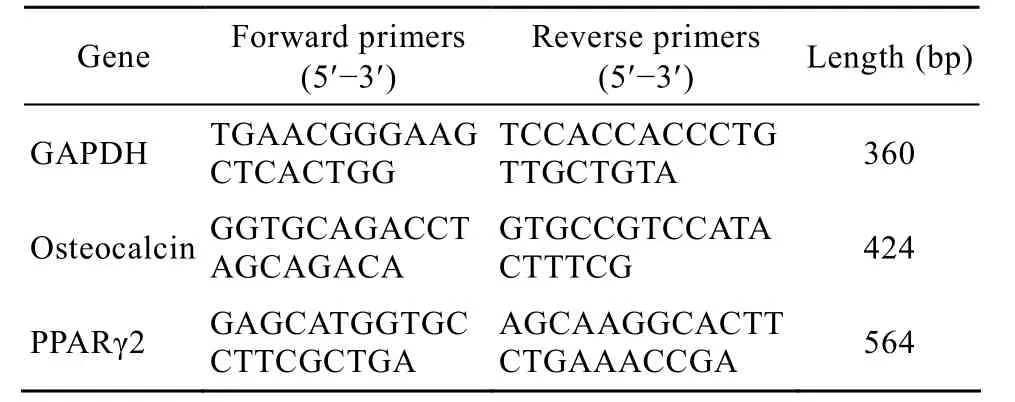
表1 本研究中所用引物Table 1 Primers used in this study
1.2.9 成脂细胞鉴定
油红-O染色:诱导培养后的细胞,室温下用10%福尔马林固定20 min,加入油红-O染色20 min。相差显微镜下检测成脂分化结果。
PCR鉴定PPARγ2的表达:目的基因引物序列见表1 (其余同上,PCR鉴定Osteocalcin的表达)。
2 结果
2.1 形态学观察
牛ADSCs 接种后4~6 h开始贴壁,初为小圆形,细胞大小不均匀,有部分单核细胞存在。48 h后逐渐伸展为短梭形、多角形和长梭形,细胞折光度较好,4 d后形态呈成纤维细胞样 (图1),8~10 d达到80%~85%汇合。传代后牛ADSCs呈典型成纤维细胞样生长 (图2)。
2.2 牛ADSCs鉴定
FITC荧光信号呈绿色,激发波长488 nm,在波长 530 nm以上观察。第 5代牛 ADSCs细胞Vimentin、CD49d和CD13均匀染色呈阳性,CD34呈阴性。以PBS代替一抗和牛成纤维细胞为阴性对照,以上抗体染色均呈阴性 (图3)。
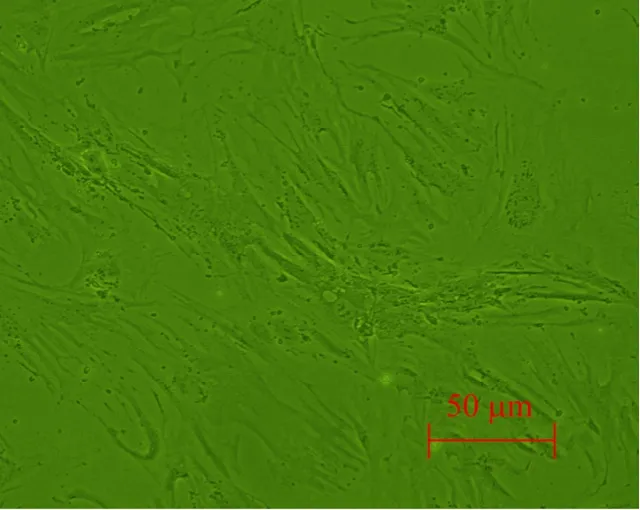
图1 原代牛ADSCs形态观察 (100×)Fig. 1 Morphology of primary bovine ADSCs (100×).

图2 第5代牛ADSCs形态观察 (100×)Fig. 2 Morphology of P5 bovine ADSCs (100×).

图3 牛ADSCs免疫组织化学染色结果Fig. 3 Results of ADSCs immunofluoresence staining. (A-D) Bovine ADSCs. (E-H) Bovine fibroblasts. (A, E) Vimentin staining. (B, F) CD49 staining. (C, G) CD13 staining. (D, H) CD34 staining. (A1-H1) A-H corresponding to excited without excitation of the original map.
2.3 生长曲线
从图4中可以看出,第5、10代的牛ADSCs生长曲线基本符合细胞生长曲线规律,经历了潜伏期、对数期、平台期,分别为1 d、2~6 d、6~8 d后。说明牛ADSCs在体外增殖稳定,生长状态无异常。
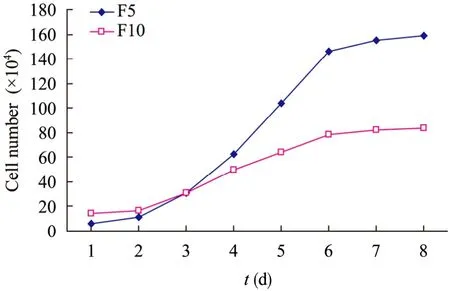
图4 牛ADSCs生长曲线Fig. 4 Growth curve of bovine ADSCs.
2.4 染色体分析
经消化收取细胞进行染色体分析,第 5代牛ADSCs有90% (27/30) 细胞的染色体具有正常二倍体倍性 (图 5),第 10代牛 ADSCs有 84% (25/30) 细胞的染色体仍具有正常二倍体倍性 (图6),说明牛脂肪间充质干细胞在体外生长染色体正常 (图5)。
2.5 诱导分化
2.5.1 成骨诱导分化
牛ADSCs成骨诱导后,第10~14天已具有较强成骨活性,21 d后实验组细胞结节中心的细胞逐渐融合失去细胞结构,骨化结形成明显。经茜素红染色呈暗红色 (图 7A箭头所指处),对照组细胞经过21 d培养后仍然呈成纤维细胞样生长,细胞无堆积现象出现,茜素红染色后无暗红色骨化结出现 (图7B),ALP染色实验组细胞呈阳性,细胞着色程度不一,呈蓝紫色,且细胞密集处着色更深 (图8A箭头所指处),ALP阳性率可到85%以上说明有大量成骨细胞形成,而对照组细胞经ALP染色后细胞无明显着色,呈阴性 (图8B)。骨钙素是骨组织的特异性蛋白,是骨细胞分化成熟的标志,在牛ADSCs中不表达 (如图9A中泳道3所示),在成骨细胞中表达 (如图9B中泳道3所示)。以上结果均说明牛间充质干细胞在成骨诱导体系下已经向成骨细胞分化。
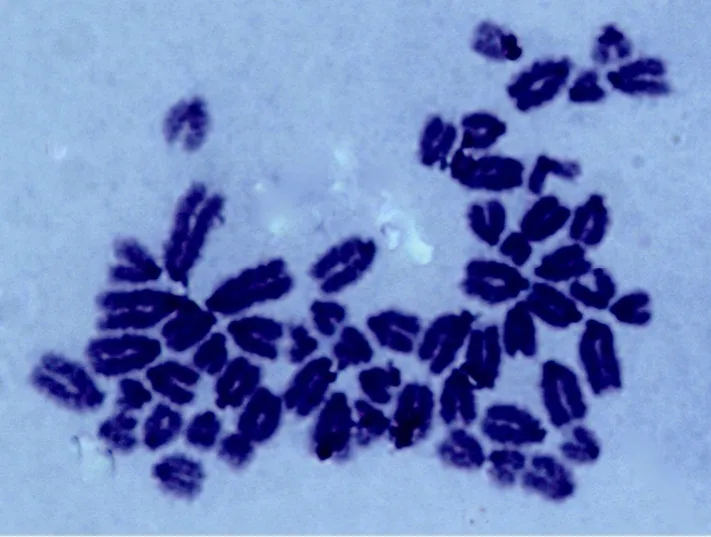
图5 F5ADSCs染色体 (1 000×)Fig. 5 Chromosomes of F5ADSCs (1 000×).
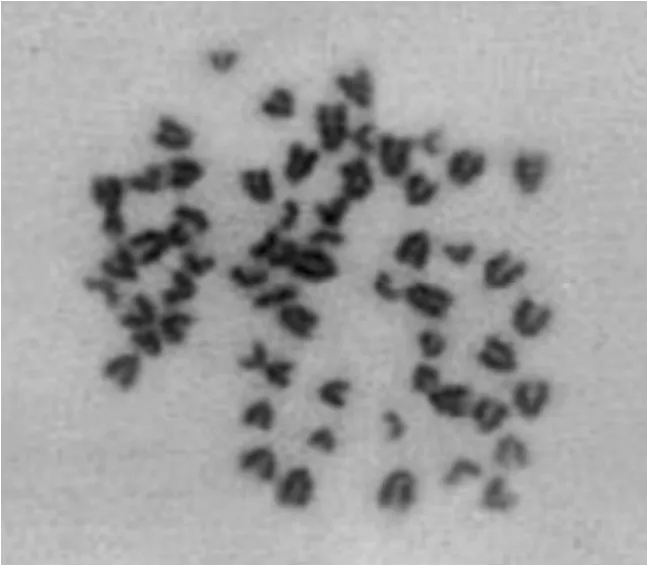
图6 F10ADSCs染色体 (800×)Fig. 6 Chromosomes of F10ADSCs (800×).
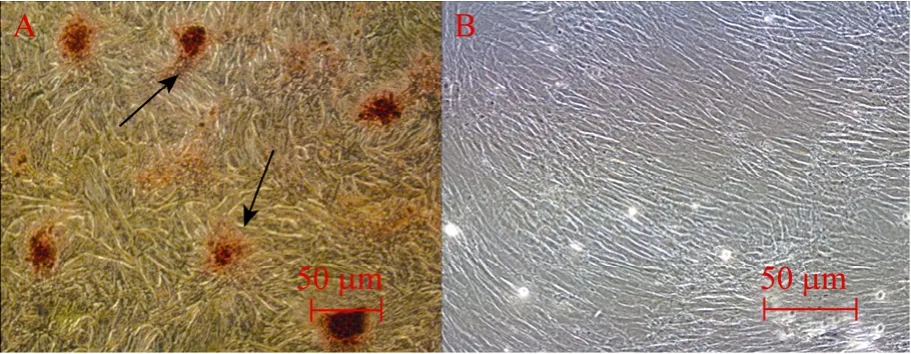
图7 牛ADSCs成骨诱导21 d后茜素红染色 (100×)Fig. 7 Alizarin Red Staining of bovine ADSCs after osteogenic induction on 21th day (100×). (A) Experimental group. (B) Control group.

图8 牛ADSCs成骨诱导21 d后碱性磷酸酶染色 (100×)Fig. 8 ALP Staining of bovine ADSCs after osteogenic induction on 21th day (100×). (A) Experimental group. (B) Control group.
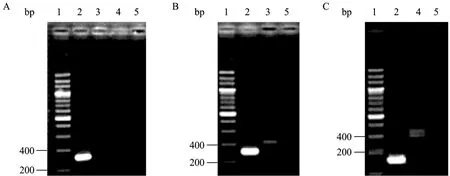
图9 牛ADSCs电泳结果Fig. 9 Electrophoresis of bovine ADSCs. (A) Electrophoresis of GAPDH. (B) Electrophoresis of osteoblasts. (C) Electrophoresis of adipocyte. 1: 200 bp marker (TaKaRa); 2: GAPDH (360 bp); 3: Osteocalcin (424 bp); 4: PPARγ2 (564 bp); 5: negative control.
2.5.2 成脂诱导分化
牛ADSCs成脂诱导后实验组细胞周围分泌出多边形、梭形微小油滴,小油滴可慢慢聚合变大,经油红-O染色后呈红色 (图10A箭头所指处),而细胞并不会被着色,对照组细胞21 d后细胞形态无异常表现,周围无油滴出现,细胞没有向脂肪细胞分化的迹象,经油红-O染色后无显色反应出现 (图10B)。过氧化物酶体增殖物激活受体 (PPARγ2)与胰岛素抵抗、脂肪细胞分化和肥胖有密切关系。PPARγ2是前脂肪细胞分化为成熟脂肪细胞以及脂肪细胞内甘油三酯蓄积的重要调节因子,在牛 ADSCs中不表达(如图9A中泳道4所示),而在脂肪细胞中表达 (如图9C中泳4道所示),以上结果均说明牛脂肪间充质干细胞在成脂诱导体系下已经向脂肪细胞分化。
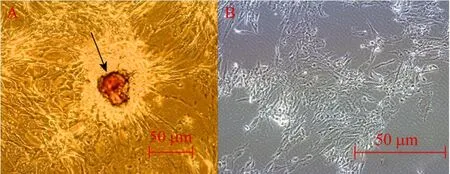
图10 牛ADSCs成脂诱导21 d后油红-O染色 (100×)Fig. 10 Oil Red-O Staining of bovine ADSCsafter adipogenesis introduction on 21th day (100×). (A) Experimental group. (B) Control group.
3 讨论
自体脂肪组织因具有来源丰富、取材安全、无免疫排斥反应的特点,成为21世纪理想的软组织填充材料。但是,多年来移植脂肪组织颗粒仍存在高吸收率和低存活率的问题,至今仍无突破性进展。自2001年Zuk等[3]研究发现,脂肪组织中含有可分化为脂肪细胞、成骨细胞、软骨细胞、脂肪细胞等具有较强的增殖能力和多向分化潜能的细胞,被称为ADSCs。人们分别从人[4-6]、小鼠[7]、大鼠[8]、兔[9]和猪[10]等动物体内分离得到类似的ADSCs。目前对于牛、羊等家畜动物的相关研究涉及很少,本研究分离得到的牛 ADSCs与其他物种的脂肪间充质干细胞形态及生长特点相似,同样具有多向分化潜能。
为了排除红细胞的干扰,人们常使用 NH4Cl裂解红细胞。鉴于红细胞不贴壁的特性,本研究中通过二次换液去除红细胞,效果明显且与使用 NH4Cl裂解红细胞并无明显差异,同时简略了细胞分离培养步骤,减少细胞在外界的操作时间。众所周知,ADSCs目前尚无特异的表面标记,本研究测定了Vimentin、CD49d、CD13和CD34四个因子。Vimentin是 5种主要的中间丝之一,存在于各种正常和病理性间质来源的组织,本研究中牛ADSCs Vimentin染色呈阳性,说明所分离得到的牛ADSCs是来源于中胚层的干细胞。CD49d是调节造血干细胞和祖细胞定居归巢到骨髓的表面分子,CD49d和CD106是脂肪间充质干细胞和骨髓间充质干细胞的很好的区分标记[11-12]。CD34是造血干细胞的表面标记在淋巴结、骨髓造血干细胞和各种内皮中表达,CD34阴性说明牛 ADSCs 并非来源于血液循环中的干细胞,同时说明牛 ADSCs 未受到脂肪组织中微血管内皮细胞的污染。以上结论说明已经得到纯度较高的牛ADSCs。本研究所用的细胞表面分子的检测可用于鉴定牛脂肪间充质干细胞。但最好的方法是进行多向诱导,并进行相应检测以确定诱导成功。
细胞基质中钙盐沉积情况最直接反映了细胞成骨的程度,茜素红具因其具有有羟基蒽醌结构,与钙盐中的钙离子结合后形成配合物显示为红色[13-14],是用于测定细胞基质中钙盐沉积的一种较特异和常用的方法。ALP是成骨细胞分化的标志,在体外钙化中起关键性作用。目前认为,ALP能够水解有机磷酸酯,使局部 PO43−浓度升高,并可破坏钙化抑制剂,从而启动钙化。ALP活性越高,说明牛ADSCs向成熟成骨细胞分化越明显,随着ALP活性的提高,钙盐沉积在胶原纤维上,形成骨化结。成骨细胞特异表达基因骨钙素在牛 ADSCs和成骨细胞的差异表达,在分子水平上说明牛 ADSCs已发生成骨分化。Hattori等[15]用β-磷酸三钙复合体作为经向成骨诱导的ADSCs的支架放至裸鼠皮下,发现有骨组织形成,提示 ADSCs 在脂肪组织工程中有广阔的应用前景。Hong 等[16]用凝胶海绵作支架在体外进行人ADSCs成脂分化的三维培养,并用油红-O染色法进行鉴定,经过短期培养后与凝胶海绵一起移植至免疫耗竭的小鼠背部,4周后用生物化学和免疫组织化学的方法证实移植物转变为脂肪组织,认为人 ADSCs结合生物相容并与可降解的凝胶海绵进行脂肪组织工程是可行的。本研究中油红-O染色及PCR结果同样证实牛ADSCs可分化为脂肪细胞。那么,本研究中牛ADSCs在体外可以分化为成骨细胞和脂肪细胞,是否在动物体内具有同样的作用,还需要进一步证实。
本研究培养的牛ADSCs在体外培养取材容易,对机体损伤小,分离方法简便,体外生长增殖能力强,经多次传代后细胞仍生长稳定、增殖速度快、贴壁率高,并且可以定向诱导分化为成骨细胞和脂肪细胞,填补了ADSCs在牛羊等家畜动物研究方面的空缺,因此有望成为脂肪组织工程和基因治疗的一种很好的细胞来源。
REFERENCES
[1] Chen TL. Inhibition of growth and differentiation of osteoprogenitors in mouse bone marrow stromal cell cultures by increased donor age and glucocorticoid treatment. Bone, 2004, 35(1): 83–95.
[2] Jü HB. In vitro experiment about osteogenic differentiation of the mesenchymal stemcell from lipose and bone marrow tissue in rats [D]. Changsha: Central South University, 2006.鞠洪斌. 大鼠脂肪间充质干细胞和骨髓间充质干细胞成骨分化比较的体外研究[D]. 长沙: 中南大学, 2006.
[3] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng, 2001, 7(2): 211–228.
[4] Aust L, Devlin B, Foster SJ, et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy, 2004, 6(1): 7–14.
[5] Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells: characterization, differentiation and application in cell and gene therapy. Cell Mol Med, 2004, 8(3): 301–316.
[6] Sakaguchi Y, Sekiya I, Yagishita K, et al. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis Rheum, 2005, 52(8): 2521–2529.
[7] Ali AA, Weinstein RS, Stewart SA, et al. Rosiglitazone causes bone loss inmice by suppressing osteoblast differentiation and bone formation. Endocrinology, 2005, 146(3): 1226–1235.
[8] Nishida T, Kubota S, Kojima S, et al. Regeneration of defects in articular cartilage in rat knee joints by CCN2 (connective tissue growth factor). Bone Miner Res, 2004, 19(8): 1308–1319.
[9] Liu YM, Zhang ZQ, Yang XF, et al. Isolation, culture and characterization of rabbit adipose-derived stromal cells. Acta Agric Boreali-Occidentalis Sin, 2009, 18(5): 43–47.刘玉梅, 张自强, 杨雪峰, 等. 兔脂肪间充质干细胞分离培养及鉴定. 西北农业学报, 2009, 18(5): 43–47.
[10] Zhang GH, Qu CQ, Yang GS. Culture and adipogenesis differentiation of porcine adipose mesenchymal stem cells. Acta Zool Sin, 2006, 52(5): 934–941.张国华, 屈长青, 杨公社. 猪脂肪间充质干细胞的分离培养及其成脂分化. 动物学报, 2006, 52(5): 934–941.
[11] Strem BM, Hicok KC, Zhu M, et al. Multipotential differentiation of adipose tissue-derived stem cell. Keio J Med, 2005, 54(3): 132–141.
[12] Katz AJ, Tholpady A, Tholpady SS, et al. Cell surface and transcriptional characterization of human adipose-derived adherent stromal ( hADAS) cells. Stem Cells, 2005, 23(3): 412–423.
[13] Perinpanayagam H, Schneider G, Holtman K, et al. Altered Cbfal expression and biomineralization in an osteosarcoma cell line. Ort Res, 2004, 22(2): 404–410.
[14] Vilmann H. The in vivo staining of bone with alizarin red S. Anat, 1969, 105(Pt 3): 533–545.
[15] Hattori H, Masuoka K, Sato M, et al. Bone for mation using human adipose tissue-derived stromal cells and abiodegradable scaffold. Biomed Mater Res B Appl Biomater, 2006, 76(1): 230–239.
[16] Hong L, Peptan IA, Colpan A, et al. Adipose tissue engineering by human adipose-derived stromal cells. Cells Tissues Organs, 2006, 183(3): 133–140.
Isolation, cultivation and identification of adipose-derived stem cell in bovines
Yu Ren1, Haiqing Wu1, Yuzhen Ma1,2, Ming Cang1, Rui Wang1, and Dongjun Liu1
1 Key Laboratory of Ministry of Education of China for Mammal Reproduction Biology and Biotechnology, Inner Mongolia University, Huhhot 010021, China
2 Inner Mongolia Hospital, Hohhot 010017, China
To obtain bovine adipose-derived stem cells (ADSCs), bovine ADSCs were digested in collagenase type I solution. The growth curve of ADSCs was checked by cell counting. Chromosome analysis was checked. The molecular markers of ADSCs were detected with immunofluoresence staining. The morphology of ADSCs was identical to fibroblast 1ike and the cells showed active proliferative ability. Vimentin, CD49d and CD13 antigens were detected, but CD34 antigen was negative. Alkaline phosphatase activity was greater in ADSCs during calcification, and Alizarin Red staining was positive. Lipid droplets were apparent around cells during adipogenesis, and Oil Red-O staining was positive. The results demonstrated that ADSCs could be used as seed cells for tissue engineering due to the simple isolation, differentiation and stable and active growth.
adipose-derived stem cell, cell separation in vitro, cell identification, cell differentiation
近年来,因其具有较强自我增殖能力和多向分化潜能的特点,间充质干细胞 (Mesenchymal stem cells,MSCs) 越来越多地受到人们的关注。现有研究显示[1],骨髓间充质干细胞 (Bone marrow stromalstem cells,BMSCs) 可以分化为成骨细胞、软骨细胞、脂肪细胞和成肌细胞等,这些细胞有望成为将来组织工程的种子细胞并为再生医学作出贡献。然而,传统获取骨髓的方法会给骨髓捐献者带来很大的痛苦,同时,通过这种方法得到的BMSCs数量有限、价格昂贵而且易造成细胞污染[2],这些成为组织工程进一步研究的瓶颈。那么,如何才能解决这一问题?目前大量的目光投向脂肪间充质干细胞(Adipose-derived stem cell,ADSCs),此类细胞利用简单的细胞消化法即可获得,而且取材方便,分离得到的ADSCs数量可观,体外增殖稳定。与骨髓间充质干细胞相比,它不仅具有相似的表面抗原标记和分化潜能,而且在特定的诱导条件下,同样可以向 3个胚层的细胞分化。但目前脂肪间充质干细胞在牛羊等家畜动物中少有研究。牛作为我国主要的畜产品动物来源在畜牧业中占有重要地位,对牛的育种改良一直是科研人员工作的重点。目前体细胞克隆和转基因技术已显示出在牛的育种改良中具有广阔的应用前景,那么供体细胞的选择是否可以提高核移植的成功率以及转基因效率已成为相关研究领域的重点课题,牛脂肪间充质干细胞以其多能性是否比牛成纤维细胞更适合作为供体细胞,从而提高克隆和转基因效率是目前的一个研究方向。同时通过建立牛脂肪间充质干细胞系也可以为牛的一些地方病的治疗提供研究基础。本研究体外分离培养牛脂肪间充质干细胞,并对其进行定向诱导,建立牛脂肪间充质干细胞细胞系,为组织工程种子细胞筛选奠定基础。
July 7, 2010; Accepted: October 13, 2010
Supported by:Major Projects in Inner Mongolia Natural Science Foundation (No. 20090505).
Yuzhen Ma. Tel/Fax: +86-471-6619236; E-mail: mayz@imnu.edu.cn
内蒙古自然科学基金重大项目 (No. 20090505) 资助。

