熊果酸诱导人肝癌SMMC-7721细胞株凋亡机制的研究
虞燕霞, 顾振纶, 殷江临, 周文轩, 郭次仪, 梁中琴1,*
(1.苏州大学医学部药理学系,江苏苏州215123;2.苏州中药研究所,江苏苏州215007;3.苏州市立医院药剂科,江苏苏州215002)
原发性肝癌系全球发病率和死亡率均较高的恶性肿瘤之一。寻找毒副作用小、对肝癌细胞选择性高、作用强的药物是研究抗肝癌药物的一个关键。
熊果酸(ursolic acid,UA),又名乌索酸,乌苏酸,属α-香树脂醇(α-amyrin)型五环三萜类化合物,以自由酸或三萜皂苷的形式广泛存在于植物中。许多含有UA的植物在民间被用于抗炎、肝脏保护、镇痛、强心、镇静和滋补等多个方面,其中多个治疗作用已经被现代的科学方法研究证实。近年来,UA对肿瘤的抑制和杀伤效应已经成为了研究热点。研究发现,UA对多种肿瘤细胞有抑制作用,同时它还具有一定的肝脏保护作用。
肝癌细胞株SMMC-7721系来源于我国肝癌病人的肿瘤细胞株。目前,国内外有关UA对肝癌的作用机制研究甚少,特别是UA对人肝癌SMMC-7721细胞的作用还未见报道。本实验旨在探讨UA对人肝癌细胞SMMC-7721的作用机制。
1 材料与方法
1.1 实验试剂 熊果酸(UA),由香港保健协会上海杨杨百草堂提供,纯度99%。以10 mmol/L溶于DMSO中,-20℃保存备用。MTT,AMRESO产品。PI(碘化丙锭),Sigma公司;瑞氏-吉姆萨染液,南京建成生物工程研究所;细胞凋亡-Hoechst染色试剂盒,碧云天生物技术研究所。Trizol Reagent,Invitrogen公司;Rneasy Mini Kit,Qiagen公司;引物由上海博彩生物科技有限公司合成。
1.2 细胞培养体系 人肝癌细胞株SMMC-7721购自中科院上海细胞生物学研究所。SMMC-7721细胞用含10%灭活FBS(杭州四季青生物工程材料研究所)的RPMI 1640培养基(Gibco产品)于37℃、5%CO2条件下培养,隔3 d传代,取对数生长期细胞进行实验。
1.3 细胞增殖抑制实验 采用常规MTT法检测UA对SMMC-7721细胞增殖的抑制作用。取对数生长期肿瘤细胞,用完全培养基调整细胞浓度为1×105个/mL,接种于 96 孔培养板中,100 μL/孔,37℃、5%CO2条件下培养过夜。次日给予UA,终浓度分别为10、20、30、40、50、60 μmol/L,对照组加0.6%DMSO,同时设不加细胞只加培养液的孔为空白对照。每组均设6个复孔。分别培养24、48、72 h。终止培养前4 h加入MTT(5 mg/mL,PBS配制,过滤除菌),10 μL/孔,培养结束后,吸净上清,每孔加入100 μLDMSO,震荡10 min,使结晶充分溶解。于酶标仪检测波长为490 nm时的吸光度A值。用药物浓度抑制软件(Logit法)计算IC50。
1.4 细胞形态学变化 取对数生长期肿瘤细胞,用完全培养基调整细胞浓度为1×105个/mL,接种于培养板中37℃、5%CO2条件下培养过夜。次日给予 UA 浓度分别为 30、40、50 μmol/L,对照组加0.5%DMSO,处理24 h后加入瑞氏-吉姆萨试剂染色10 min,用水冲去染液,晾干,倒置显微镜下观察结果。细胞用相同方法处理后,用Hoechst 33258染色液染色10 min,用荧光显微镜观察细胞核的变化。
1.5 流式细胞分析 取对数生长期肿瘤细胞,用完全培养基调整细胞浓度为1×105个/mL,37℃、5%CO2条件下培养过夜。次日给予UA,浓度分别为30,40,50 μmol/L,对照组加 0.5%DMSO,设 3 个复孔,培养24 h、48 h、72 h后收集细胞,PBS洗2次。加入冰预冷的70%的乙醇固定,4℃,1 h。离心弃去固定液,PBS洗2次,加入100 μg/mL Rnase 37℃水浴30 min。PBS洗2次,PI 50 μg/mL染色避光4℃,30 min,用流式细胞仪检测细胞凋亡率。
1.6 半定量RT-PCR检测 取对数生长期的SMMC-7721细胞分为6组,一组只使用DMSO处理,其余五组使用 40 μmol/L UA 分别处理 3、6、12、24、48 h后收集细胞,按Trizol试剂盒说明书提取总RNA。测定总 RNA浓度及纯度。制备 cDNA,在Taq酶的作用下进行扩增。PCR扩增条件为94℃4 min,94 ℃ 30 s,退火温度(Tm)30 s或45 s,72 ℃ 1 min,30~38个循环不等,最后均72℃延伸 8 min,引物、Tm及cycle详见(表1)。将PCR产物用1.5%琼脂糖电泳,80 V电泳1 h,结果用凝胶成像仪(上海天能公司)扫描图像。实验平行3份进行,凝胶扫描图像采用软件分析,以GADPH条带为内参,数据进行单因子方差分析。
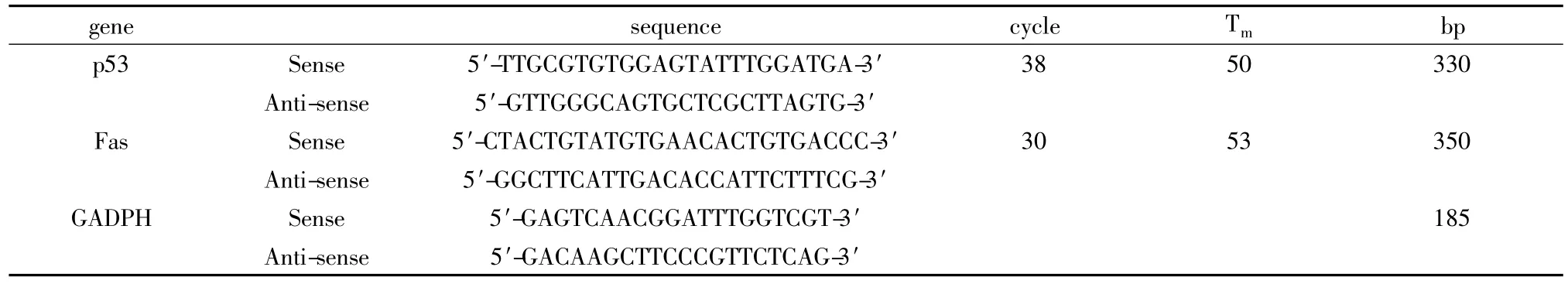
表1 PCR扩增所使用的引物Table 1 Premier used for PCR amplification
1.7 统计学处理 采用SPSS 10.0统计软件进行t检验及方差分析,P<0.05具有统计学意义。
2 结果
2.1 UA对SMMC-7721细胞增殖的抑制作用 不同浓度的UA对SMMC-7721细胞存活率影响的测定:见表2。UA 10 μmol/L 和 20 μmol/L 组浓度较低,对SMMC-7721细胞未见明显的抑制作用,因此无显著的时效性。UA从30 μmol/L作用24 h开始具有统计学意义。随着UA浓度的增加,作用时间的延长,细胞的存活率逐渐降低,细胞增殖抑制作用明显增强。UA作用24、48、72 h的 IC50分别为:45.72、23.22、21.76 μmol/L。
表2 熊果酸对SMMC-7721细胞存活率的影响(±s,n=6)Table 2 Reduced viability of SMMC-7721cells after UA treatment(±s,n=6)

表2 熊果酸对SMMC-7721细胞存活率的影响(±s,n=6)Table 2 Reduced viability of SMMC-7721cells after UA treatment(±s,n=6)
与对照组比较,*P <0.05,**P <0.01,***P<0.001。
24 h 48 h 72 h control 0.807±0.033 1.152±0.022 1.422±0.238组别 OD值UA(μmol/L)10 0.767±0.031 1.038±0.040 1.215±0.172 20 0.820±0.021 1.032±0.033 1.385±0.167 30 0.699±0.034**0.523±0.038***0.440±0.038***40 0.373±0.071***0.145±0.034***0.090±0.015***50 0.162±0.033***0.022±0.024***0.008±0.012***60 0.097±0.003***0.012±0.010***0.000±0.000***
2.2 UA对SMMC-7721细胞形态学变化的影响通过Wright-Giemasa染色,使用倒置显微镜观察,正常对照组的细胞核染成紫色,胞浆染成粉红色,色泽均一。随着给药浓度的增加细胞形态变化明显,细胞膜皱褶卷曲,出泡以及芽生形成膜包裹的凋亡小体。使用Hoechst33258染色,在荧光显微镜下观察,正常对照组细胞核呈弥散,微弱,均匀的荧光;30 μmol/L组的细胞核内可见浓染致密的颗粒块状荧光;40、50 μmol/L组明显可见细胞核内DNA的荧光碎片,可以认为这就是凋亡细胞。
2.3 UA对SMMC-7721细胞凋亡率的影响SMMC-7721 细胞经过 30、40、50 μmol/L 3 个浓度组药物处理24、48、72 h后,用药组的凋亡细胞百分率明显高于正常对照组,且呈一定的浓度和时间依赖性(图1)。

图1 熊果酸对SMMC-7721细胞凋亡率的影响(±s,n=3)Fig.1 Apoptosis rate of SMMC-7721 cells induced by UA(±s,n=3)
2.4 UA作用SMMC-7721细胞后凋亡相关基因mRNA表达水平的变化 各组PCR实验结果中,GADPH均有稳定的表达,因而可作为参照。SMMC-7721细胞经过UA 40 μmol/L处理后,与对照组相比较:p53的mRNA在UA作用6 h和12 h表达增加,其他时间点表达较弱(图2-1);Fas的mRNA随UA作用时间的延长表达上调(图2-2)。
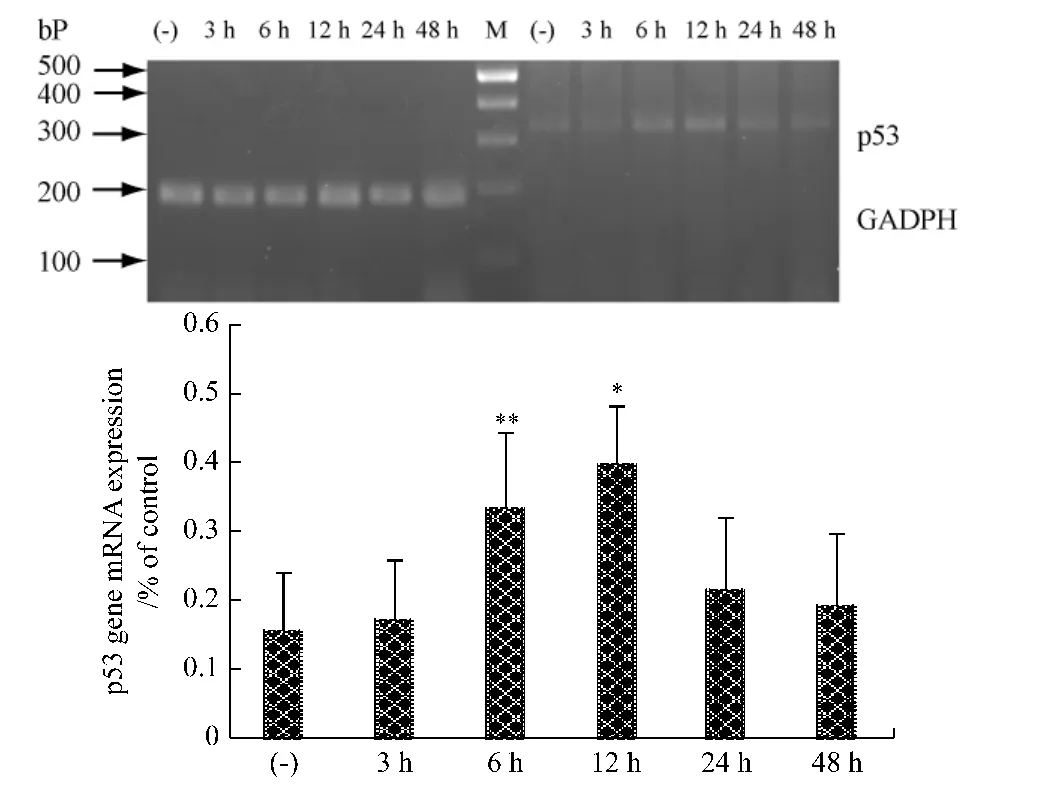
图2-1 熊果酸作用于SMMC-7721细胞不同时间对p53基因表达的影响Fig.2-1 p53 gene mRNA expression of control and treated SMMC-7721 cells with UA at different time point

图2-2 熊果酸作用于SMMC-7721细胞不同时间对Fas基因表达的影响Fig.2-2 Fas gene mRNA expression of control and treated SMMC-7721 cells with UA at different time point
3 讨论
已有研究表明UA能显著抑制肝癌细胞HepG2的活性[1]。本实验用 MTT法检测 UA对人肝癌SMMC-7721细胞增殖抑制作用,结果显示UA在30 μmol/L浓度作用24 h就能产生明显的抑制作用,且随着药物浓度增加和作用时间延长,抑制作用也相应加强。为了了解UA对肝癌细胞的抑制作用,本实验使用细胞形态学和流式细胞仪的检测技术证实了UA可以诱导SMMC-7721细胞凋亡。
为了进一步了解UA诱导肝癌细胞SMMC-7721的凋亡机制,我们使用了半定量PCR技术检测了与凋亡相关的基因p53和Fas的表达。结果显示UA能使这两个基因表达增加。Manu KA等人的研究发现UA能诱导黑色素瘤B16F-10细胞的凋亡,同时还能诱导细胞中p53的表达[2]。p53基因是一个肿瘤抑制基因,它对于维护细胞的正常功能,监控DNA损伤、调节细胞周期、细胞分化以及细胞凋亡等方面发挥重要作用[3]。作为一个转录调控基因,p53可以通过转录活化下游的靶基因,参与了多个信号传导通路的调节[4]。实验中p53基因在给药6 h和12 h时表达增强较为显著,而24 h和48 h表达不明显,这可能是由于p53作为一个上游基因在被激活后引发了一系列下游基因的变化,同时随着药物作用时间的延长还有其他许多机制(如影响细胞周期等)参与了对细胞凋亡的调控,使p53表达增加不显著,其具体机制还有待于进一步研究。
本实验发现在SMMC-7721细胞中UA不仅能激活p53基因,同时也激活了p53的下游基因Fas。Fas的表达增加能够促进肿瘤细胞发生凋亡[5]。Fas/FasL诱导的细胞凋亡机制是人体细胞自身新陈代谢进程中的一个重要环节。Fas(Apo-1)是广泛分布于多种细胞表面的一种跨膜糖蛋白,它与FasL结合后,通过 FADD的介导将凋亡信号传递给Caspase-8,激活Caspase-8产生一种连锁反应,导致半胱氨酸蛋白酶超家族中的其它成员相继被激活。这些蛋白酶被激活后,将水解各自的底物,产生各种死亡效应分子,诱导细胞凋亡。在人类恶性肿瘤的发展过程中,常伴有肿瘤细胞表面Fas表达缺失或功能丧失。故诱导或增强Fas的表达可以促进肿瘤细胞发生凋亡。
综上所述,UA作用于人肝癌SMMC-7721细胞可以显著抑制细胞增殖,其主要作用机制为诱导SMMC-7721细胞的凋亡。可能的分子机制是UA通过上调p53基因,从而引起了下游基因Fas上调。在这些上下游基因的联合作用下细胞发生了凋亡。UA作为一种低毒、廉价的天然植物成分,在癌症的预防和治疗中有着广阔的前景。本研究为UA在肝癌的预防和治疗中提供了更多的理论和实验依据。
[1]Tian Z,Lin G,Zheng R X,et al.Anti-hepatoma activity and mechanism of ursolic acid and its derivatives isolated from Aralia decaisneana[J].World J Gastroenterol,2006,12(6):874-879.
[2]Manu K A,Kuttan G.Ursolic acid induces apoptosis by activating p53 andcaspase-3 gene expressions and suppressing NF-κB mediated activation of bcl-2 in B16F-10 melanoma cells[J].Int Immunopharmacol,2008,8(7):974-981.
[3]Arakawa H.p53,apoptosis and axon-guidance molecules[J].Cell Death Differ,2005,12(8):1057-1065.
[4]Kuribayashi K,El-Deiry W S.Regulation of programmed cell death by the p53 pathway[J].Adv Exp Med Biol,2008,615:201-221.
[5]O'Brien D I,Nally K,Kelly R G,et al.Targeting the Fas/Fas ligand pathway in cancer[J].Expert Opin Ther Targets,2005,9(5):1031-1044.

