山羊GnRHR基因部分序列多态性及其与产羔数的关联性分析
张育军,胡敏兰 ,张子军,丁建平,任春环,杨玉敏,阮崇美
(安徽农业大学动物科技学院,合肥 230036)
下丘脑分泌的促性腺激素释放激素(gonadotropin releasing hormone,GnRH)在调节哺乳动物生殖系统正常发育及其机能维持方面发挥着重要作用。GnRH与垂体促性腺细胞表面的GnRHR结合后,刺激垂体前叶合成和释放促卵泡素(follicle-stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH),从而促进性腺的生长、成熟和调控哺乳动物的繁殖力。GnRHR是位于垂体促性腺细胞表面的一种G蛋白耦联受体,转导GnRH信号,并调节LH和FSH的合成和分泌[1]。因此,GnRHR基因是动物繁殖性状的一个重要候选基因。Antelli等报道,位于人GnRHR的第1个胞外环上的T104I和Y108C的突变可影响配体与受体的结合力,从而导致人第二性征的发育障碍[2]。Dunn等报道,母鸡群体中GnRHR限制酶等位基因的频率分别是0.54(Bpu1102I+)和0.46(Bpu1102I-),GnRHR基因对双黄蛋数目有显著加性效应(P<0.05)[3]。刘忠慧等在小尾寒羊和陶赛特羊群体GnRHR基因cDNA检测到第230处发生G→C的突变,导致第77个氨基酸由甘氨酸变为半胱氨酸(Gly→Cys),这一突变可能与小尾寒羊和陶赛特羊的繁殖力有一定的正相关[4]。储明星等发现济宁青山羊GnRHR基因具有AA、AB和BB三种基因型,并且BB型济宁青山羊平均产羔数比AB和AA型分别多0.69只(P<0.05)和0.82只(P<0.05)[5]。而GnRHR基因多态性分析在黄淮山羊方面还未见相关报道。
黄淮山羊是我国优良的地方山羊品种之一,产羔率达227%~239%[6];波尔山羊则是世界著名的肉用山羊品种,产羔率180%~193%。本研究以黄淮山羊和波尔山羊为研究素材,以GnRHR基因为候选基因,采用单链构象多态(single strand conformation polymorphism,SSCP)方法对动物繁殖起重要调控作用的Gn-RHR基因进行单核苷酸多态性(single nucleotide polymorphism,SNP)检测,以比较GnRHR基因在黄淮山羊和波尔山羊品种中的多态性,旨在寻找与产羔数相关的遗传标记,为山羊高繁殖力的标记辅助选择提供科学依据。
1 材料和方法
1.1 材料
1.1.1 材料 具有产羔记录的黄淮山羊母羊120只(安徽省阜阳市颖东区种羊场)和波尔山羊母羊34只(安徽省肥东县包公镇种羊场)。每只采血样10 mL,用ACD抗凝,-20℃冻存。用酚氯仿抽提法提取基因组DNA,溶于 TE,4℃保存。
1.1.2 主要试剂 Taq DNA聚合酶、dNTPs、pGEM2T Easy载体、DNA片段回收纯化试剂盒、质粒提取纯化试剂盒等均购自上海生工生物工程技术有限公司,N、N2亚甲基双丙烯酰胺、丙烯酰胺、TEMED、过硫酸胺等购自Sigma公司。
1.2 方法
1.2.1 引物设计和PCR扩增 根据GenBank绵羊GnRHR基因的全编码序列(L42937,L43841),用Primer Premier 5.0软件在外显子1、外显子2处设计3对引物。第1和第2对引物(P1,P2)用于扩增exon 1片段,而P3引物对用于扩增exon 2片段。引物序列、扩增片段大小见表1。
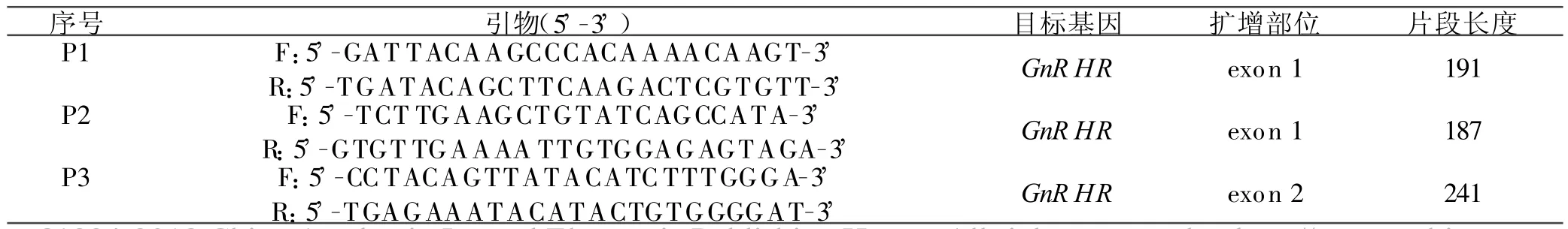
表1 PCR扩增的引物序列
PCR反应总体系为25 μ L,其中基因组DNA 50 ng,10×缓冲 液 2.5 μ L,dNTPs 的 终浓 度 200 μ mol/L,TaqDNA聚合酶1 u。引物的浓度及其PCR扩增条件见表2。产物用1.5%琼脂糖凝胶电泳检测。

表2 3对引物PCR扩增的条件
1.2.2 SSCP分析 配制30 mL 12%的聚丙烯酰胺凝胶,混匀后迅速灌胶;当胶灌至离玻璃板上沿0.1 cm时,停止灌胶,插入梳子,室温聚合;凝胶聚合后,向电泳槽中加1×TBE,用注射器冲洗加样孔;预电泳10 min,同时准备点样;取2.0 μ L PCR产物置于 PCR管中,加7 μ L上样缓冲液,煮沸变性 10 min后迅速置于冰上,冰浴10 min,用微量移液器点样;150 V电压,电泳12~14 h。电泳结束后,进行硝酸银染色。用Alpha Imager TM 2200 and 1220 Documentation and A-nalysis Systems(Alpha Innotech Corporation,San Leandro,CA,USA)拍照和分析。
1.2.3 PCR产物测序 用柱式凝胶回收试剂盒回收纯化PCR产物。将回收后的DNA片段与pGEM2T Easy载体连接,转化大肠杆菌(E.coli)DH5α菌株,酶切鉴定后在3730测序仪上测序。
1.2.4 群体遗传学研究分析 统计基因频率及基因型频率,并运用数学模型进行最小二乘方差分析,比较黄淮山羊产羔数在不同GnRHR基因型之间的差异:yijkl=μ+HYSi+Pj+Gk+eijkl,其中:yijkl为产羔数的记录值;μ为群体均值;HY Si为第i个场年季的固定效应;Pj为第j个胎次的固定效应;Gk为第k种标记基因型的固定效应;eijk l为随机残差效应,且满足e~N(0,σ2)。用SAS(6.12版本)软件包的GLM(general linear model)过程完成。
产羔数是指2~4胎繁殖母羊一胎的产羔数量。分别来自2个种羊场2008年后半年的产羔记录。
2 结果
2.1 PCR扩增 3对引物P1、P2、P3扩增获得了理想的PCR产物(图1),片段长度与预期大小一致,并且没有非特异性扩增条带,2个品种羊的扩增片段大小也一致,可以直接进行SSCP分析。
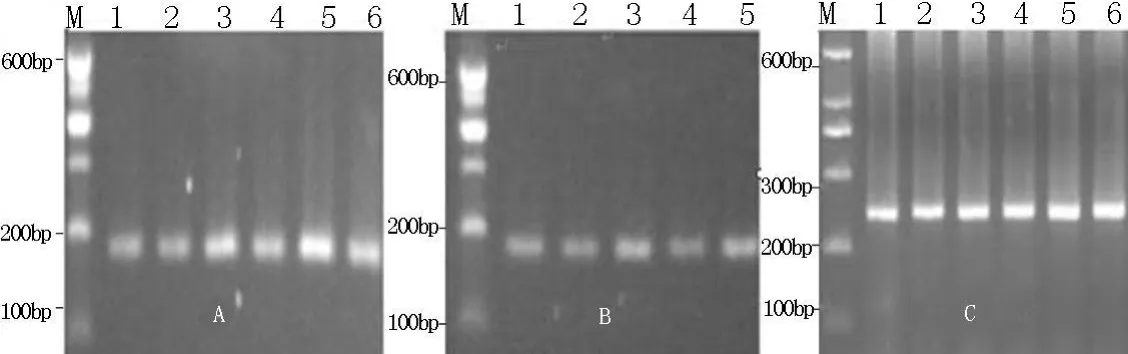
图1 GnRHR基因引物扩增产物
2.2 SSCP检测 对P1、P2、P3引物扩增的黄淮山羊和波尔山羊2个品种的GnRHR基因PCR产物分别进行SSCP分析。结果发现:在检测山羊中,引物P1、P3扩增片段均不存在多态性(结果未呈示)。引物P2扩增片段有3种基因型(图2),分别命名为AA、AB和BB,存在多态性。
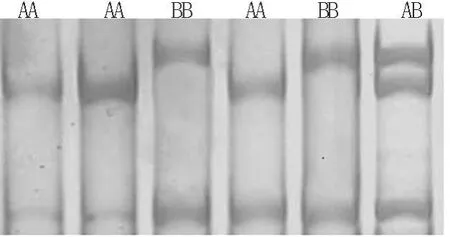
图2 山羊GnRHR基因P2扩增片段的SSCP结果
2.3 克隆测序 经PCR-SSCP分析,所设计的引物中仅在引物P2扩增的片段中检测到多态性,扩增出3种基因型,选择黄淮山羊纯合的AA型和BB型进行测序分析。结果显示,扩增片段长度为188 bp;AA型与BB型序列相比较,在58 bp处发生A→C碱基突变(图3),编码的氨基酸由赖氨酸变为谷氨酰胺。
2.4 基因群体遗传学分析

图3 P2引物扩增片段序列及测序图比较
2.4.1 基因频率和基因型频率 对引物P2扩增的黄淮、波尔山羊GnR HR基因外显子1的基因频率和基因型频率进行了统计分析,其基因多态性分布情况见表3。
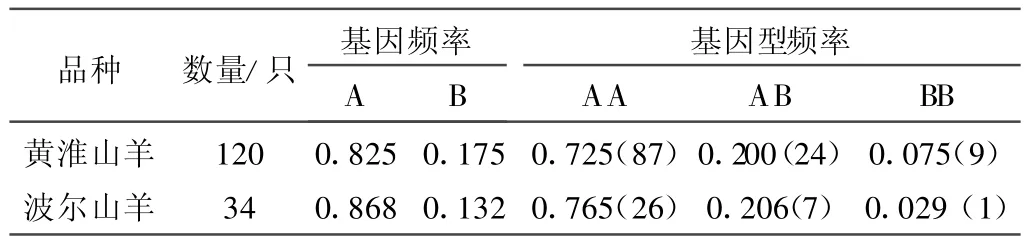
表3 GnRHR基因在黄淮山羊和波尔山羊品种中的多态性分布
2.4.2 GnRHR基因与黄淮山羊产羔数的关联分析 黄淮山羊群体中GnRHR基因P2扩增产物不同基因型的产羔数的最小二乘均值及标准误见表4。由表可见:BB型黄淮山羊平均产羔数比AA型多0.66只(P<0.05);AB基因型黄淮山羊产羔数比BB基因型的少0.39只,但差异不显著(P>0.05),比AA基因型的多0.27只,差异也不显著(P>0.05),见表4。

表4 不同GnRHR基因型黄淮山羊产羔数的最小二乘均值及标准误差
3 讨论
GnRHR基因是分子标记的研究热点之一,国内外学者对GnRHR基因的多态性进行了研究。De Roux等[7]发现,人GnRHR cDNA存在317G→A和785A→G两个突变,分别导致氨基酸改变(Gln106Arg和Arg262Gln)。吴旭等[8]在对文昌鸡群体GnRHR内含子1的多态性检测中发现,内含子的多态性对文昌鸡300、400日龄产蛋数有显著的影响,以显性方式作用。Jiang等[9]在梅山×欧洲大白猪的F2代群体中发现GnRHR基因3'端UTR(非翻译区)1 721位有C/G替代;1 721位等位基因G在梅山猪中的频率为0.94,在欧洲大白猪中的频率为0.42。
本研究在GnRHR基因外显子1和外显子2处共设计3对引物,在外显子1设计的2对引物中有1对引物(P2)扩增片段具有多态,而P1的扩增片段没有多态。克隆获得的山羊GnRHR基因外显子1的片段长度为232bp。GnRHR基因纯合的BB基因型黄淮山羊平均产羔数比AA基因型多0.66只,差异显著(P<0.05),而比杂合AB基因型多0.39只,差异不显著(P>0.05)。BB型与AA型相比,在外显子1有1个突变(C→A),而且引起氨基酸改变。由此可以推测GnRHR基因可能是控制黄淮山羊多胎性能的一个主效基因或是与之存在紧密连锁的一个遗传标记。
[1]刘忠慧,储明显,陈国宏.促性腺激素释放激素基因与其受体基因的研究进展[J].中国畜牧兽医,2006,33(3):35-38.
[2]姜德相,董桂红,王达荣.GnRH对提高母猪受胎率和产仔存活数作用的研究[J].中国畜牧兽医,2005,32(6):28-29.
[3]Dunn I C,Miao Y W,Mo rris A,et al.A study of association between genetic markers in candidate genes and reproductive traits in one generation of a commercial broiler breeder hen population[J].Heredity,2004,92(2):128-134.
[4]刘忠慧,储明星.绵羊GnRHR基因部分序列PCR-SSCP分析[J].安徽农业大学学报,2006,33(3):318-321.
[5]储明星,肖杰文,狄冉,等.促性腺激素释放激素受体(GnRHR)基因多态性及其与济宁青山羊高繁殖力关系[J].农业生物技术学报,2009,17(2):218-223.
[6]赵本领,包玉亭,霍福新,等.黄淮山羊品种资源调查报告[J].中国畜禽业,2008(1):642-661.
[7]De Roux N,Young J,Misrahi M,et al.A family with hy pogonadotropic hypogonadism and mutations in the gonadotropin-releasing ho rmone receptor[J].T he New England Journal of Medicine,1997,337(22):1597-1602.
[8]吴旭,王金玉,严美娇,等.GnRHR,IGF-1基因对文昌鸡繁殖性能的遗传效应分析[J].畜牧兽医学报,2007,38(1):31-35.
[9]Jiang ZH,Gibson J P,A rchibald A L,et al.The porcine gonadotropin-releasing hormone receptor gene(GnRHR):genomic organization,polymorphisms,and association with the number of corpora lutea[J].Genome,2001,44(1):7-12.

