123I和99Tcm标记的吲哚类σ2受体放射性示踪剂的设计、稳定化合物的合成及体外生物评价
李 艳,贾红梅,*,Deuther-Conrad Winnie,Brust Peter,Steinbach Joerg,刘伯里
1.放射性药物教育部重点实验室,北京师范大学 化学学院,北京 100875;2.Forschungszentrum Dresden-Rossendorf, Institute of Radiopharmacy/Neuroradiopharmaceutical Division, 04318 Leipzig, Germany
目前,恶性肿瘤在我国已成为危害人们健康的头号杀手。乳腺癌、前列腺癌、肺癌等呈逐年上升趋势。研究表明,σ受体在许多肿瘤细胞系中有高度表达[1],在肿瘤诊断和治疗方面有广泛的应用[2]。目前σ受体至少有两种亚型被确认:σ1型和σ2型受体[3]。其中,σ2受体是肿瘤增殖的生物标志[4-6]。
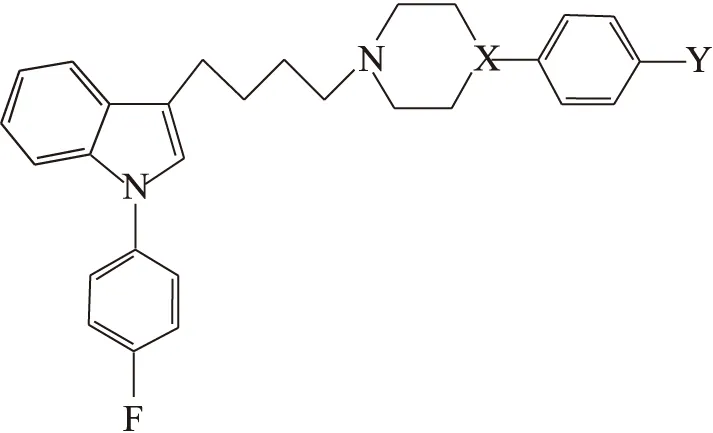
图1 吲哚类化合物的结构Fig.1 Structure of the Indole compounds
Mach等[7]认为,用于固体瘤增殖期显像的PET放射性示踪剂主要有两种:一是放射性核素标记的核酸类似物(DNA前体),如[18F]FLT等,但该类显像剂的缺点是只能标记处于增殖期的部分肿瘤细胞,常常低估肿瘤增殖状态;另一种就是放射性核素标记的σ2受体示踪剂,该类显像剂可以标记所有肿瘤细胞,可以更好地估计肿瘤增殖状态。因此,与σ2受体有高亲和力和选择性的放射性示踪剂是优良的肿瘤显像剂,其研究具有重要的理论意义和实际应用价值[8]。Perregaard 等[9]报道了一系列对σ2受体具有较高亲和力和选择性的吲哚类化合物,该类代表化合物的结构示意图示于图1,IC50值列入表1。为了设计吲哚类肿瘤SPECT显像剂,首先在与哌嗪环相连的苯环对位引入碘原子,设计123I标记的吲哚类化合物。由于99Tcm核素优良的核性质及便宜易得等优点,保留可能是配体与σ2受体作用的药效团吲哚环部分,将99Tcm-MAMA螯合基团取代哌嗪环,采用整体法设计99Tcm标记的配合物。在此基础上,合成其稳定化合物 (Indole-I和Indole-MAMA-Re)并进行体外生物评价。制备了标记前体(Indole-MAMA)和99Tcm-Indole-MAMA,为设计合成用于SPECT显像的123I和99Tcm标记的吲哚类σ2受体肿瘤显像剂提供了参考。
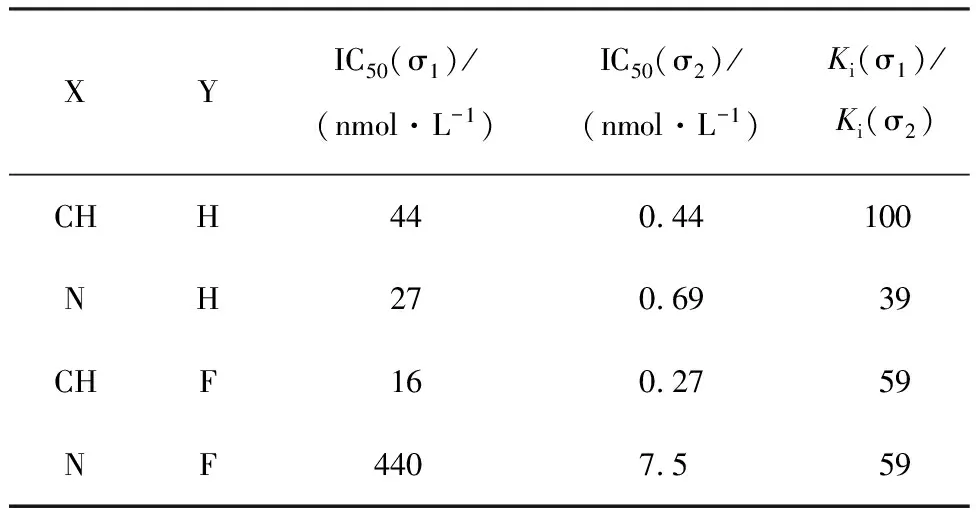
表1 吲哚类化合物的IC50值Table 1 IC50 values of indole compounds
1 实验部分
1.1 主要试剂、材料和仪器
吲哚丁酸、氟哌啶醇,分析纯,美国Aldrich公司;对氟碘苯、N,N-二异丙基乙胺(DIEA),分析纯,比利时Acros公司;氧化锌、碘化亚铜,分析纯,三苯基磷,化学纯,北京国药集团化学试剂公司;三氟乙酸,化学纯,美国Alfa公司;氢化铝锂、甲基吡咯烷酮、溴代琥珀酰亚胺,化学纯,三乙胺、无水碳酸钾,分析纯,北京化工厂;三乙基硅烷,化学纯,北京金龙化学试剂有限公司;苯甲醚,化学纯,北京市东环联合化工厂;[3H]镇痛新,1 354 GBq/mmol,美国Perkin Elmer Life Sciences;[3H]DTG,1 147 GBq/mmol,美国NEN Life Science Products;烯丙右吗喃氢溴酸盐(Dextrallorphan hydrobromide),获赠于Hoffman-La Roche, Basel, Switzerland;99Mo-99Tcm发生器由中国原子能科学研究院提供。
AVATAR 360型红外谱仪,美国Nicolet公司;Avance 500 MHz型核磁共振谱仪,Avance Ⅲ 400 MHz型核磁共振谱仪,均为瑞士Bruker公司;GC2000/TRACETMMS 质谱仪,美国Finigan公司;240C 型元素分析仪,美国Perkin-Elmer公司;SCL-10AVP高效液相色谱仪,日本岛津公司;Alltima C18反相柱(5 μm,4.6 mm×250 mm),美国Alltech公司;Class-Packard 500 TR系列的放射性检测器,美国Packard Bioscience公司。
1.2 Indole-I和Indole-MAMA-Re的合成
1.2.11-(4-氟苯)-3-(4-(4-(4-碘苯)哌嗪-1-)丁基)-1H-吲哚(Indole-I)的合成 Indole-I的合成路线示于图2。4-(1-(4-氟苯)-1H-吲哚-3-)丁醇(化合物1)的合成参考文献[9]。化合物1与N-溴代丁二酰亚胺(NBS)、Ph3P反应生成3-(4-溴丁基)-1-(4-氟苯)-1H-吲哚 (化合物2),化合物2与1-(4-碘苯)哌嗪反应生成1-(4-氟苯)-3-(4-(4-(4-碘苯)哌嗪-1-)丁基)-1H-吲哚(化合物3)。
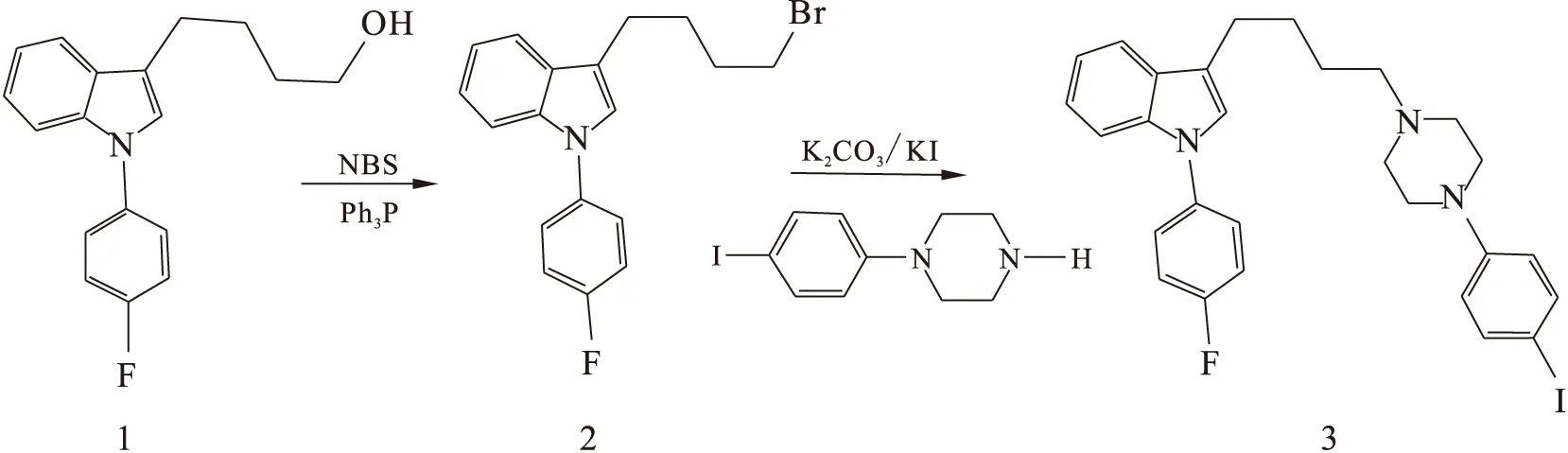
图2 Indole-I的合成路线Fig.2 Synthetic route of Indole-I
(1) 3-(4-溴丁基)-1-(4-氟苯)-1H-吲哚(化合物2)的合成
将150 mg化合物1(0.53 mmol)、Ph3P 170 mg(0.64 mmol)、NBS 110 mg(0.63 mmol)溶于3 mL THF中,在冰浴条件下搅拌2 h,过滤后旋去溶剂,过柱分离,展开剂为乙酸乙酯和石油醚的混合溶液,体积比为1∶10。化合物2的产率为82%。
(2) 1-(4-氟苯)-3-(4-(4-(4-碘苯)哌嗪-1-)丁基)-1H-吲哚(化合物3)的合成
将100 mg化合物2(0.29 mmol)、80 mg 1-(4-碘苯)哌嗪(0.77 mmol)、400 mg K2CO3(2.9 mmol)、50 mg KI(0.29 mmol)溶于10 mL乙腈中,加热到80 ℃,回流6 h。过滤,旋去溶剂后过柱分离,展开剂为乙酸乙酯和石油醚的混合溶液,体积比为1∶4。化合物3的产率为68%。
1.2.2Indole-MAMA-Re的合成 Indole-MAMA-Re的合成路线示于图3。化合物2与螯合基团反应生成Indole-MAMA-Tr(化合物4),后经脱保护反应生成Indole-MAMA(化合物5),再与Re螯合生成Indole-MAMA-Re(化合物6)。
(1) Indole-MAMA-Tr(化合物4) 的合成
将100 mg化合物2(0.29 mmol)溶于2 mL干乙腈中,加入208 mg MAMA-Tr(0.44 mmol)、65 mgN,N-二异丙基乙胺(DIEA),N2保护下,加热到80 ℃回流12 h,旋干混合物,过柱分离,展开剂为乙酸乙酯和石油醚的混合溶液,体积比为1∶1。化合物4的产率为27%。
(2) Indole- MAMA(化合物5)的合成
冰盐浴下,将70 mg化合物4(0.1 mmol)溶于8 mL CF3COOH中,加入0.25 mL苯甲醚,反应15 min后,加入0.2 mL三乙基硅烷,再反应20 min,溶液变为白色混浊液,旋干混合物,油泵抽干。产物未经纯化直接进行下步反应。
(3) Indole-MAMA-Re(化合物6)的合成
将上步的反应产物5,在N2保护下,溶于9 mL甲醇中,加入50 mg(Ph3P)2ReOCl3(0.060 mmol)和1.5 mL NaAc/CH3OH (1 mol/L),缓慢升温至80 ℃,回流6 h,用乙酸乙酯稀释反应混合物,过滤,再用乙酸乙酯洗2次,过滤,得到紫色滤液,旋干后,过柱分离,展开剂为乙酸乙酯和石油醚的混合溶液,体积比为1∶1。化合物6的产率为20%。
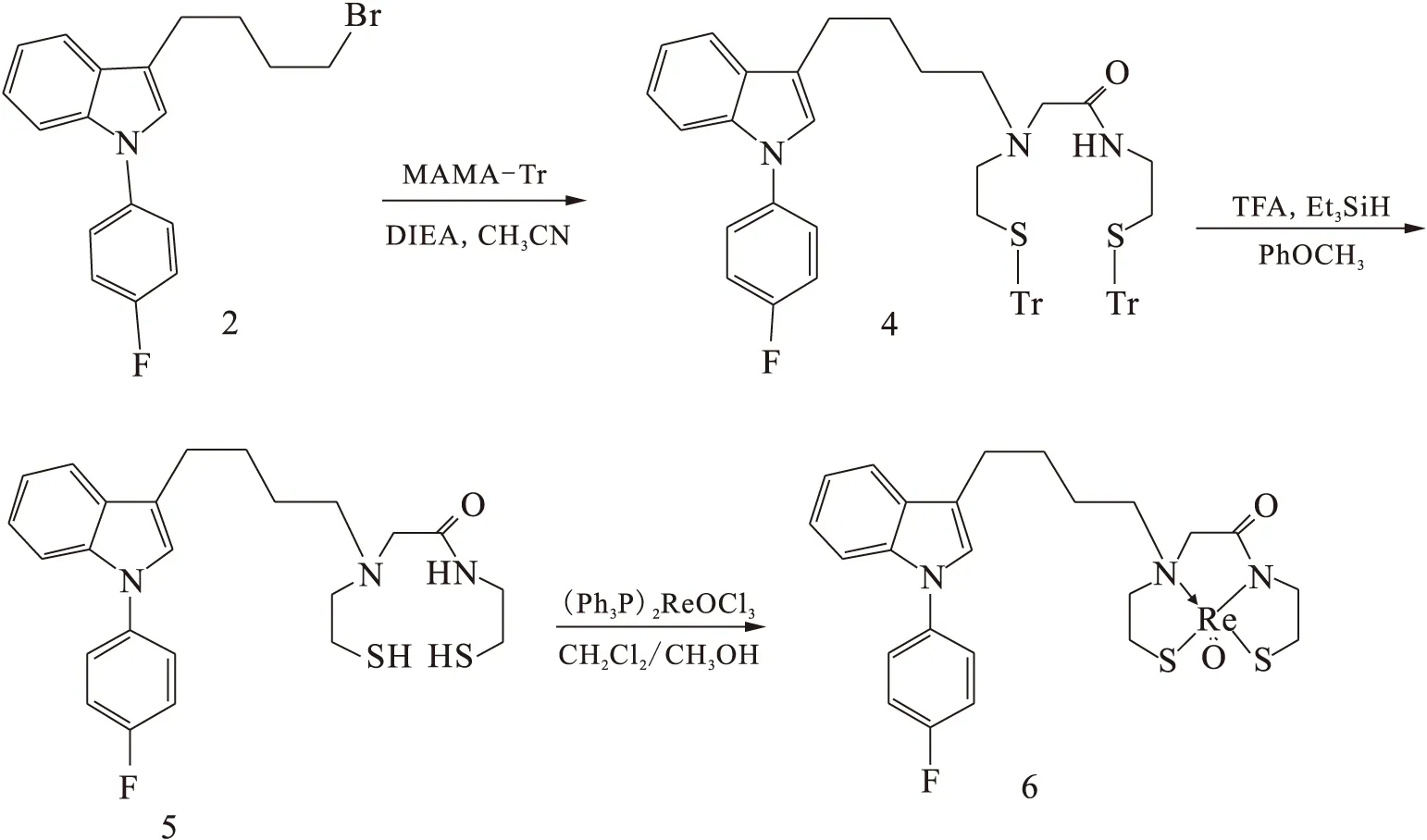
图3 Indole-MAMA-Re的合成路线Fig.3 Synthetic route of Indole-MAMA-Re
1.3 化合物的受体结合分析实验
1.3.1σ1和σ2受体的制备 Indole-I和Indole-MAMA-Re对σ1受体和σ2受体的亲和力在富含各自σ受体亚型的组织中测定[10]:分别在大鼠脑组织匀浆和在大鼠肝组织匀浆中进行。动物的使用遵循德国实验动物法和实验室动物使用法规。σ1和σ2受体的制备方法与文献[11]方法相同。
1.3.2Indole-I和Indole-MAMA-Re与σ1受体和σ2受体亲和力的测定 Indole-I和Indole-MAMA-Re 的体外亲和力用竞争结合分析法测定,方法与文献[11]一致。简言之,对σ1受体的亲和力用大鼠脑皮质膜蛋白和0.8 nmol/L[3H]镇痛新进行测定,对σ2受体的亲和力用大鼠肝膜蛋白和0.8 nmol/L [3H]DTG在10 μmol/L 烯丙右吗喃存在下以封闭σ1受体的条件下进行测定。膜蛋白在冰上解冻后,用培养缓冲溶液(50 mmol/L Tris-HCl,pH=7.4,21 ℃)稀释,再次匀浆。实验的蛋白浓度用二喹啉甲酸(BCA)方法测定。非特异性结合试剂采用10 μmol/L 氟哌啶醇。待测化合物的温育温度和时间分别为21 ℃和120 min。所有的实验均重复3次。用迭代非线性曲线拟合法得出参数IC50值。应用Cheng-Prusoff 方程由IC50值计算得出抑制常数(Ki)值。
(1)
c(LT)为放射性配体的浓度,Kd为放射性配体与受体结合的平衡解离常数。
1.4 99Tcm-Indole-MAMA的放射化学合成及纯化
1.4.199Tcm-Indole-MAMA的合成 将2 mg配体5溶于2 mL乙醇中,形成1 g/L配体溶液。取200 μL99Tcm-GH,加入100 μL配体溶液,调节pH=5.5~6.0,在80~90 ℃的水浴中加热30 min,冷却后,用饱和NaHCO3溶液中和至pH=7,薄层色谱法测定标记率,展开体系:生理盐水/聚酰胺片。
1.4.299Tcm-Indole-MAMA的纯化及HPLC分析 采用高效液相系统配置Packard 500 TR系列的放射性检测器,Alltech C18反相柱,淋洗条件为梯度淋洗,流速为1 mL/min。流动相淋洗条件列入表2。

表2 流动相淋洗条件Table 2 Eluent condition of the mobile phase
注(Note):1)φ(TFA)=0.1%
2 结果与讨论
2.1 中间体及目标化合物的结构鉴定
Indole-I和Indole-MAMA-Re的结构及中间体均通过IR、NMR、MS分析确证。
(1) 化合物2
IR:3 051、2 933、1 511、1 459、1 434、1 383、1 220、1 133、839、741 cm-1。1H NMR(500 MHz,CDCl3):δ 7.66(d,J=9.7 Hz,1H),7.46~7.50(m,3H),7.20~7.29(m,4H),7.12(s,1H),3.50(t,J=6.6 Hz,2H),2.87(t,J=7.6 Hz,2H),2.00~2.06(m,2H),1.91~1.97(m,2H)。EI-MS:理论值,345.02;计算值,345.05。
(2) 化合物3
1H NMR(500 MHz,CDCl3):δ 7.69(d,J=7.8 Hz,1H),7.55(d,J=8.0 Hz,2H),7.47~7.50(m,3H),7.19~7.28(m,4H),7.13(s,1H),6.72(d,J=8.0 Hz,2H),3.23(brs,4H),2.88(t,J=7.2 Hz,2H),2.65(brs,4H),2.51(brs,2H),1.81~1.86(m,2H),1.72(brs,2H)。13C NMR(125 MHz,CDCl3):δ 161.8、159.8、150.8、137.8、136.3、128.9、125.9、125.1、122.5、119.8、119.3、118.1、116.5、116.3、110.2、81.4、58.5、53.0、48.6、27.9、26.7、24.9。EI-MS:理论值,553.35;计算值,553.14。
(3) 化合物4
IR:3 366、3 055、2 927、1 676、1 594、1 511、1 489、1 458、1 444、1 221、840、742、700 cm-1。1H NMR(500 MHz,CDCl3):δ 7.29~7.52(m,16H),7.07~7.19(m,22H),6.91(s,1H),2.94(d,J=5.4 Hz,2H),2.77(s,2H),2.65(t,J=6.6 Hz,2H),2.31~2.32(m,2H),2.26~2.27(m,3H),2.17~2.18(m, 2H),1.59(t,J=6.8 Hz,2H),1.39~1.50(m,4H)。
(4) Indole- MAMA
产物未经纯化直接进行下步的反应。
(5) Indole-MAMA-Re
1H NMR(500 MHz,CDCl3):δ 7.01~7.21(m,8H),6.80(t,1H),4.59~4.66(m,2H),4.06~4.14(m,4H),3.55~3.58(m,2H),3.36(m,2H),3.20~3.28(m,4H),1.90(m,4H)。EI-MS:理论值,659.39;计算值,659.11。
2.2 Indole-I和Indole-MAMA-Re对σ受体的亲和力和选择性
通过竞争结合曲线求得Indole-I和Indole-MAMA-Re抑制放射性配体与σ1受体或σ2受体结合一半时所需的浓度IC50值。化合物Indole-I、Indole-MAMA-Re对σ2受体的竞争结合曲线示于图4。通过Cheng-Prusoff方程得到上述两个化合物对σ1受体和σ2受体的抑制常数Ki值列入表3。
对于本工作研究的吲哚类化合物,在吲哚环的N原子上引入4-氟苯基,可大大提高化合物对σ2受体的亲和力和选择性[9]。而当哌嗪环相连的苯环上没有取代基时,化合物对σ2受体的亲和力(IC50=0.69 nmol/L)和选择性(Ki(σ1)/Ki(σ2)=39)均较高,而在该苯环引入F原子后,化合物对σ1受体(IC50=440 nmol/L)和σ2受体(IC50=7.5 nmol/L)的亲和力均降低,但仍保持对σ2受体的高亚型选择性(Ki(σ1)/Ki(σ2)=59)。由表3和图4可知,当在该苯环引入碘原子后,化合物对σ2受体(Ki(σ2)=0.162 μmol/L)的亲和力和亚型选择性(Ki(σ1)/Ki(σ2)=3.5)均降低。因此,在哌嗪环的苯环上不宜引入体积大的卤素取代基。若用Re-MAMA螯合基团替代哌嗪环部分,化合物对σ1受体(Ki=3.75 μmol/L)、σ2受体(Ki= 7.83 μmol/L)的亲和力均降低到μmol/L数量级,说明哌嗪环部分也是配体受体的重要结合位点。根据Glennon[12-13]提出的σ1和σ2受体配体的药效团模型,σ1和σ2受体配体都应具有1个碱性氮原子和2个疏水性区域。比较Re-MAMA螯合基团与哌嗪环的结构发现,MAMA的N原子与Re原子配位后可能失去碱性N原子的特征,Re-MAMA螯合基团由于存在酰胺键导致脂溶性降低,也就是说,用Re-MAMA螯合基团替代哌嗪环部分后,可能影响了配体受体的2个作用位点,所以导致配体对σ1和σ2受体的亲和力都大大降低。由于希望得到99Tcm标记的σ2受体显像剂,需要降低该配合物对σ1受体的亲和力,提高配合物对σ2受体的亲和力,从而提高亚型选择性,因此,利用整体法设计99Tcm标记的受体配体时,需要慎重选择99Tcm螯合基团以及替换原配体结构的部位,破坏配体对σ1受体的作用位点,而尽量保持配体对σ2受体的作用位点,只有这样才有可能得到对σ2受体具有高亲和力和高亚型选择性的99Tcm标记的σ2受体显像剂。因此希望在本工作化合物的基础上,通过进一步的结构修饰,提高化合物对σ2受体的亲和力。
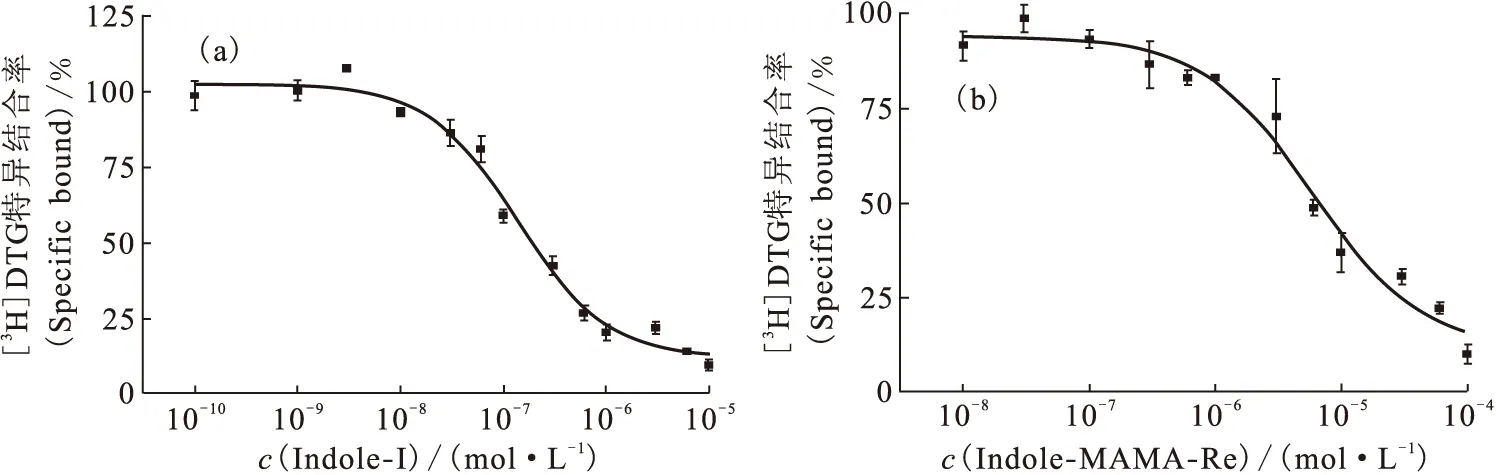
图4 化合物Indole-I(a)、Indole-MAMA-Re(b)与[3H]DTG对σ2受体的竞争结合曲线Fig.4 Competition curves of [3H]DTG binding to σ2 receptors in rat liver by Indole-I(a) and Indole-MAMA-Re(b)

化合物(Compounds)Ki(σ1)/(μmol·L-1)Ki(σ2)/(μmol·L-1)Ki(σ1)/Ki(σ2)Indole⁃I0574±03550162±003035Indole⁃MAMA⁃Re375±222783±48705
注(Note):n=3
2.3 99Tcm-Indole-MAMA的标记及99Tcm-Indole-MAMA与Indole-MAMA-Re的HPLC分析
99Tcm-GH的标记率大于99%,采用配体交换法制备99Tcm-Indole-MAMA的标记率为47%。经HPLC分析后,99Tcm-Indole-MAMA的放化纯大于90%。纯化后经HPLC分析,稳定配体Indole-MAMA-Re在C18反相柱上的保留时间为27.6 min(图5),标记化合物99Tcm-Indole-MAMA的保留时间为28.5 min(图6),两者保留时间仅相差0.9 min,说明制备的标记物为99Tcm-Indole-MAMA。
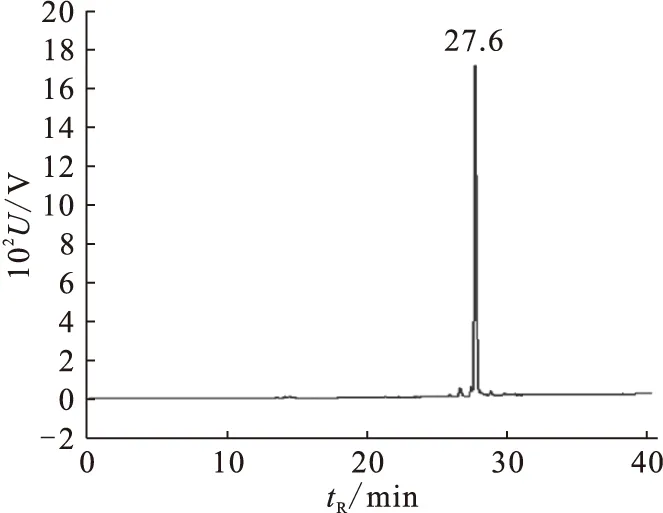
图5 Indole-MAMA-Re的HPLC谱图 Fig.5 HPLC analysis of Indole-MAMA-Re
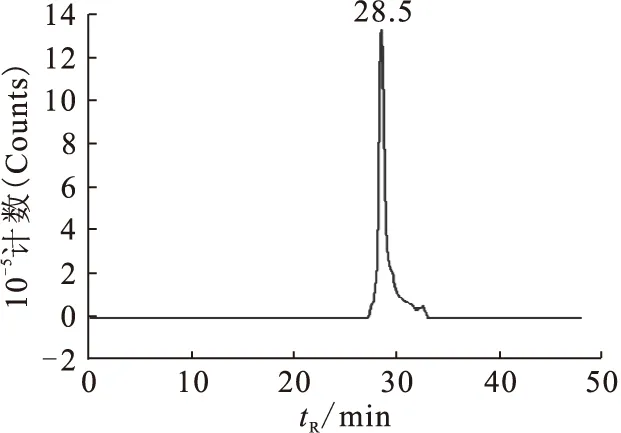
图6 99Tcm-Indole-MAMA 的HPLC谱图Fig.6 HPLC analysis of 99Tcm-Indole-MAMA
3 结 论
以对σ2受体具有高亲和力和高亚型选择性的1-(4-氟苯)-3-[4-(4-苯-1-哌嗪)-1-丁基]-1H-吲哚配体为先导化合物,设计了放射性碘和99Tcm标记的吲哚类σ2受体肿瘤放射性示踪剂,合成了其稳定化合物 (Indole-I和Indole-MAMA-Re) 和标记前体(Indole-MAMA),测定了Indole-I和Indole-MAMA-Re对σ1和σ2受体的亲和力。结果表明,在哌嗪环的苯环上不宜引入体积大的卤素取代基,在设计99Tcm标记物时,必须在保持σ2受体配体作用位点的前提下引入99Tcm螯合基团。99Tcm-Indole-MAMA与Indole-MAMA-Re的HPLC分析结果表明,制备的99Tcm-Indole-MAMA放化纯大于90%。今后可在本文化合物的基础上通过结构优化,设计合成对σ2受体具有高亲和力和选择性的吲哚类SPECT肿瘤显像剂。
[1] Vilner B J, John C S, Bowen W D. Sigma-1 and Sigma-2 Receptors are Expressed in a Wide Variety of Human and Rodent Tumor Cell Lines[J]. Cancer Res, 1995, 55(2): 408-413.
[2] Bourrie B, Bribes E, Derocq J-M, et al. Sigma Receptor Ligands: Applications in Inflammation and Oncology[J]. Curr Opi Invest Drugs, 2004, 5: 1 158-1 163.
[3] Quirion R, Bowen W D, Itzhak Y, et al. A Proposal for the Classification of Sigma Binding Sites[J]. Trends Pharmacol Sci, 1992, 13: 85-86.
[4] Mach R H, Smith C R, Al-Nabulsi I, et al. σ2Receptors as Potential Biomarkers of Proliferation in Breast Cancer[J]. Cancer Res, 1997, 57: 156-161.
[5] Wheeler K T, Wang L-M, Wallen C A, et al. Sigma-2 Receptors as a Biomarker of Proliferation in Solid Tumours[J]. Br J Cancer, 2000, 82(6): 1 223-1 232.
[6] Al-Nabulsi I, Mach R H, Wang L-M, et al. Effect of Ploidy, Recruitment, Environmental Factors, and Tamoxifen Treatment on the Expression of Sigma-2 Receptors in Proliferating and Quiescent Tumour Cells[J]. Br J Cancer, 1999, 81(6): 925-933.
[7] Mach R H, Wheeler K T. Imaging the Proliferative Status of Tumor With PET[J]. J Label Compd Radiopharm, 2007, 50: 366-369.
[8] 张秋艳,樊彩云,贾红梅.Sigma受体显像剂[J].化学进展,2007,19(5):713-721.
[9] Perregaard J, Ejner K, Sanchez C, et al. σ Ligands With Subnanomolar Affinity and Preference for the σ2Binding Site. 1, 3-(ω-Aminoalky1)-1H-Indoles[J]. J Med Chem, 1995, 38: 1 998-2 008.
[10] Bowen W D. Sigma Receptors: Recent Advances and New Clinical Potentials[J]. Pharm Acta Helv, 2000, 74: 211-218.
[11] 樊彩云,贾红梅,Deuther-Conrad W,等.新的99mTc 标记σ受体肿瘤显像剂[J].中国科学B辑,2005,35(6):499-503.
[12] Glennon R A. Pharmacophore Identification for Sigma-1(σ1) Receptor Binding: Application of the “Deconstruction- Reconstruction-Elaboration” Approach[J]. Mini-Rev Med Chem, 2005, 5: 927-940.
[13] Glennon R A. Binding Characteristics of σ2Receptor Ligands[J]. Brazilian J Pharm Sci, 2005, 41: 1-12.

