电化学调价制备2AFⅠ.二甲基羟胺和甲基肼的电解氧化
张 虎,叶国安,李 丽,邓惟勤,李会蓉,李高亮,杨小梅
中国原子能科学研究院 放射化学研究所,北京 102413
在先进后处理流程中使用二甲基羟胺(DMHAN)和甲基肼(MMH)作为钚的还原剂和支持还原剂时,为了达到1B中铀钚分离的要求,通常要使二甲基羟胺和甲基肼保持过量,这样在1BP中存在着剩余的还原剂。在对1BP料液调价制备2AF的过程中,首先要将过量的二甲基羟胺和甲基肼完全破坏,然后才能进行钚的价态转变。采用电化学方法进行料液调价,无需加入任何化学试剂,是一种清洁环保的调价技术[1-2]。本工作是电化学调价系列研究工作之一。
1 实验部分
1.1 仪器及装置
GC2014气相色谱仪,日本岛津公司;S-3100二极管阵列分光光度计,韩国SCINCO公司;LPS202双路稳压稳流电源,北京TRADEX公司;CHI660C电化学工作站,上海辰华仪器有限公司。钛基镀铂板电极为阳极、钛板电极为阴极,阴极和阳极电极面积均为18 cm2,阴极、阳极之间无隔膜,两极间距为1 cm,电解液体积为40 mL。
1.2 试剂
二甲基羟胺系实验室合成,气相色谱分析纯度大于95%;甲基肼为航天部一院101所产品,纯度大于99%;HNO3等其它试剂为北京化学试剂公司产品,分析纯。
1.3 实验方法
电解实验示意图示于图1。将配置好的电解液40 mL加入电解池,接通电源,调节电流(电压)到设定值后开始电解,记录电解时间、槽电压及阴极和阳极的电极电位(相对于饱和甘汞电极),电解过程不搅拌。实验过程中取电解池中部的样品,分析二甲基羟胺和甲基肼浓度随电解时间的变化,分析亚硝酸浓度随电解时间的变化。气体收集装置[3]示于图2。分别收集阴、阳极气体,采用气相色谱分析气体组成。

图1 电解实验示意图Fig.1 Electrolysis experiment sketch
循环伏安实验在20 ℃下进行,采用单室三电极体系,CHI102铂电极(φ=0.2 cm)为工作电极,饱和甘汞电极(SCE)为参比电极,CHI115铂丝电极为辅助电极。所用溶剂均为二次蒸馏水。电极使用前用3000#金相砂纸打磨,再用20~50 nm α-Al2O3抛光,然后用二次蒸馏水清洗。实验前通高纯氮气除氧。
1.4 分析方法
采用气相色谱法分析二甲基羟胺浓度、电解气体产物和液体产物;甲基肼浓度的分析采用对二甲胺基苯甲醛显色分光光度法(470 nm);亚硝酸浓度的分析采用α-萘胺显色分光光度法(510 nm)。
2 结果与讨论
2.1 MMH和DMHAN在铂电极上的循环伏安图
以铂电极为工作电极,分别对1.00×10-2mol/L DMHAN+0.10 mol/L HNO3溶液和1.00×10-3mol/L MMH+0.10 mol/L HNO3溶液进行循环伏安扫描测试,结果示于图3。DMHAN和MMH在铂电极上均产生一个不可逆氧化峰,随着扫描速度的增加,不可逆氧化峰电位发生正移,峰电流呈现增加趋势。MMH和DMHAN在铂电极上的反应为不可逆氧化反应。
2.2 MMH的电解
2.2.1电流密度J对MMH电解破坏的影响 在1.50 mol/L HNO3的电解液中,恒电流电解,考察不同电流密度下MMH浓度与电解时间的关系(图4)。由图4看出,随着电流密度的增加,电解速率加快。当电流密度为15.0 mA/cm2时,90 min可以将MMH破坏完全,电解液中MMH的浓度低于检测限。表1为电位与电流密度的关系。从表1可以看出,随着电解时间的增加,阳极电位Van和阴极电位Vca(相对于饱和甘汞电极电位)均向正电位方向变化,阳极电位变化得相对更快,槽电压V逐渐升高。在电解开始的时候,由于MMH的浓度较高,扩散速率较快,此时极化电位较低,相应的槽电压也较低;随着MMH的电解,浓度降低,扩散到电解表面发生反应的MMH的量减少,为了维持恒电流,极化电位升高,在5.0 mA/cm2时,电解40 min以后,槽电压从初始的1.4 V升高到2.4 V。

图3 DMHAN(a)和MMH(b)在铂电极上的伏安图 Fig.3 Cyclic voltoammograms of DMHAN(a) and MMH(b) in nitric acid media at Pt electrodec0(HNO3)=0.10 mol/L,初始扫描,阳极扫描(Initial scan direction: anodic),θ=20 ℃ (a):c0(DMHAN)=1.00×10-2 mol/L;v,V/s:1——0.01,2——0.02,3——0.03,4——0.04,5——0.05,6——0.06,7——0.07,8——0.08,9——0.09(b):c0(MMH)=1.00 mmol/L;v,V/s:1——0.05,2——0.10,3——0.20,4——0.30,5——0.40,6——0.50,7——0.60,8——0.80
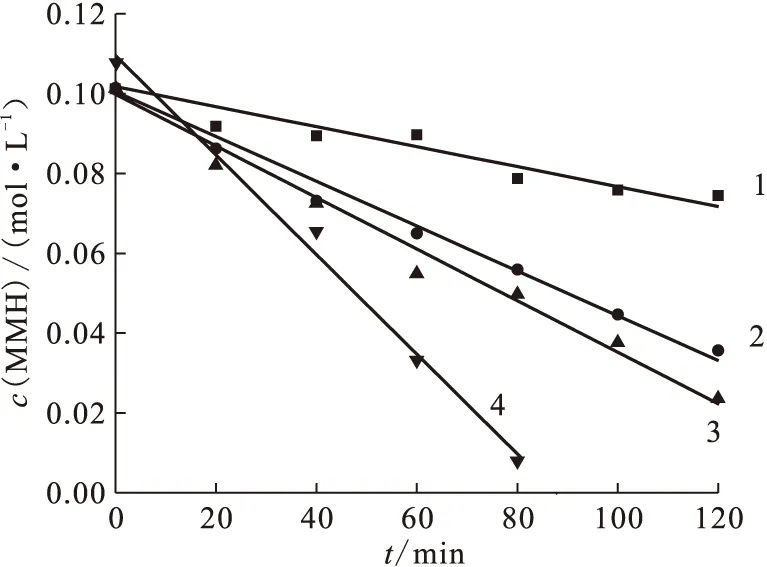
图4 不同电流密度J下MMH浓度与电解时间的关系Fig.4 Plots of MMH concentration vs electrolysis timec0(HNO3)=1.50 mol/L;1,2,3——c0(MMH)=0.100 mol/L;4——c0(MMH)=0.105 mol/LJ,mA/cm2:1——2.8,2——5.0,3——7.8,4——15.0
2.2.2HNO3初始浓度对MMH电解的影响 电解液中MMH浓度为0.107 mol/L,电流密度为5.0 mA/cm2,恒电流电解,改变HNO3初始浓度,考察HNO3初始浓度对MMH电解的影响,结果列于表2。在恒电流电解条件下,随着HNO3初始浓度的变化,MMH的电解速率没有明显变化,表明HNO3初始浓度对MMH的电解速率没有影响,HNO3在电解过程中只起到电解质的作用。
2.3 DMHAN的电解
2.3.1电流密度对DMHAN电解破坏的影响 在含0.10 mol/L DMHAN、1.50 mol/L HNO3的电解液中,恒电流电解,考察不同电流密度下DMHAN浓度与电解时间的关系(图5)。在同样的电解条件下,DMHAN电解的速率要快于MMH。在电流密度为15.0 mA/cm2时,MMH需要90 min电解完全,而DMHAN在40 min就可电解完全。在恒电流电解时,DMHAN浓度与电解时间成线性关系,直线斜率为电解速率常数。电流密度增大,电解速率相应加快。HNO3初始浓度为1.50 mol/L时不同电流密度下的电解速率常数k值列于表3。

表1 电位与电流密度的关系Table 1 Electrode potential vs current density
注(Note):c0(HNO3)=1.50 mol/L;c0(MMH)=0.100 mol/L
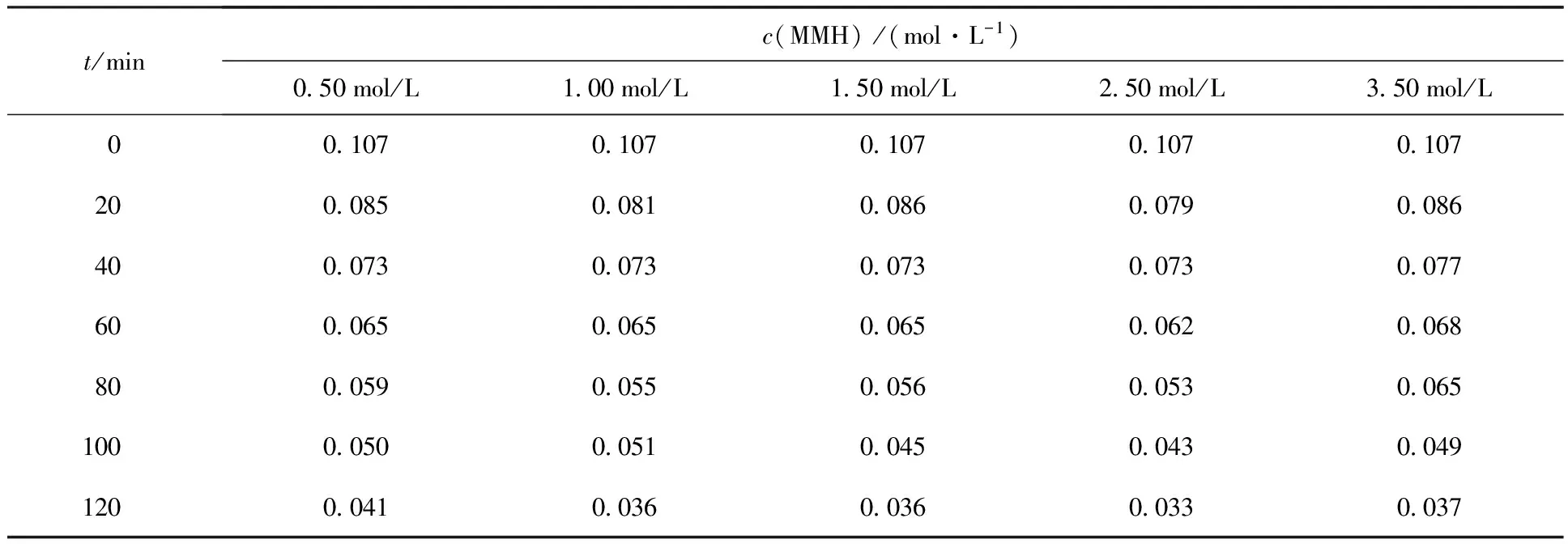
表2 不同HNO3初始浓度对MMH电解速率的影响Table 2 Effection of initial nitric concentration on electrolysis MMH
注(Note):J=5.0 mA/cm2;c0(MMH)=0.107 mol/L
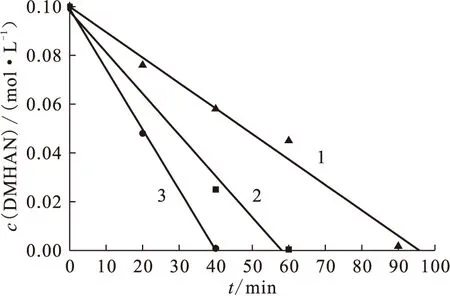
图5 DMHAN浓度与电解时间的关系Fig.5 Plots of DMHAN concentration vs electrolysis timec0(HNO3)=1.50 mol/L;c0(DMHAN)=0.10 mol/LJ,mA/cm2:1——2.8,2——10.0,3——15.0
2.3.2HNO3初始浓度对DMHAN电解的影响 配制c(DMHAN)=0.10 mol/L的HNO3溶液,电流密度为5.0 mA/cm2,恒电流电解下,考察HNO3初始浓度的改变对DMHAN电解的影响(表4)。实验结果表明,HNO3初始浓度对DMHAN的电解有着显著的影响。随着HNO3初始浓度的增大,电解速率明显提高。在实验中,当HNO3初始浓度大于2.00 mol/L时,在20 min时通过气相色谱无法检测到DMHAN的存在。为了弄清楚在HNO3初始浓度大于2.00 mol/L时DMHAN被迅速破坏的原因,在重复实验中缩短取样时间间隔,实验结果表明,在电解开始的几分钟之内,DMHAN的浓度缓慢降低,但是随后DMHAN的浓度迅速降低。

表3 DMHAN电解速率常数kTable 3 Rate constant of electrolysis DMHAN
注(Note):c0(HNO3)=1.50 mol/L;c0(DMHAN) =0.10 mol/L
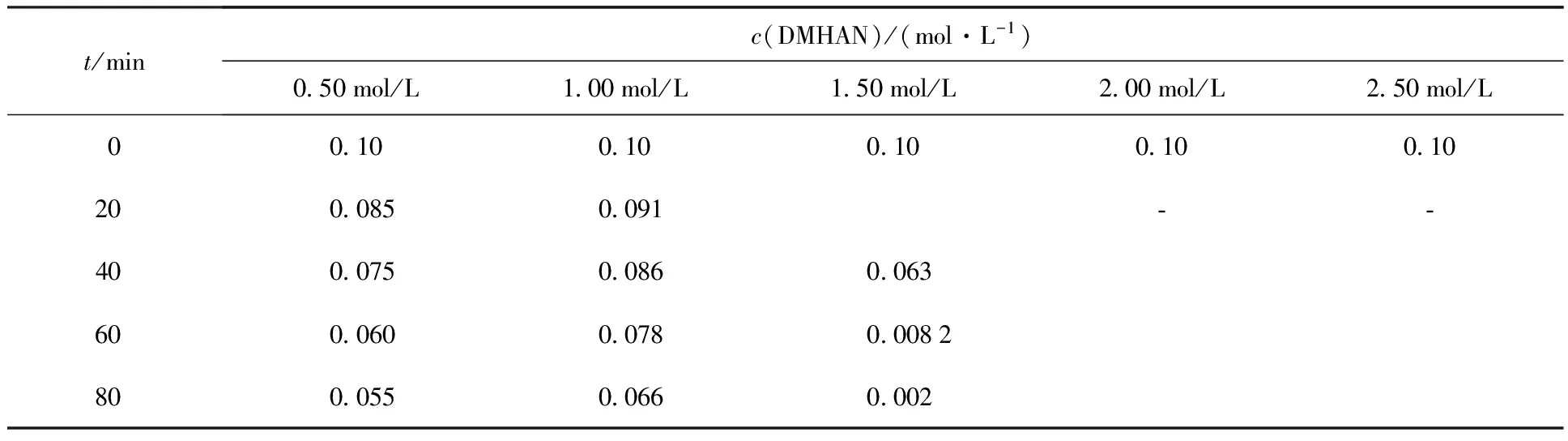
表4 HNO3初始浓度对DMHAN电解的影响Table 4 Effection of initial nitric concentration on electrolysis DMHAN
注(Note):c0(DMHAN)=0.10 mol/L,J=5.0 mA/cm2
HNO3初始浓度分别为0.50 mol/L和2.50 mol/L时DMHAN电解过程中阴、阳极的电极电位数据列于表5。从表5看出,在HNO3初始浓度为0.50 mol/L时,阳极电位缓慢下降而不是上升,从最初的2.06 V降低到2.00 V,同时阴极电位向正电位方向缓慢上升,总的槽电压则表现为恒定值2.8 V,在80 min的电解时间内溶液颜色无明显变化。在HNO3初始浓度为2.50 mol/L时,电极电位经过开始阶段的稳定期后迅速下降,阳极电位从1.95 V下降到1.24 V,槽电压也从2.6 V下降到1.7 V,之后又缓慢上升。电解10 min时溶液颜色逐渐变为棕黄色,同时阴极产生大量气体,遇空气变为棕黄色,这是NO气体的特征反应,此时槽电压变为1.7 V。实验表明HNO3的存在加快了DMHAN的破坏,反应机理将在随后进行讨论。
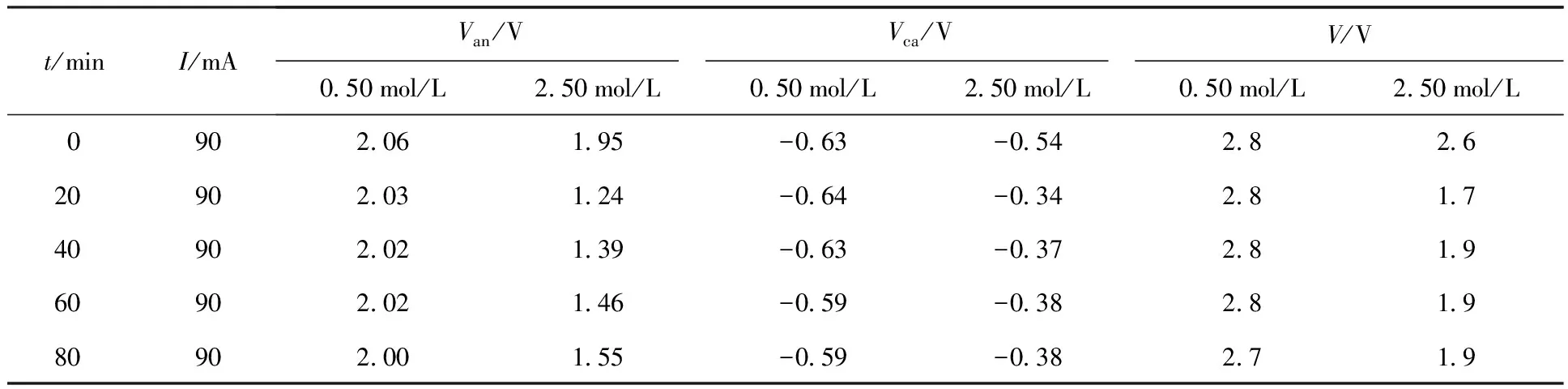
表5 不同HNO3初始浓度下DMHAN电解时的电极电位Table 5 Electrode potential of electrolysis DMHAN at different initial nitric concentrations
注(Note):c0(DMHAN)=0.10 mol/L
2.4 DMHAN和MMH同时存在时的电解过程
在1BP中DMHAN和MMH是同时存在的,1BP中DMHAN浓度约为0.093 mol/L、MMH浓度约为0.15 mol/L,HNO3初始浓度约为1.50 mol/L。电流密度对DMHAN和MMH同时存在时的电解示于图6。在MMH未电解之前,DMHAN浓度几乎保持不变,当MMH电解破坏后,DMHAN在极短的时间内迅速反应完全。之前对DMHAN和MMH电化学动力学的研究中,测得DMHAN的平衡电位为0.47 V(vs.SCE),MMH的平衡电位为0.31 V(vs.SCE)。由于MMH的电位较低,在铂电极上首先被电解氧化。当MMH被完全电解破坏后,在阴极表面产生大量无色气体,遇空气变为棕黄色,同时槽电压降低。这表明当电解液中有MMH存在时,DMHAN在阳极上发生缓慢的直接电解氧化反应。当MMH被电解氧化后,DMHAN的反应主要是发生在阴极表面的间接氧化反应。
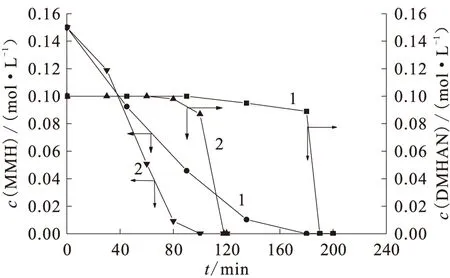
图6 DMHAN和MMH浓度与电解时间的关系Fig.6 Plots of DMHAN and MMH concentration vs electrolysis timec0(HNO3)=2.50 mol/L,c0(DMHAN)=0.10 mol/L,c0(MMH)=0.15 mol/LJ,mA/cm2:1——10,2——20
实验表明,当有DMHAN存在时可以加快MMH的电解。当电流密度增大时,MMH的电解速率加快,电解速率与电流密度呈近似线性关系。当有DMHAN存在时,HNO3浓度增加会加快MMH的电解速率,说明电解反应中存在着MMH与电解产物之间的化学反应,从而加速了MMH的反应。
2.5 电解过程中HNO2浓度的变化
图7(a)为0.10 mol/L DMHAN的HNO3溶液电解过程中HNO2浓度随时间的变化。HNO3初始浓度对HNO2的产生有着明显的影响,HNO3初始浓度为1.50 mol/L时,电解30 min内并未产生HNO2,之后迅速出现HNO2浓度的峰值,随后HNO2浓度逐渐保持在大约10-2mol/L。而当HNO3初始浓度为2.50 mol/L时,HNO2峰值出现的时间明显提前,在电解开始几分钟之内HNO2浓度就已经达到10-2mol/L。

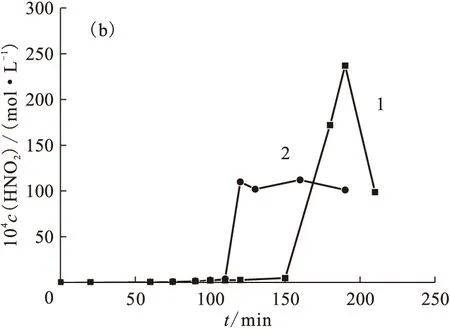
图7 HNO2浓度随电解时间的变化Fig.7 Plots of HNO2 concentration vs electrolysis timec0(DMHAN)=0.10 mol/L,J=20 mA/cm2 c0(HNO3),mol/L:1——1.50,2——2.50c0(MMH),mol/L:(a)——0,(b)——0.15
图7(b)为MMH和DMHAN同时存在时,HNO3初始浓度分别为1.50和2.50 mol/L时,电解过程中HNO2浓度随时间的变化。由于有MMH的存在,在MMH未电解完全之前,HNO2不会大量产生,当MMH电解破坏完全之后,很快出现了HNO2的浓度峰。

2.6 DMHAN和MMH电解产物
2.6.1DMHAN电解产物及组成 图8为DMHAN电解气体体积与时间的关系。标为1、2的体系中DMHAN初始浓度为0.10 mol/L,HNO3初始浓度为1.50 mol/L;标为3的体系为纯的1.50 mol/L HNO3水溶液,不含DMHAN。从图8可见,DMHAN存在时,阳极气体产生的量很少,在0.10 A的电流下电解1 h,阳极产生气体体积仅为3.5 mL。而在阴极,电解开始阶段气体的产量较为缓慢,之后阴极发生剧烈的反应,放出大量气体直到阴极反应结束。阴极产生的无色气体,遇空气变为棕黄色。停止电解后,用气相色谱分析电解液中的液相产物,发现电解液中有甲醇存在,同时有少量乙醇存在。而采用1.50 mol/L HNO3溶液进行电解时,阳极气体的产量明显增大,电解90 min内阴极无明显的气体产生。将电解质换为0.75 mol/L硫酸溶液,DMHAN仍然为0.1 mol/L,重复上述实验,阴极产生大量无色气体,遇空气无颜色变化,在电解过程中电解液的颜色无变化。上述实验表明,DMHAN的HNO3溶液电解时,阴极放出大量气体,是由于HNO3和DMHAN共同参与了化学反应。采用气相色谱分析DMHAN的HNO3溶液电解时,阴极产生气体的组成,其中N2O的体积百分数超过50%,NO约为5%,其余组成包括少量H2(小于1.5%)、O2(小于0.1%)和N2(13%)等,尽管还不能给出所有组分和它们的相对百分含量,但是已有的结果依然有助于推测电解反应的机理。
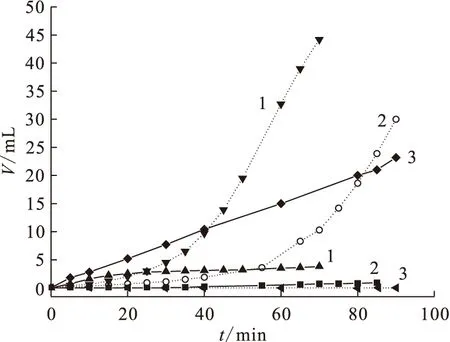
图8 DMHAN电解气体体积与时间的关系Fig.8 Plots of gaseous volume of electrolysing DMHAN vs electrolysis time1,2:c0(DMHAN)=0.10 mol/L, c0(HNO3)=1.50 mol/L;3:c0(HNO3)=1.50 mol/L, c0(DMHAN)=0 mol/LI,A:1——0.10,2——0.05,3——0.10实线阳极,点线阴极(Real line: anode; broken line: cathode)
2.6.2MMH电解气体及组成 在0.1 mol/L MMH、1.50 mol/L HNO3溶液中,电解电流为0.10 A的条件下进行电解实验,分别测量阴阳极产生气体体积,结果示于图9。从阴极和阳极产生气体的体积可以看出,阳极产生气体明显多于阴极,MMH的电解主要发生在阳极,是阳极的电解氧化反应。分别收集阴极和阳极气体,采用气相色谱分析气体的组成。分析结果列于表6。表6结果说明,在阳极MMH的电解氧化产生N2。 在阴极,由于超电势较高,发生了不同程度的HNO3电解还原反应,生成不同价态的氮氧化物和氮气,同时伴随有少量水的电解。对DMHAN和MMH在阴极和阳极电解气体的研究表明,DMHAN的电化学反应主要发生在阴极,而MMH主要发生阳极的电解氧化反应[5]。
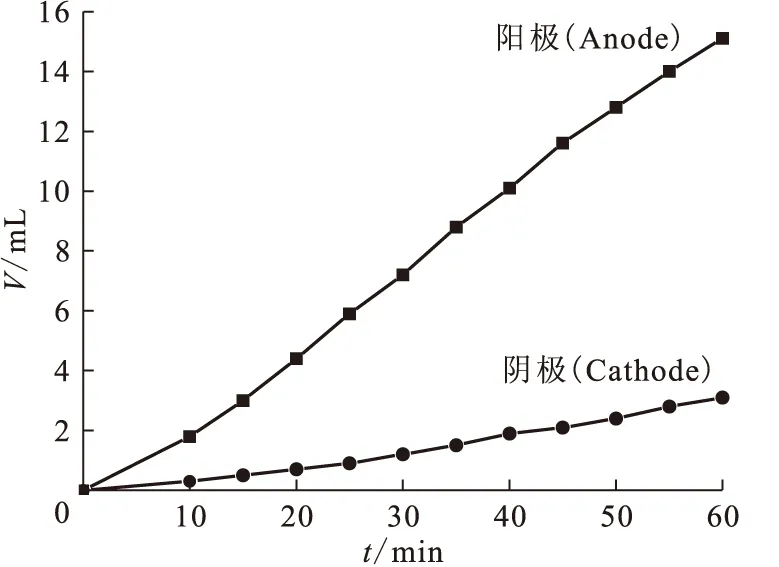
图9 MMH电解气体体积与时间的关系Fig.9 Plots of gaseous volume of electrolysing MMH vs electrolysis timec0(MMH)=0.1 mol/L,c0(HNO3)=1.50 mol/L,I=0.10 A

气体(Gases)ϕ/%阴极(Cathode)阳极(Anode)H2<15<15O2068N23583N2O2615NO231<10
2.7 DMHAN、MMH电解反应机理
通过以上的研究表明,DMHAN、MMH、HNO3在电解过程中发生了复杂的化学反应。循环伏安图(图3)表明DMHAN和MMH在铂电极上的反应为不可逆氧化反应,在阴极不发生直接电化学还原反应。MMH被电解氧化破坏后,DMHAN在阴极发生间接氧化反应,HNO3参与了电解反应。可能的反应机理如下所述。
(1) 阴极区反应
H2O(E⊖=+0.94 V)
(1)

(2)
3HNO2+2CH3OH
(3)

N2O+2CH3OH
(4)



其中反应式(1)为HNO3的电解还原,通常在HNO3浓度大于3 mol/L时反应才会较明显。由于式(3)中DMHAN可以与HNO3反应产生HNO2,在HNO2的催化作用下,使得式(1)中HNO3在较低浓度时也能够发生电解还原。HNO2能够自催化还原HNO3,HNO2的积累可以加速反应式(2)的进行[6];反应式(4)为DMHAN与HNO2的反应,该反应存在诱导期,当HNO2积累到一定浓度后DMHAN可迅速被HNO2氧化。
(2) 阳极区的反应[5]
CH3OH+N2+5H+
N2+CH3OH+N2O+2H2O+H+
DMHAN和MMH同时存在下HNO3体系中的电解过程推测如下:由于DMHAN氧化电位较MMH高,溶液中有MMH存在时,首先进行的是阳极上MMH的电解氧化,此时阴极发生的反应较为复杂,包括HNO3的电解还原、氢离子电解还原生成氢气等。当MMH未电解完全时溶液中不存在HNO3。当MMH被电解氧化后,DMHAN与HNO3反应产生HNO2,在HNO2的自催化作用下,HNO3在阴极发生电解还原反应生成HNO2。同时HNO2又可以自催化式(2)和式(3)的反应。随着阴极区生成的HNO2浓度不断增大,经过短暂的诱导期后,DMHAN快速与HNO2反应产生N2O。HNO2又可以经过分解、氧化等步骤生成氮氧化物。生成的甲醇可被进一步电解氧化为甲酸。
3 电流效率及工业应用分析
仅对体系中的MMH进行电流效率(η)计算(表7),MMH电解的电流效率均大于100%,表明MMH在电解过程除了发生阳极的直接氧化,还与阴极区产生的HNO2发生了化学反应,加速了MMH的氧化,造成MMH电解的η>100%,这与电解反应机理的推测相符。
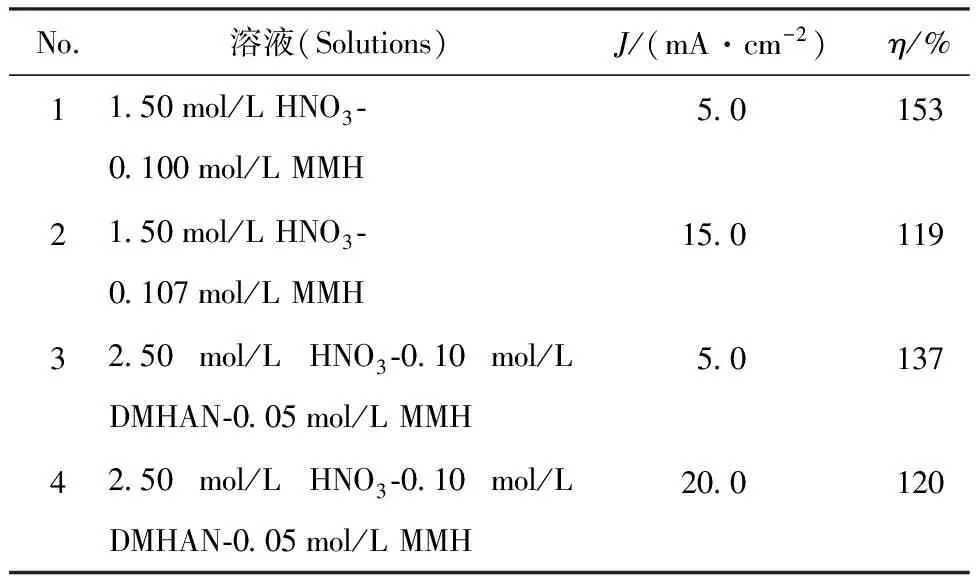
表7 MMH电解的电流效率Table 7 Current efficiency of electrolysis MMH
对电解气体产物的分析表明,气体中氢气的体积分数小于1.5%。由于氢气的爆炸极限为4%~74.2%(体积分数),故电解产生的气体是安全的。当MMH被电解氧化后,DMHAN在阴极的间接氧化反应,会在短时间内释放出大量气体,形成气峰,由图9还可计算出气峰的产生量约为0.7~1.2 L/(A·h)。
4 结 论
DMHAN和MMH在铂电极上的反应为不可逆氧化反应。DMHAN和MMH同时存在时,阳极主要发生MMH的直接电解氧化反应。MMH被完全破坏后,DMHAN在阴极发生间接的氧化反应,HNO3初始浓度升高有利于提高电解速率。电解产生的气体(0.7~1.2 L/(A·h))中,氢气的体积分数小于1.5%,由于氢气的爆炸极限为4%~74.2%(体积分数),故电解产生的气体是安全的。
[1] Baumgartner F, Schmieder H. Use of Electrochemical Process in Aqueous Reprocessing of Fuels[J]. Radiochimica Acta, 1978, 25: 191-210.
[2] Schmieder H, Galla U. Eelctrochemical Processes for Nuclear Fuel Reprocessing[J]. J Appl Electrochem, 2000, 30: 210-207.
[3] 李兆义,何建玉,蒋栋梁,等.普雷克斯过程电解还原分离铀钚时产生气体的研究[J].原子能科学技术,1982,16(3):288-291.
[4] 叶国安,何建玉.硝酸在惰性电极上还原机理的研究[J].核化学与放射化学,1998,20(4):193-201.
[5] King D M, Bard A J. The Electrochemistry of the Methylhydrazines[J]. J Am Chem Soc, 1965, 87: 3.
[6] Katz J J, Seaborg G T, Morss L R. The Chemistry of the Actinide Elements[M]. London/New York: Chapman and Hall, 1986: 1 142.

