少动鞘氨醇单胞菌引起小儿败血症合并脑膜炎1例
陈明亮,王刚毅,许学斌,金汇明,陈敏,邵祝军,张曦
1. 上海市疾病预防控制中心,上海200336; 2. 中国疾病预防控制中心,北京102206
少动鞘氨醇单胞菌是革兰阴性非发酵菌,为鞘氨醇单胞菌属。该菌在环境中广泛存在,为条件致病菌,主要感染手术后和免疫力低下人群,可引起医院内感染和社区获得性感染。2008年3月,上海市疾病预防控制中心微生物实验室从某医院送检的1位脑膜炎患儿血液中分离出1株鞘氨醇单胞菌,经革兰染色、系统生化反应,鉴定为少动鞘氨醇单胞菌,同时该患儿伴有细菌性脑膜炎,故予以报道。
1 病例资料
患儿,男,2岁,因突发高热2 d,于2008年3月3日入某医院治疗。患者有A群流脑多糖疫苗接种史(2006年7月24日和2006年11月10日),无流行性脑脊髓膜炎患者接触史。
1.1 入院体格检查
体温39.5 ℃,头颈及四肢皮肤见少量散在瘀点,无颈项强直,无意识障碍,克氏征及布氏征阴性。实验室血常规检查:白细胞17.9×109/L,中性粒细胞87%;实验室脑脊液常规检查:脑脊液外观呈乳白色、微混、无凝块,潘氏试验阳性,白细胞810×106/ L,葡萄糖 3.3 mmol/L,蛋白质>0.45 g/L。临床诊断为细菌性脑膜炎。给予患儿青霉素钠和头孢噻肟静脉滴注治疗,体温逐渐恢复正常,皮肤瘀点亦逐步散去,于2008年3月10日痊愈出院。
1.2 脑脊液与全血细菌的分离和鉴定
将全血注入血培养瓶(BD公司,美国)中培养,于第3天液体变混,接种于血琼脂平板、巧克力平板和麦康凯平板,同时以未接种的上述3种平板作为空白对照,分别置于35 ℃需氧和35 ℃ 5% CO2环境中培养48 h。空白对照平板上无菌落生长,血琼脂平板和巧克力平板上皆出现细小菌落。血琼脂平板上菌落光滑湿润、圆整突起、不溶血、黄色,直径0.5~1 mm(图1),经革兰染色为阴性杆菌。脑脊液沉渣经培养无菌落生长。
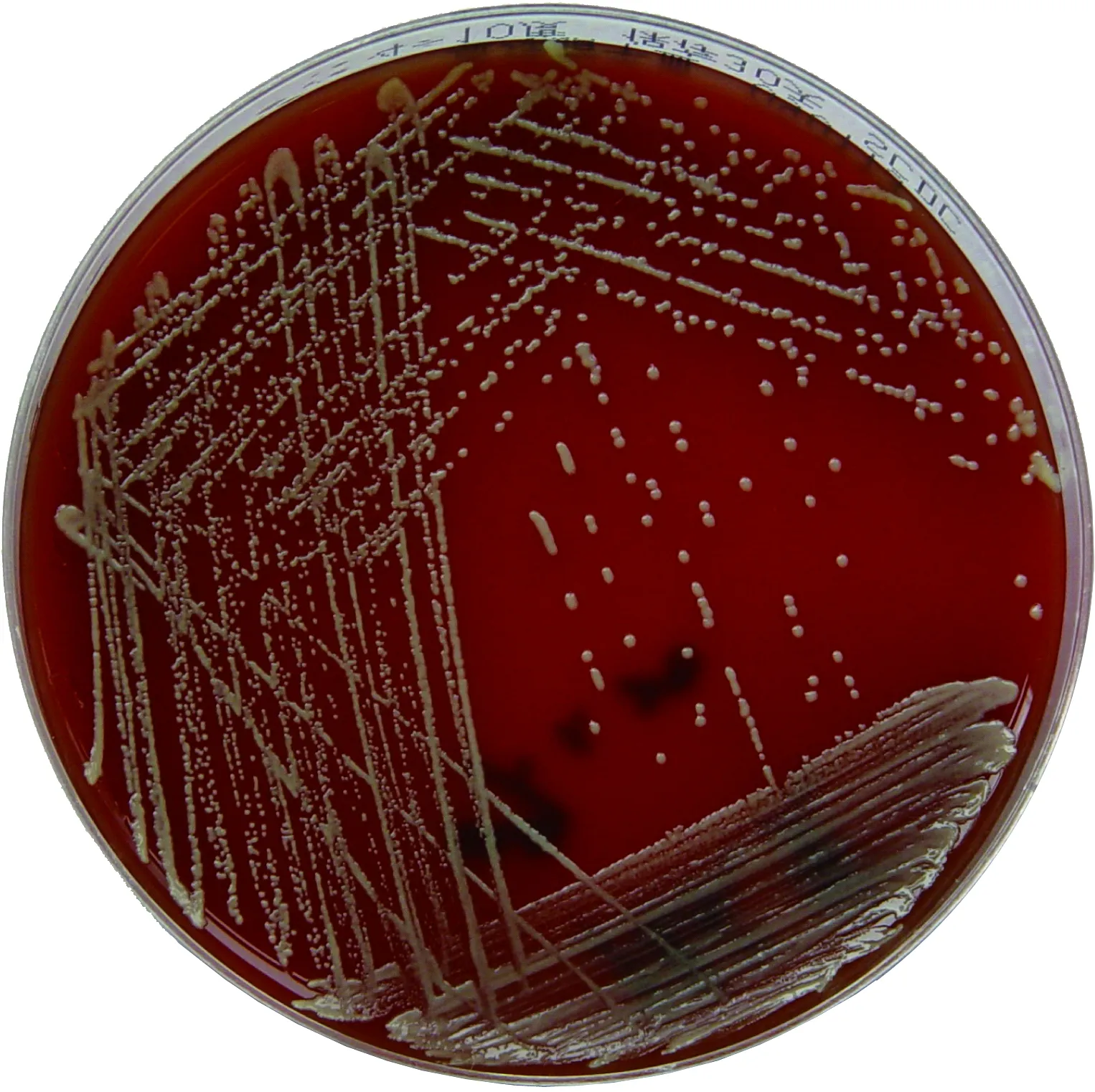
Culture media, blood agar
图1少动鞘氨醇单胞菌的菌落形态
Fig.1BloodcultureshowsgrowthofSphingomonaspaucimobilis
1.3 生化鉴定及药敏试验
氧化酶试验阳性,选用纯化培养物做全自动微生物鉴定系统VITEK Ⅱ的GN卡和API 20 NE手工编码鉴定,结果均为少动鞘氨醇单胞菌。其中VITEK Ⅱ的鉴定可信度98.14%;API 20 NE的鉴定编码为0446600,为少动鞘氨醇单胞菌的可能性(ID%)99.6%。经纸片扩散法测试,该菌对氨苄西林、阿莫西林/克拉维酸、头孢吡肟、头孢噻肟、头孢他啶、亚胺培南、美洛培南、庆大霉素、阿米卡星、四环素、环丙沙星、左氧氟沙星、诺氟沙星、复方磺胺甲唑、利福平均敏感,仅对氨曲南、阿奇霉素耐药。
2 讨论
少动鞘氨醇单胞菌于1977年从临床病例中分离并首次被命名,分类上曾属于假单胞菌属中的少动假单胞菌(Pseudomonaspaucimobilis)[1],1990年将其归于鞘氨醇单胞菌属的少动鞘氨醇单胞菌(Sphingomonaspaucimobilis)。曾普遍认为该菌广泛存在于各种水源[2],临床病例罕见。该菌培养特征为相对苛养,在固体和液体培养基上均生长缓慢,一般需2 d以上。
近年来发现少动鞘氨醇单胞菌可引起医院内感染及社区获得性感染[2-4],目前已有该菌引起胆管感染、透析相关性腹膜炎、泌尿道感染、呼吸器相关性肺炎、创口感染、骨髓炎、次发性脓毒性关节炎及术后眼内炎的报道。手术后和免疫力低下人群为该菌的主要感染对象,所发病例均为散发,传染性低。作为条件致病菌,少动鞘氨醇单胞菌引起的败血症兼小儿脑膜炎病例实属罕见,对其致病机制有待进一步研究。
细菌性脑膜炎是一种急性脑膜炎症,是由细菌感染而激发脑脊液中多形核白细胞产生的反应[5]。尽管目前国际上采用了广泛的抗生素治疗及其他更先进的治疗手段,脑膜炎的发病率和病死率仍居高不下[6]。脑膜炎具有典型的三联征,即发热、颈项强直和意识改变。细菌性脑膜炎的病原体因患者的年龄而异,在全世界婴幼儿中,肺炎链球菌、脑膜炎奈瑟菌和b型流行性感冒嗜血杆菌是引起细菌性脑膜炎的主要致病原[7,8]。
从本例患儿血标本中分离出少动鞘氨醇单胞菌,标本培养阳性,而对照标本未见杂菌,由此诊断为败血症合并脑膜炎。当然,如能获得2次标本并进行测定,则更有说服力;但由于条件限制,未能再次获得标本。
遗憾的是,本实验室未能从该病例的脑脊液中分离出致病菌,但其脑脊液生化常规结果提示为典型的细菌性脑膜炎特征(白细胞增多、葡萄糖减少、蛋白质含量升高),支持该病例为细菌性脑膜炎的临床诊断。由于脑脊液标本的致病菌分离率随用药而急剧下降[9],且本例中所采的血和脑脊液标本均未能进行床边接种,所以可能导致本例的细菌检出率急剧下降。因此,在进行细菌性脑膜炎的监测工作中,需特别强调标本床边接种的重要性。
此次病例的症状及体征表现为高热和皮肤出现瘀点,与普通型流行性脑脊髓膜炎的败血症期症状相似,后者可表现为恶寒、高热、头痛、呕吐、肌肉酸痛、神志淡漠,且约70%患者出现瘀点、瘀斑;此外,该病例在春季发病,而流行性脑脊髓膜炎多发于冬、春季,似乎难与脑膜炎奈瑟菌引起的脑膜炎相区别。但鉴于该患儿血培养提示为少动鞘氨醇单胞菌,认为患有败血症及脑膜炎。根据本例结果,我们提出,少动鞘氨醇单胞菌引起的小儿脑膜炎存在与春季小儿流行性脑脊髓膜炎相鉴别诊断的临床价值,而临床实验室对血和脑脊液的早期检测有助于早期发现和治愈细菌性脑膜炎。虽然少动鞘氨醇单胞菌对多种抗生素敏感,但考虑到目前假单胞菌属易获得耐药性甚至多重耐药性机制,需引起临床实验室的重视。
[1] Holmes B, Owen RJ, Evans A, Malnick H, Willcox WR. Pseudomonas paucimobilis, a new species isolated from human clinical specimens, the hospital environment, and other sources [J]. Int J Syst Bacteriol, 1977, 27: 133-146.
[2] Dervisoglu E, Meric M, Kalender B, Sengul E. Sphingomonas paucimobilis peritonitis: a case report and literature review [J]. Perit Dial Int, 2008, 28(5): 547-550.
[3] Charity RM, Foukas AF. Osteomyelitis and secondary septic arthritis caused by Sphingomonas paucimobilis [J]. Infection, 2005, 33 (2):93-95.
[4] Seo SW, Chung IY, Kim E, Park JM. A case of postoperative Sphingomonas paucimobilis endophthalmitis after cataract extraction [J]. Korean J Ophthalmol, 2008, 22 (1): 63-65.
[5] Mace SE. Acute bacterial meningitis [J]. Emerg Med Clin North Am, 2008, 26(2): 281-317.
[6] Durand ML, Calderwood SB, Weber DJ, Miller SI, Southwick FS, Caviness VS Jr, Swartz MN. Acute bacterial meningitis in adults. A review of 493 episodes [J]. N Engl J Med, 1993, 328 (1): 21-28.
[7] Schuchat AK, Robinson JD, Wenger LH, Harrison LH, Farley M, Reingold AL, Lefkowitz L, Perkins BA. Bacterial meningitis in the United States in 1995. Active Surveillance Team [J]. N Engl J Med, 1997, 337 (14): 970-976.
[8] Dawson KG, Emerson JC, Burns JL. Fifteen years of experience with bacterial meningitis [J]. Pediatr Infect Dis J, 1999, 18 (9): 816-822.
[9] Kanegaye JT, Soliemanzadeh P, Bradley JS. Lumbar puncture in pediatric bacterial meningitis: defining the time interval for recovery of cerebrospinal fluid pathogens after parenteral antibiotic pretreatment [J]. Pediatrics, 2001, 108(5): 1169-1174.

