液-液萃取衍生气相色谱法测定饮用水中卤乙酸
陈小丽 陈 敏 梁春霞
(广州铁路疾病预防控制中心,广州 510010)
氯气在消毒过程中同水体中存在的部分天然有机物发生反应,产生消毒副产物(DBPs),如三卤甲烷(THMs)、卤乙酸(HAAs)等,从而增加了饮用水的致癌风险[1]。研究表明,HAAs的致癌风险占消毒副产物总致癌风险的91.9%以上[2]。世界卫生组织和许多国家的水质标准中都规定了卤乙酸的限值,我国2006年颁布的《生活饮用水卫生标准》(GB 5749-2006)中增加了卤乙酸中的二氯乙酸(DCAA)和三氯乙酸(TCAA)2个指标的限值。卤乙酸的分析检测方法有衍生-气相色谱法、气相色谱-质谱法、离子色谱法、毛细管电泳等[3],但由于对方法的灵敏度、可靠性和简便性方面的要求,美国EPA批准并推荐使用的方法只有EPA 552.1、EPA 552.2和6251B标准方法3种,这些方法基于从水样中萃取卤乙酸,衍生化成酯后用GC-ECD测定。
笔者参考GB/T 5750-2006[4]采用液-液萃取,对5种卤乙酸甲酯化后用气相色谱法电子捕获检测器检测,取得了较满意的结果。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪:GC-2010型,配ECD检测器,日本岛津公司;
漩涡振荡器:MS3型,德国IKA公司;
电热恒温水浴锅:HWS26型,上海一恒科学仪器有限公司;
标准物质:一氯乙酸(MCAA,99.5%)、二氯乙酸(MCAA,99.5%)、三氯乙酸(TCAA,99.5%)、一溴乙酸(MBAA,98.4%)、二溴乙酸(DBAA,98.8%),均为色谱纯,美国Chem Service公司;
内标:1,2-二溴丙烷(1,2-DBP,99.5%),色谱纯,美国Chem Service公司;
甲醇:色谱纯;
叔丁基甲醚:色谱纯;
硫酸钠:分析纯,于600℃烘烤2 h;
浓硫酸:优级纯;
实验用水为超纯水。
1.2 色谱条件
色谱柱:HP-5石英毛细管柱(30 m×0.32 mm, 0.25 μm);柱温采用程序升温:初温40℃,保持5 min,以10℃/min升至140℃,然后再以20℃/min升至240℃, 保持4 min;进样口温度:220℃,检测器温度:300℃;载气(氮气)流量: 1.0 mL/min;尾吹气流量:30 mL/min;分流比为10∶1。
1.3 水样采集和保存
取250 mL玻璃瓶(经10%硝酸浸泡过夜后用纯水冲洗晾干,于120℃烤箱烘烤2 h,放凉),以100 mg/L水样比率加入颗粒状氯化胺( 把水样中游离氯残留转变为结合氯,防止生成更多的卤乙酸和生物降解),沿瓶壁缓慢注入水样至充满(注意不要让水溢出),盖上瓶塞,上下翻转振摇使氯化胺溶解。同时用水充满采样瓶作为现场空白。 水样于4℃冰箱保存,7 d内分析完毕[4]。
1.4 标准溶液配制
准确称取一定量的标准物质MCAA、DCAA、TCAA、MBAA、DBAA分别为40、10、10、10、10 mg于5个10 mL容量瓶中,用甲醇溶解并定容至刻度,得到各溶液浓度分别为4.0、1.0、1.0、1.0、1.0 mg/mL的标准储备溶液。准确吸取上述单一的标准溶液各100 μL于10 mL容量瓶中,用甲醇定容至刻度,混匀,得混合标准溶液,其中5 种卤乙酸的浓度分别为MCAA 40 μg/mL, DCAA、TCAA、MBAA、DBAA均为10 μg/mL。
1.5 内标液配制
取内标物质1,2-DBP 5.2 μL滴入预先盛有5mL甲醇的10 mL容量瓶中,用甲醇定容至刻度,内标储备液浓度为1.0 mg/mL。移取100 μL内标储备液用甲醇定容至5 mL容量瓶中,内标液浓度为20 μg/mL。
1.6 样品前处理
(1) 萃取
准确吸取25 mL水样于50 mL具塞比色管中,加入内标液100 μL,浓硫酸1 mL,趁余热立即加入2 g硫酸钠固体,振摇溶解。准确加入3 mL叔丁基甲醚萃取液,密封后于漩涡振荡器振荡1 min,静止5 min让水相和有机相分层。
(2) 衍生化
移取上清液2 mL置于预先装有2 mL 10%硫酸-甲醇溶液(现配现用,以免生成硫酯)的具塞试管中,盖上塞子,封口膜密封,摇匀后置于50℃水浴中进行酯化反应1 h。取出置于4℃冰箱冷却10 min,然后加入8 mL 100 g/L硫酸钠溶液抑制酯化反应并帮助两相分离,振摇1 min,静止2 min,用吸管取上层液于样品瓶中进行色谱分析。
1.7 工作曲线绘制
分别吸取混合标准溶液0、12.5、25、50、100、200 μL及内标液100 μL于50 mL具塞比色管中,分别用超纯水定容至25 mL,系列混合标准工作溶液的浓度为MCAA:0、20、40、80、160、320 μg/L;DCAA、TCAA、MBAA、DBAA均为0、5、10、20、40、80 μg/L,内标浓度为80 μg/L。以下步骤同样品前处理。
2 结果与讨论
2.1 色谱条件优化
色谱柱初温较低,在此时间区主要出溶剂峰和甲醇峰,因内标和卤乙酸甲酯的沸点温度比较高,不会影响待测组分的灵敏度和分离能力。选用上述的色谱条件对标准溶液样品进行测定,MCAA、DCAA、TCAA、MBAA、DBAA的甲酯化产物和内标1,2-DBP均能获得较好的分离,14 min 内6种物质全部分析完毕,标准图谱如图1所示。
2.2 衍生化时间的确定
50μg/L的5种卤乙酸标准分别用10%硫酸-甲醇酯化1 h和 2 h,依照确定的色谱条件进行检测后,将酯化2 h各色谱峰面积除以酯化1 h相应的色谱峰面积,得到酯化2 h和1 h的标准峰面积比。发现衍生化2 h和1 h的酯化程度相差不大,为了达到快速检测的目的,确定衍生化时间为1 h。

1—MCAA; 2—MBAA; 3—DCAA; 4—内标1,2-DBP;5—TCAA; 6—DBAA图1 5种卤乙酸甲酯和内标的色谱图
2.3 线性范围及检出限
按确定的分析条件测定系列混合标准工作溶液,各浓度平行测定2次,以保留时间定性,内标法定量。以标准峰面积与内标峰面积比为纵坐标(Y),标准浓度与内标浓度比为横坐标(X)分别绘制5种卤乙酸的工作曲线,以仪器2倍噪声计算方法检出限。从配制的工作曲线系列测定结果分析,5种卤乙酸中MCAA在浓度范围20~320 μg/L,其它4种卤乙酸在浓度范围5~80 μg/L内均具有良好的线性,相关系数均大于0.99。5种卤乙酸的线性回归方程、相关系数及检出限见表1。
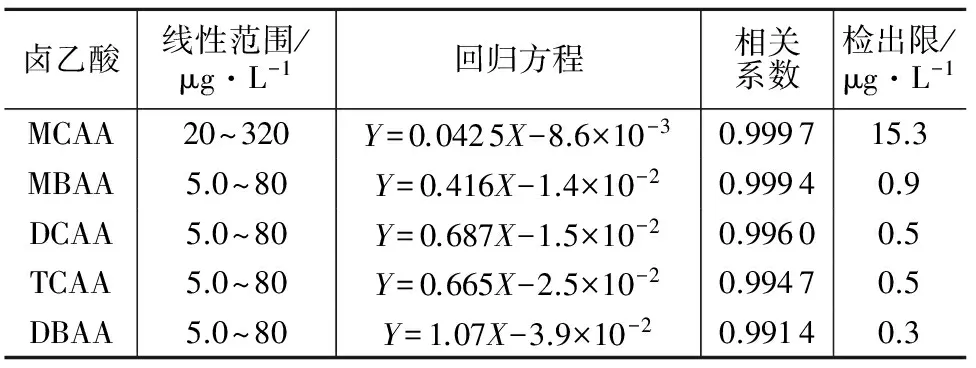
表1 5种卤乙酸线性范围、回归方程、相关系数及检出限
2.4 回收率及精密度试验
在已测得结果的实际样品中分别加入高、低两个浓度的混合标准溶液,每个浓度样品重复测定6次,计算得5种卤乙酸的平均回收率为74.5%~104.0%,RSD为3.1%~11.0%,结果见表2。

表2 5种卤乙酸的精密度及回收率(n=6)
2.5 实际样品测定
采用该法测定了9份自来水、纯净水和矿泉水,结果显示大部分水样含有卤乙酸DCAA、TCAA,浓度远低于《生活饮用水卫生标准》(GB5749-2006)要求的二氯乙酸(DCAA)0.05 mg/L、三氯乙酸(TCAA)0.1 mg/L。这与目前饮用水消毒方法主要是加氯消毒相符合,并且这种消毒副产物是普遍存在的,测定结果见表3。
表3实际水样5种卤乙酸含量μg/L
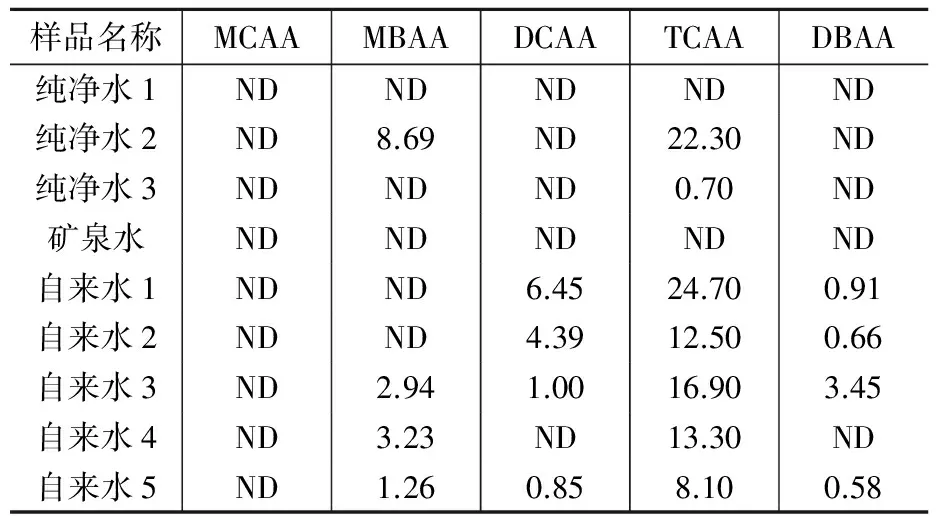
注: ND表示浓度在检出限以下。
3 结语
用液-液萃取衍生气相色谱法测定了饮用水中5种卤乙酸,结果表明:该法具有良好的分离效果,方法灵敏,准确度、精密度满足方法学的要求;且样品处理操作简单,是测定饮用水中卤乙酸可行的检测方法。
[1] 李金燕,贺生云.常规水处理过程中的卤乙酸浓度控制[J].水资源保护,2007,23(3):74-76.
[2] 张晓健,李爽. 消毒副产物总致癌风险的首要指标参数-卤乙酸[J].给水排水,2000,26(8):1-6.
[3] 向红,吕锡武. 饮用水中卤代乙酸测定方法的研究进展[J].理化检验:化学分册,2009,45(5):612-616.
[4] GB/T 5750.10-2006 生活饮用水标准检验方法[S].

