急性高胆红素血症对豚鼠周围听觉系统影响的形态学研究*
梁勇 周昕△
1 南方医科大学南方医院耳鼻咽喉头颈外科(广州 510515);△现在重庆市第一人民医院耳鼻咽喉科
高胆红素血症是重要的致聋病因之一,多数临床研究表明,当血清胆红素浓度达到一定水平时可对听觉系统产生危害,严重时甚至可造成不可逆性破坏。对于高胆红素血症导致听觉系统损害的形态学特点和部位目前存在一定争议,本研究采用新生豚鼠制成急性高胆红素血症模型,以探讨急性高胆红素血症对周围听觉系统损害的形态学特征及其可能的损害部位。
1 材料与方法
1.1 动物模型的制作和鉴定 选择30只生后1周左右健康纯白红目豚鼠(南方医科大学实验动物中心提供),体重80~130 g,雌雄不限,耳廓反射灵敏,外耳和鼓膜无异常,听性脑干反应(ABR)、畸变产物耳声发射(DPOAE)和失匹配负波(mismatch negativity, MMN)均正常。将动物随机分成3组,每组10只:①对照组,腹腔注射2 ml生理盐水;②低剂量组,腹腔注射胆红素100 μg/g;③高剂量组,腹腔注射胆红素200 μg/g,按陈舜年等[1]的方法建立高胆红素血症动物模型。给药后恒温、恒湿、避光环境下自然哺育8 h;取血2 ml,全自动生化分析仪上测定吸光度,计算血清胆红素水平。观察给药前后各组动物行为、躯体运动等方面的症状表现。
1.2 内耳形态学观察 注射8 h后动物用4%多聚甲醛行心脏灌注固定,断头取下耳蜗。左侧耳蜗行硝酸银灌注染色,在解剖显微镜下分离出耳蜗基底膜,制作铺片,光镜下观察内、外毛细胞的损伤情况。将右侧耳蜗依次经过固定、脱钙、脱水、石蜡包埋后,沿蜗轴行连续切片,片厚5 μm,经HE染色后观察内耳各结构以及螺旋神经节及其神经纤维。
1.3 统计学方法 采用单因素方差分析比较各组差异。
2 结果
2.1 动物模型鉴定及行为学观察 30只被测豚鼠中,仅高剂量组1只在实验过程中死亡,其余均能完成所有检测。给药8 h后各组血清胆红素含量依次为14.16±5.30、114.36±14.94、234.14±19.33 mmol/L,差异有统计学意义(F=567.67,P<0.001)。观察发现高剂量组的豚鼠行为明显异常,出现严重运动障碍,本能运动缺乏,翻正反射明显减弱,甚至出现角弓反张和濒死呼吸;低剂量组豚鼠同样有类似的异常表现,但程度稍轻。
2.2 形态学观察结果 光镜下观察基底膜铺片的内、外毛细胞及其他支持细胞均着色良好,各组织形态结构清晰可见,毛细胞排列整齐规律,很少出现听毛倒伏、融合、变性和缺失等形态改变(图1)。耳蜗石蜡切片可见各组耳蜗动物各回的螺旋神经节大小均匀,胞体呈圆或椭圆形、外形规则、胞膜清晰,边界清楚,核大而圆、着色较浅、位于中央,核仁明显、核膜清晰。螺旋神经节细胞间穿行的神经纤维髓鞘致密完整,轴索未见明显异常(图2)。
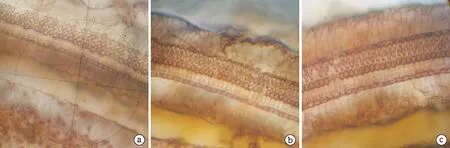
图1 三组豚鼠耳蜗基底膜铺片结果(AgNO3染色,×400) a、b、c分别为对照组、低剂量组、高剂量组

图2 三组豚鼠耳蜗石蜡切片显示螺旋神经节结果(HE染色,×400) a、b、c分别为对照组、低剂量组、高剂量组
3 讨论
Vannucci等[2]研究表明,生后7天左右的大鼠和妊娠32~34周分娩出新生儿的脑组织发育在组织学方面相似,动物这种发育特点与早产儿易患高胆红素血症病变特点相吻合,因此本实验选用生后7天左右豚鼠作为造模动物。高胆红素血症是由于各种原因导致的血清胆红素含量增高,游离胆红素含量与神经机能障碍程度相关。其与神经元突触膜结合后,降低Na+-K+-ATP酶活力,能量代谢水平下降,兴奋性氨基酸持续释放,细胞内Ca2+超载,引起神经元肿胀、核固缩直至凋亡。前期动物实验造模中发现,慢性高胆红素血症动物模型存在种种缺陷,动物死亡率高,无法达到研究所需时间要求,难以排出其他因素对研究结果产生的偏倚等。本研究中使用的急性高胆红素血症动物模型与新生儿高胆红素血症主要发病条件相似,腹腔给予的胆红素通过体液吸收进入血液循环,在给药8 h后血清胆红素含量明显增高,同时病变组豚鼠的神经行为症状出现明显异常,说明动物造模成功。
在前期研究中测试了高胆红素血症实验动物的DPOAE和ABR[3],结果发现随血清胆红素含量增高,各组动物的DPOAE检测通过率均有所降低,各测试频率的DPOAE幅值稍有减小,但差异均无统计学意义。本实验结果中,各组动物耳蜗基底膜铺片可见内、外毛细胞数量及形态无明显改变。前期实验[3]中可见耳蜗功能出现亚临床损害时,反映早期耳蜗功能变化的DPOAE已出现异常改变,但外毛细胞无明显的形态学改变;而在检测ABR时,低剂量胆红素组动物首先出现改变的是波Ⅲ、Ⅴ及Ⅰ-Ⅲ波间期,而波Ⅰ潜伏期与对照组比较无明显差异;随着血清胆红素含量升高,ABR各项指标均出现明显异常,波潜伏期延长,阈值升高。结合听觉电生理学[3]和本研究形态学结果,说明高胆红素对耳蜗功能影响较轻微,主要损伤听觉中枢,尤其是耳蜗核和上橄榄核。
有研究表明,由于促使Na+-K+-ATP酶活力降低是胆红素细胞毒性的作用机制之一,因此胆红素作用部位受到Na+-K+-ATP酶在体内的表达区域及易损程度影响。豚鼠内耳的Na+-K+-ATP酶α异构体主要分布于螺旋神经节、球囊斑感觉上皮,在Corti器和血管纹等其余区域其表达呈弱阳性或阴性[4],因此在周围听觉系统中螺旋神经节较其他部位易受胆红素毒性损害。在体和离体实验研究[5,6]发现,只有足够的胆红素含量和暴露时间才能导致听觉系统不可逆性损害。本实验急性高胆红素血症动物造模8 h后螺旋神经节和听神经等部位暂未出现器质性病变,推测其原因可能是通过血迷路屏障在耳蜗沉积的胆红素含量较少,对外周听觉系统损害较小,随着血清胆红素浓度增高且影响时间延长,上述部位才可逐渐出现明显的病理性改变。因此高胆红素血症对耳蜗的早期轻度损害是可逆的,听觉中枢神经元较周围结构可能更易受外界损害,从而导致听觉中枢部分核团受损。
由于MMN是听觉事件相关电位的一个亚成分,是一系列重复的、性质相同的“标准刺激”中具有任何可辨别差异的“偏差刺激”诱发的脑电反应,主要来源于皮层部分区域,包括颞叶初级听皮层及邻近部位和额叶次级听皮层,因此可以反映听觉辨别功能。本研究前期曾对同样的实验动物进行了MMN测试,结果发现随胆红素含量升高,各组动物MMN振幅有逐渐降低的趋势,但差异无统计学意义[3,7]。通常认为振幅决定于皮层的状态,说明急性高胆红素血症对听皮层的损伤可能较轻微。而高剂量组动物MMN潜伏期延长,检出率减小,说明听觉通路的功能受损,传入听皮层的差异量减小,辨别差异阈值升高,有可能导致皮层水平的频率、强度和时间的辨别能力降低。Cannon等[8]比较了Gunn大鼠各部分脑组织的沉积胆红素含量,发现小脑含量最高、脑干次之、皮层最低,同样证明了高胆红素血症对听觉中枢损伤主要集中在耳蜗核、上橄榄复合体等低位脑干,是听觉中枢受损的主要部位,而对听皮层损伤较轻微。
本研究及前期研究结果表明,急性高胆红素血症对听觉系统的主要损伤部位可能在耳蜗核、上橄榄核等低位脑干,而对外周的耳蜗外毛细胞和螺旋神经节以及听皮层等未引起明显的器质性损害,仅仅出现功能性变化。关于高胆红素血症对听觉损伤的作用机制仍然存有争议,是否对听觉辨别能力产生影响,在听觉信息敏感性、辨别能力、整合处理方面也缺乏相应的研究,对听觉系统的损伤是否存在可逆性,还有待今后进一步研究。
1 陈舜年, 贲晓明, 李佩红, 等. 胆红素脑病动物模型制作与鉴定[J]. 新生儿科杂志, 1997, 12:166.
2 Vannucci R, Connor J, Mauger D, et al. Rat model of perinatal hypoxic- ischemic brain damage[J]. J Neurosci Res,1999,55:158.
3 周昕, 梁勇, 李琦, 等. 高胆红素血症对豚鼠畸变产物耳声发射、听性脑干反应和失匹配负波的影响[J]. 南方医科大学学报, 2009, 29:768.
4 钟时勋, 刘兆华. 豚鼠内耳Na+-K+-ATP酶α亚基异构体的表达[J]. 听力学及言语疾病杂志,2003,11:198.
5 Ozmert E, Erdem G, Topcu M, et al. Long-term follow-up of indirect hyperbilirubinemia in full-term Turkish infants[J]. Acta Paeditr,1996, 85:1 440.
6 Watchko JF. Bilirubin induced apoptosis invitro: Insights for kernicterus[J]. Pediatr Res,2005, 57:177.
7 周昕, 梁勇. 幼年和成年豚鼠失匹配负波反应的特性[J]. 中国耳鼻咽喉头颈外科杂志, 2008,15:674.
8 Cannon C, Daood MJ, O'Day TL, et al. Sex-specific regional brain bilirubin content in hyperbilirubinemic Gunn rat pups[J]. Biol Neonate,2006, 90:40.

