137个遗传性聋小家系的聋病分子流行病学研究
鲍晓林 郭玉芬 刘晓雯 徐百成 郭家亮 孙蔷
1 天津市泰达医院耳鼻咽喉头颈外科(天津 300457); 2 兰州大学第二医院耳鼻咽喉头颈外科
目前普遍认为GJB2基因、线粒体DNA 12SrRNA A1555G和SLC26A4基因是最常见的遗传性致聋因素,本研究对西北地区137个小家系中的耳聋患者进行了这三种基因的突变检测,旨在探索其耳聋的发病机制,为预防和治疗耳聋提供依据,报告如下。
1 资料与方法
1.1 研究对象 中国西北地区有明确遗传家族史的137个核心家系的170例耳聋患者,其中男112例,女58例,年龄6~24岁。其中单一患者家系106个,双患者家系29个,三患者家系2个。
1.2 调查方法
1.2.1 填写问卷调查表 根据王秋菊等[1]提出的遗传性聋资源的收集、保存的方法进行聋病流行病学调查,主要包括患者耳聋的发生年龄、发病方式、耳聋的程度、感染史、发育史、母亲的妊娠及分娩史、有无耳毒性药物用药史、有无耳聋高危新生儿疾病史以及有无其他系统疾病等[1~3]。详细了解家系中有无耳聋及聋哑患者与先证者的关系。
1.2.2 全身及耳鼻咽喉科常规检查[3]在进行全身及耳鼻咽喉科检查时,特别注意全身发育、眼部及甲状腺的检查以初步排除综合征型聋,排除因中耳炎、脑膜炎、病毒性脑炎、腮腺炎及全身感染等因素所致的耳聋。
1.2.3 绘制家系谱图 采集家系成员的亲缘关系背景资料,从先证者出发,追溯家庭成员的亲缘关系,结合病史资料和临床听力学检测,应用Cyrillic软件绘制家系谱图,确定遗传方式。
1.2.4 听力学检测与评估 按照WHO(1997年)听力损失分级标准分级:25~40 dB HL为轻度聋,41~60 dB HL为中度聋,61~80 dB HL为重度聋,>81 dB HL为极重度聋。应用Madsen901(丹麦)声导抗检测仪进行鼓室压力及镫骨肌反射的检测,应用美国智听公司Smart EP 3.X听觉诱发电位仪进行听性脑干反应检测,测定阈值及判断是否存在蜗后病变,在此基础上进行耳聋表型的分类。
1.2.5 血样采集 所有聋哑学生及家系成员签写知情同意书后,抽取静脉血5~10 ml,用酚氯仿法提取白细胞DNA。
1.3 基因扩增 采用王秋菊课题组[4]针对GJB2基因和SLC26A4基因的编码区、线粒体DNA12SrRNA设计的共22对引物序列、反应条件和反应体系。PCR反应体系在ABI公司9700热循环仪完成。PCR反应结束后,取每种PCR产物和标准Marker各2 μl,分别加入6 μl溴酚蓝,用1.1%琼脂糖凝胶进行产物纯度和浓度的检测。
针对线粒体DNA12SrRNA1555位点的扩增产物,经琼脂糖凝胶电泳验证后分别取6 μl,加入Alw26l限制性内切酶0.2 μl,6×Buffer 2 μl,加水至20 μl,在37℃水浴箱中温育消化3小时,经琼脂糖凝胶电泳验证,酶切切开者为300 bp和500 bp两个条带,而不能切开的则为800 bp的一个条带,不能切开的或是酶切显示不清的送测序验证。
按照Coyle等[5]和赵亚丽等[6]设计的20对引物对SLC26A4基因21个外显子进行扩增,用琼脂糖凝胶进行检测。
1.4 PCR产物测序分析 PCR产物经过纯化后直接应用ABI公司3730型DNA分析仪测序。测序引物与PCR扩增引物相同;测序结果应用DNA Star5.0、Bioedit等软件包进行分析,通过ClustalX、BLAST软件进行序列比对、多物种蛋白的进化研究和结构预测。
2 结果
2.1 发病年龄 在170例聋哑学生中,以2岁为分界线,语前聋患者119例,语后聋患者21例,其余30例患者不能明确其发病年龄。
2.2 听力检测结果 170例(340耳)中,重度听力损失46耳,极重度听力损失294耳,均为双侧感音神经性聋。
2.3 遗传方式 137个家系中,常染色体隐性遗传方式102个(74.45%,102/137),母系遗传方式13个,其余22个家系不能明确遗传方式。
2.4 单一患者家系基因检测结果 106个单一患者家系中,GJB2基因检测发现纯合突变5例(235delC 4例、416G>A 1例),1例235delC与299-300delAT复合杂合突变,杂合突变4例(235delC 3例、299-300delAT 1例)。只检测到79G>A 、109G>A、341A>G、368C>A和608T>C等遗传多态改变的有49例,无突变的47例。线粒体DNA12SrRNA1555位点同质型突变的有14例。SLC26A4基因共发现纯合突变6例,基因型为IVS7-2A>G/IVS7-2A>G 5例,1181InsG/1181InsG 1例;复合杂合突变3例,分别为1229C>T/wt与1982A>G/wt杂合突变2例,基因型分别为IVS7-2A>G与2027T>A/wt和2027T>A/wt(典型测序图见图1~3)。
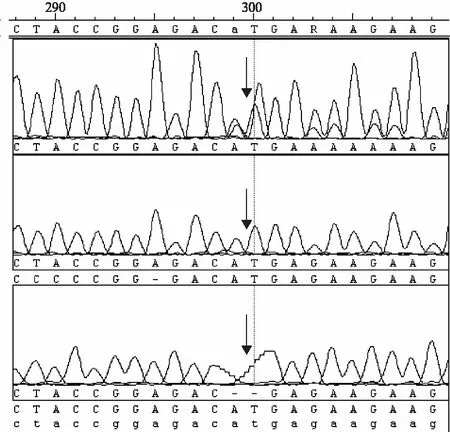
图1 299-300delAT纯合突变(上)、野生型(中)、杂合突变(下)

图2 mtDNA12SrRNA1555异质型突变(上)、同质型(中)、正常测序图(下)
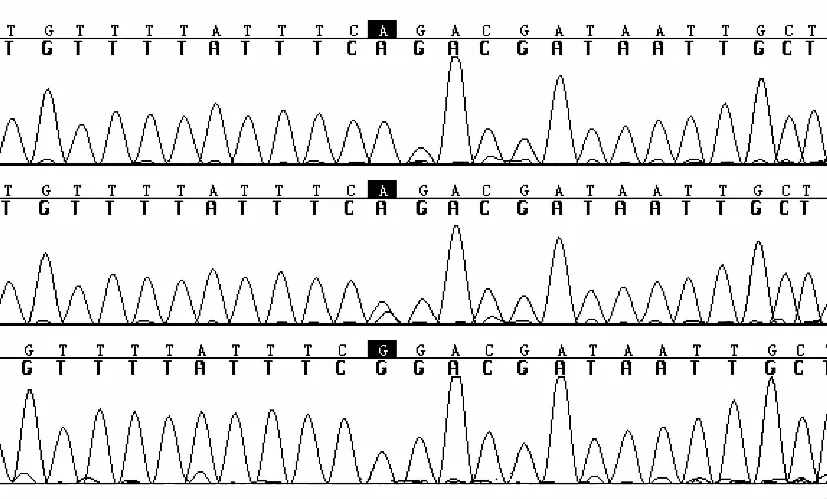
图3 SLC26A4第8内含子剪接点正常(上)、杂合(中)IVS7-2A>G突变纯合(下)
2.5 双患者及三患者家系基因检测结果 31个家系共64个患者中,GJB2基因235delC纯合突变5例、235delC杂合突变5例;299-300delAT纯合突变4例,17例为良性多态改变,33个未检测到突变。线粒体DNA12SrRNA1555位点同质型突变的2例。SLC26A4基因仅检测到5例杂合突变,基因型分别为 IVS7-2A>G/wt 3例,2162C>T/wt(T721M)和2168A>G/wt(H723R)各1例。基因型完全相同的仅有3个,有16个家系三种基因都未检测到突变。
GJB2基因、线粒体DNA12SrRNA 1555位点和SLC26A4基因的突变率分别为14.11%(24/170)、9.41%(16/170)和8.82%(15/170)。
2.6 对单一患者家系和双患者家系GJB2基因、线粒体DNA12SrRNA1555位点和SLC26A4基因三种常见致病基因突变率比较 单一患者家系和双患者家系之间的线粒体DNA12SrRNA和SLC26A4基因突变率的差别有统计学意义(χ2分别为1.689、4.758和10.780,P值分别为0.430、0.029和0.000),证实聋病基因存在遗传聚集和遗传易感的特性。
3 讨论
家系资源能够带来比散发病例更集中的遗传信息,而且很大程度上减少了环境因素、遗传异质性因素的影响。通过对家系的研究,不仅能够进行基因定位、基因诊断,还可以获得更多的有关基因调控等基因功能和基因互作方面的信息,解释发病机制,最终达到疾病预防和基因治疗的目的。
本研究137个小家系中GJB2基因突变发生率最高,占所有致病突变的43.64%(24/55),证实GJB2基因也是西北地区遗传性聋人群中最常见的致病基因。线粒体DNA12SrRNA A1555G和SLC26A4基因突变率分别为29.09%(16/55)和27.27%(15/55)。而线粒体DNA12SrRNA的1555位点的突变占所有突变的29.09%(16/55),是发生纯合突变最多的位点,体现了药物性聋仍然是西北地区最常见的致聋病因,说明当前滥用耳毒性药物的问题依旧非常严重。GJB2基因的235delC纯合突变占16.36%(9/55),与大前庭水管综合征相关的IVS7-2A>G纯合突变占9.09%(5/55),而GJB2基因299-300delAT纯合突变占7.27%(4/55),依次排在第2位到第4位。在31个双患者或三患者的家系中,有9个家系GJB2基因检测到双等位基因突变,4个家系检测到了SLC26A4的杂合突变,2个mtDNA12SrRNA 1555位点的同质型突变,所有家系中基因型完全相同的仅有3个,有16个家系三种基因都未检测到突变。本研究有74.45%的家系明确为隐性遗传,并且为23.53%(40/170)的患者明确了耳聋的分子病因(纯合和复合杂合突变),体现了基因诊断的意义所在。然而还有8.82%(15/170)的患者仅检测到单一位点的基因突变,67.65%(115/170)的患者未检测到任何突变,这些耳聋患者通过现有的研究水平还无法做出分子诊断,需要不断的探索和研究。
耳聋遗传学相关研究的不断深入,是为了探索耳聋的发病机制,实现预防和治疗耳聋的最终目的。通过遗传咨询和婚配指导可以有效的避免两个携带相同致病基因突变的人婚配,从而降低子代遗传性聋的风险,应该是目前最经济、有效而且容易推广的手段[7]。氨基糖苷类药物性聋与线粒体DNA 12SrRNA A1555G 突变密切相关[8~10],避免应用氨基糖苷类药物可以为子孙后代带来福音。SLC26A4基因突变与前庭导水管扩大密切相关,通过避免外伤震荡、预防病毒感染等手段完全可以延缓耳聋的进展。对学语前的婴幼儿可以早期发现聋病危险因素,采取必要的预防措施,从而保证言语语言功能的发育,实现聋而不哑。
1 王秋菊,杨伟炎,韩东一,等.遗传性耳聋资源的收集、保存及利用——综合系统的建立[J].中华耳科学杂志,2003,1:65.
2 Stephens D, Lewis P, Davis A. The epidemiology of hearing problem: How should we investigate it[J].Acta Otolaryngol, 2004, 522(suppl):13.
3 谢鼎华,杨伟炎.耳聋的基础与临床[M].长沙:湖南科学技术出版社,2003.344~355.
4 李庆忠,王秋菊,迟放鲁,等.中国散发听力损失患者中GJB2基因突变分子流行病学研究[J]. 中国眼耳鼻喉科杂志,2006,5:310.
5 Coyle B,Reardon W,Herbrick JA, et al, Molecular analysis of the SLC26A4 gene in Pendred syndrome[J]. Hum Mol Genet, 1998,7:1 105.
6 赵亚丽,李庆忠,翟所强,等. 国人前庭水管扩大患者SLC26A4基因的特异性突变[J]. 听力学及言语疾病杂志, 2006,14:93.
7 刘晓霞,郭玉芬,韩东一,等.非综合征型聋患者线粒体DNAA1555G突变频率分析[J].中华耳鼻咽喉头颈外科杂志,2007,39:739.
8 Li XM,Guan MX.A human mitochondrial GTP binding protein related to tRNA modification may modulate phenotypic expression of the deafness—associated mitochondrial 12S rRNA mutation[J].Molecular and Cellular Biology,2002,22:7 701.
9 赵立东,王秋菊,郭维维,等.与线粒体DNAA1555G突变有关的非综合征型耳聋[J].中华耳科学杂志,2004,2:136.
10 11 赵苏瑛,张海军,徐春宏,等.核基因参与人类线粒体12S rRNA突变相关非综合征耳聋的临床表型[J].分子细胞生物学报,2006,1:39.

