粒细胞集落刺激因子对缺血再灌注损伤猪心肌凋亡和心肌纤维化的影响
梁 滨,周旭晨,黄榕翀,朱 皓,王俊杰,葛均波,邹云增
(1.大连医科大学附属第一医院 心内科,辽宁 大连 116011;2.大连市第三人民医院 心内科,辽宁 大连 116033;3.复旦大学附属中山医院 心内科, 上海 200032)
粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)能够动员骨髓干细胞进入外周血,有助于被动员的干细胞迁移至梗死心肌相关区域[1]。由于G-CSF治疗为非侵入性治疗,因此有可能更广泛应用于心肌梗死及缺血性心脏病的治疗[2-3]。近年来研究发现,粒细胞集落刺激因子(G-CSF)治疗可能通过增加梗死区域新生血管和新生心肌细胞改善心肌梗死后心脏功能,但有关G-CSF对缺血再灌注后局部心肌凋亡和心肌纤维化的影响研究不多,且研究多选择小动物模型[4]。因此,本研究主要观察G-CSF治疗对缺血再灌注损伤猪心肌的影响,从而为临床应用提供更多实验依据。
1 材料和方法
1.1 主要实验试剂与仪器
重组人粒细胞集落刺激因子注射液(rhG-CSF,商品名惠尔血)购自麒麟鲲鹏(中国)生物药业有限公司,Tunel DeadEndTM检测试剂盒购自美国Promega公司,Reverse Transcription System 及Access RT-PCR 试剂盒购自Promega公司,欧乃派克(碘海醇)注射液购自AMERICAN HEALTH公司,铊[201TI]核素注射液购自上海原普同位素科技有限公司,其他试剂均为国产分析纯。PCR反应仪购自德国Eppendorf公司,水平电泳仪购自日本MuPid公司,GE Innova 2000数字平板心血管造影系统购自美国GE公司,PHILIPS-IRIX三探头单光子发射型计算机断层仪购自荷兰PHILIPS公司。
1.2 实验方法
健康实验用小型猪,2~3月龄,体重25~30 kg,雌雄不拘。麻醉状态下,以6F AL1造影导管行左、右冠状动脉造影后,选择合适的球囊于前降支第一对角支分出后主干处封堵,1 h后撤出球囊使血管再通,再次行前降支血管造影,并以6F猪尾导管行左室造影(图1)。将存活的12只猪随机分为对照组和G-CSF治疗组,每组6只。G-CSF治疗组动物接受G-CSF 5 μg/kg·d-1皮下注射,连续7 d,而对照组则给予等量生理盐水皮下注射。术后阿司匹林(150 mg/d)持续口服直至处死。所有猪均于动物模型建立后及治疗第4周记录生命体征,同时行冠状动脉造影、左室造影及201TI-核素单光子放射计算机断层显像(SPECT)检查。由不了解分组的专门技师分析冠状动脉造影数据,计算左室射血分数(LVEF)评价左室功能,并计算左室壁各区域运动不良的节段数目的变化以评价左室局部收缩功能的变化。心肌核素采集图像由核医学研究室两位专门人员应用计算机软件分析。根据提供的软件进行图像重建,采用垂直长轴、短轴及水平长轴3组图像,图像分析时将左心室分成17个节段(基底前壁、基底前侧壁、基底下侧壁、基底下壁、基底下间壁、基底前间壁、心中部前壁、心中部前侧壁、心中部下侧壁、心中部下壁、心中部下间壁、心中部前间壁、心尖部前壁、心尖部下壁、心尖部侧壁、心尖部间隔壁、心尖)(图2、3),测定左心室心肌灌注情况。所有猪于术后4周处死,分离左前降支及其对应供应区域心肌,TUNEL法测定梗死边缘区心肌细胞凋亡情况,Mallory三色法胶原染色测定边缘区心肌纤维化情况,RT-PCR测定Bcl-2和Bax表达情况。
1.3 统计学方法
采用SPSS 13.0专业统计分析软件包建立数据库并进行数据分析,计量资料以均数±标准差表示,自身比较采用配对t检验,组间比较采用t检验;计数资料采用χ2检验。以P<0.05为差异具有显著性意义。
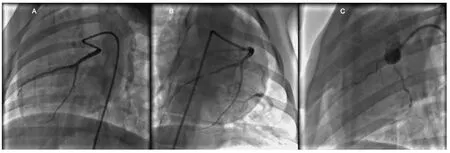
图1 缺血再灌注猪模型制备及G-CSF治疗后冠状动脉造影
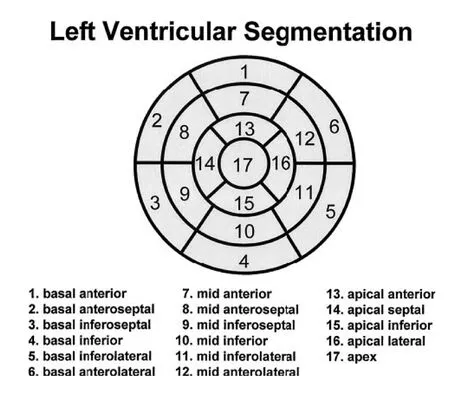
图2 SPECT图像中左心室的17节段分法
Fig 2 Seventeen segments of left ventricular from SPECT data
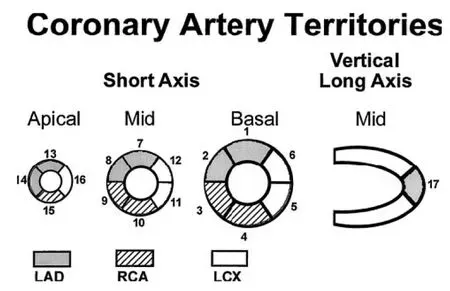
图3 左心室的节段分布与冠状动脉的对应关系
Fig 3 Correspondence between left ventricular regions and coronary artery
2 结 果
2.1 一般资料
心肌缺血再灌注模型建立成功并存活12只,随机分组后,所有实验猪均未见死亡、心肌梗死、感染以及心力衰竭等不良事件发生。
2.2 左室造影评价左室功能
与缺血再灌注动物模型制备后即刻相比,缺血再灌注4周时两组猪LVEF均明显提高(图4,P<0.01),但G-CSF治疗组LVEF改善程度与对照组相比差异有显著性意义(图4,P<0.05)。同时,G-CSF治疗4周后左室各区域运动不良的节段数目明显下降,由29.4±12.7减少至20.8±10.3 (P=0.048),而对照组则未见这种趋势(27.9±14.0 vs 25.5±13.6,P=0.178)。
2.3 SPECT评价G-CSF治疗后缺血再灌注猪心肌灌注情况
缺血再灌注猪模型建立即刻及术后4周时进行SPECT检查发现,两组猪心肌原来分布稀疏区在4周时核素摄取均有所增强,原有的缺损区域部分放射性填充,缺损面积逐渐缩小,但G-CSF治疗后心肌灌注缺损指数降低幅度明显高于对照组(图5,P<0.05)。
2.4 G-CSF动员与心肌细胞凋亡
Tunel染色结果显示,G-CSF治疗组梗死边缘区凋亡心肌细胞数量明显少于对照组(图6)。以DNA ladder Marker为标志,分别在223 bp、327 bp以及597 bp可见扩增条带,电泳条带的位置分别与Bax、Bcl-2及GAPDH的理论值相符。G-CSF治疗组Bcl-2 mRNA表达高于对照组,而Bax mRNA表达则低于对照组(图6)。
2.5 G-CSF动员与心肌纤维化
胶原染色(图7)可见对照组猪4周后梗死边缘区心肌纤维排列紊乱不规则,与正常心肌相比,胶原纤维明显增多,并呈现交错状态,将心肌纤维分割成岛屿状,G-CSF治疗4周后猪梗死边缘区心肌胶原增生较对照组明显减轻。
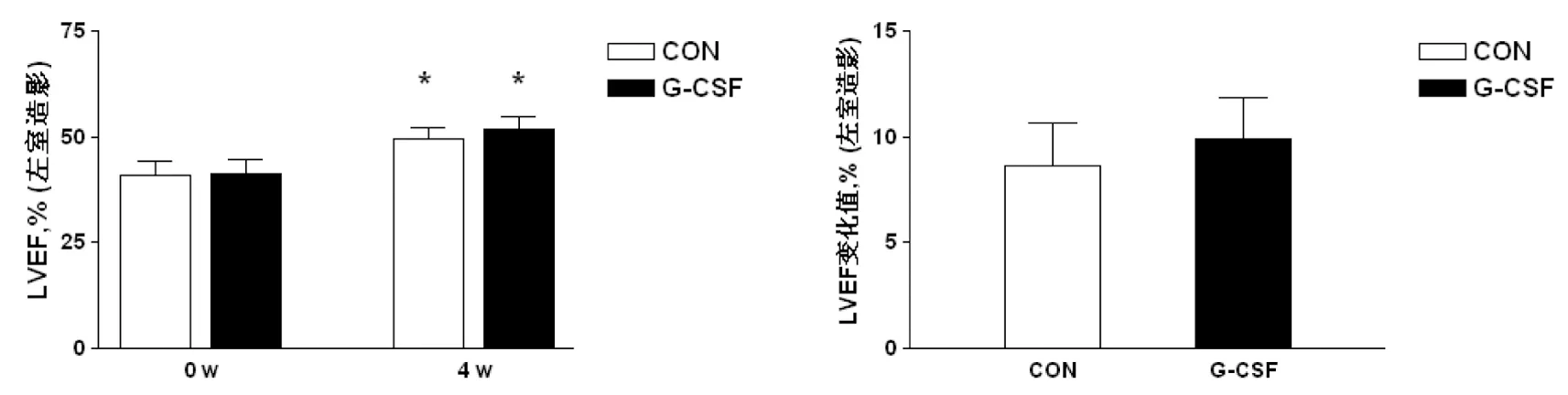
图4 G-CSF治疗后4周LVEF变化
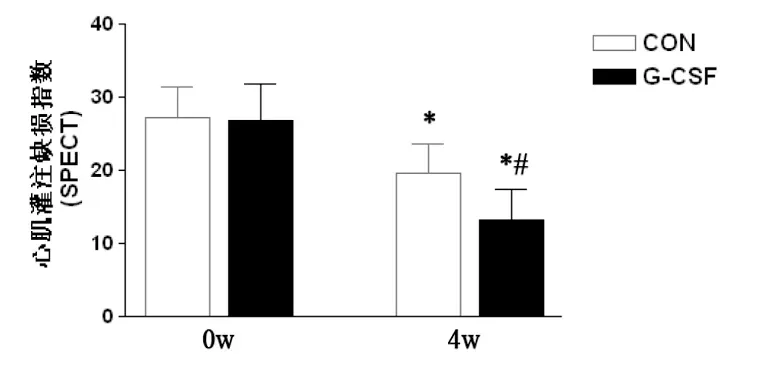
图5 SPECT评价动物模型制备后不同时间心肌灌注缺损面积
CON,对照组;G-CSF,G-CSF治疗。*与0周组比,配对t检验P<0.05;#与对照组比,Studentt检验P<0.05
Fig 5 Myocardial perfusion changes at four-week follow-up after G-CSF treatment by SPECT
3 讨 论
本研究证实,皮下注射G-CSF可以改善心肌缺血再灌注后左室局部收缩功能和心肌灌注。这种改善可能与减少心肌凋亡和改善心肌纤维化作用有关。
尽管随着药物治疗和介入技术的不断提高,急性心肌梗死(AMI)救治成功率不断提高,但是心肌梗死后远期心力衰竭依然是无法解决的问题。即便AMI后靶血管迅速开通(<6 h)有助于减少梗死心肌面积,然而病理研究证实心肌梗死后20 min,心肌细胞即出现缺血、坏死,乃至疤痕形成,而靶血管开通后缺血再灌注使得心肌细胞缺血损伤进一步加重,从而引发一系列病理生理反应,导致心力衰竭发生。而目前尚缺乏有效的预防和治疗缺血再灌注损伤的方法。因此,寻找新的治疗手段成为该领域的热点话题。近年来,包括作者在内的许多研究小组证实干细胞移植可以明显改善心肌梗死后心脏功能,减少梗死面积,增加局部心肌灌注,同时改善临床症状[5,6]。

图6 G-CSF治疗对心肌凋亡的影响
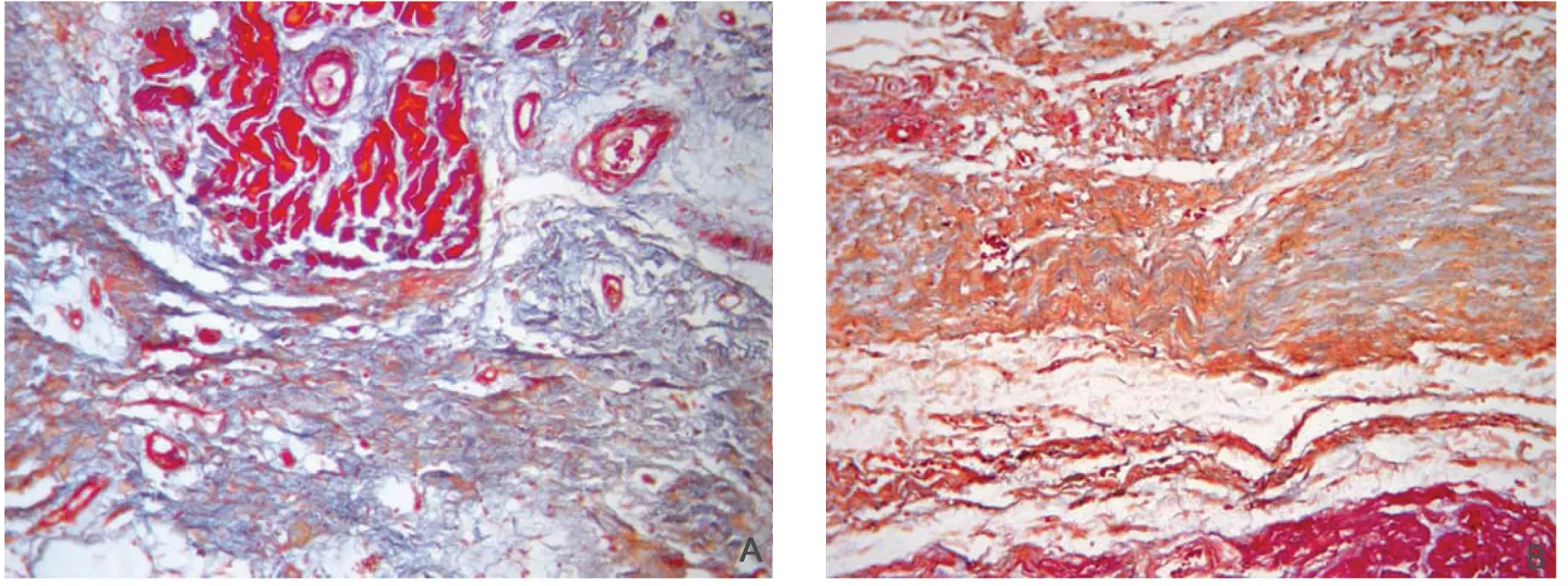
图7 治疗4周后胶原染色 (×200)A为对照组,B为G-CSF治疗组Fig 7 Collagen staining after G-CSF treatment
而粒细胞集落刺激因子(G-CSF)作为骨髓造血干细胞(hematopoietic stem cell,HSC)强有力的动员剂,具有同时动员骨髓造血干细胞、间质干细胞及内皮干细胞释放进入外周血的能力。之前研究也发现,G-CSF可以治疗慢性缺血性心脏病,可能与G-CSF抗心肌凋亡和促进局部再血管化有关[7]。但是,有关G-CSF治疗缺血再灌注损伤的研究不多,且多为小动物实验,因此本研究中作者利用球囊低压力扩张封堵前降支后再开通的方法,成功建立缺血再灌注猪模型后,给予G-CSF连续7 d皮下注射或者生理盐水注射,4周后通过左室造影和SPECT方法评价左室整体和局部收缩功能。有研究显示,AMI后“自发”G-CSF轻度升高有助于干细胞“归巢”,可能与心肌修复有关,但正常状态下这种修复功能很弱。在本研究中作者也发现,对照组猪心脏功能与模型制备时相比也有一定程度的改善。尽管与对照组相比,G-CSF似乎不能进一步改善整体LVEF,但可以改善左室局部收缩功能并增加局部血流灌注,从而改善心脏功能。RT-PCR测定凋亡相关因子Bcl-2/Bax mRNA表达结果显示,与TUNEL结果一致,G-CSF治疗后损伤心肌边缘区域心肌凋亡明显减少。而且,胶原染色结果也提示G-CSF可以明显改善心肌纤维化程度。因此认为,G-CSF可能通过减少心肌细胞凋亡和改善心肌纤维化改善缺血再灌注动物心脏功能,这也为降低AMI远期心力衰竭发生率提供了一种新的治疗手段。当然,本研究动物数目不多,相关结论还需要在更大规模动物实验中进一步研究证实。
[1] Orlic D,Kajstura J,Chimenti S,et al.Mobilized bone marrow cells repair the infarct heart,improving function and survival[J].PNAS,2001,98:10344-10349.
[2] George JC.Stem cell therapy in acute myocardial infarction:a review of clinical trials[J].Transl Res,2010,155(1):1-9.
[3] Abdel-Latif A,Bolli R,Zuba-Surma EK,et al.Granulocyte colony-stimulating factor therapy for cardiac repair after acute myocardial infarction:a systematic review and meta-analysis of randomized controlled trials[J].Am Heart J,2008,156(2):216-226.
[4] Higuchi T,Yamauchi-Takihara K,Matsumiya,et al.Granulocyte colony-stimulating factor prevents reperfusion injury after heart preservation [J].Ann Thorac Surg.2008,85(4):1367-1373.
[5] Yao K,Huang RC,Ge JB,et al.Effect of intracoronary bone marrow mononuclear cell administration on chronic myocardial infarction[J].Heart,2008,94(9):1147-1153.
[6] 张飞龙,陈良龙,李淑梅,等.Janus激酶-信号转导子与转录激活子通路介导粒细胞集落刺激因子影响冠状动脉微栓塞后心肌细胞凋亡的实验研究[J].中华心血管病杂志,2008,36(3):254-259.
[7] 黄榕翀,姚康,陆浩,等.经冠脉内G-CSF注射治疗慢性缺血性心脏病的实验研究[J].中华心血管病杂志,2009,37(8):685-691.

