RP-HPLC法分离测定发酵液中的交沙霉素
胡 平,宋速快,林开春
(1.恩施职业技术学院 生物工程系,湖北 恩施 445000;2.华中农业大学 植物科学与技术学院,湖北 武汉 430070;3.湖北省农产品质量安全检查中心,湖北 武汉 430070)
交沙霉素是由那波链霉菌交沙霉素变种(Streptomycesnarbonensisvar.Josamyceticus)发酵产生的大环内酯类抗生素,它的抗菌谱与红霉素相似,对G+菌及某些G-菌包括淋球菌、金黄色葡萄球菌、脑膜炎双球菌、支原体等有效.日本抗生物质医药品基准及卫生部标准中收载的含量测定方法为微生物检定法.近几年,国内出现利用分光光度法测定交沙霉素含量的报道[1~3].也有采用高效液相色谱(High Performance Liquid Chromatography,HPLC)法[4~7]、液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)及液相色谱-电喷雾离子质谱联用技术(liquid chromatography-electrospray ionization-mass spectrometry,LC-ESI-MS)检测药片中或血糖中交沙霉素含量的报道[8],方法准确、灵敏、简便,但未曾有对发酵液中交沙霉素含量测定的研究.本文经试验建立了RP-HPLC测定发酵液中交沙霉素含量的方法,该方法色谱系统简单,能将交沙霉素与发酵液中的杂质组分实现很好分离.
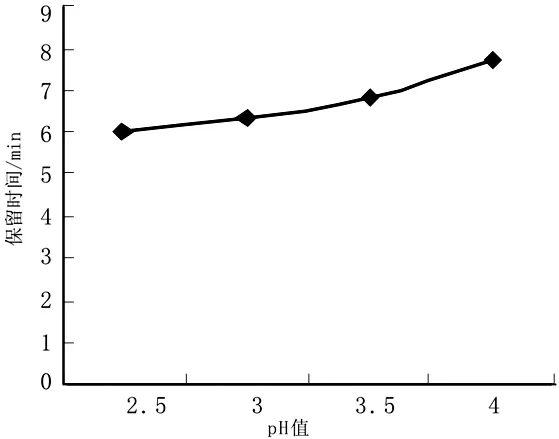
图1 流动相pH与保留值的关系
表1方法的精密度测定结果(n=6)
Tab.1 The result of the accuracy of analytical measure(n=6)
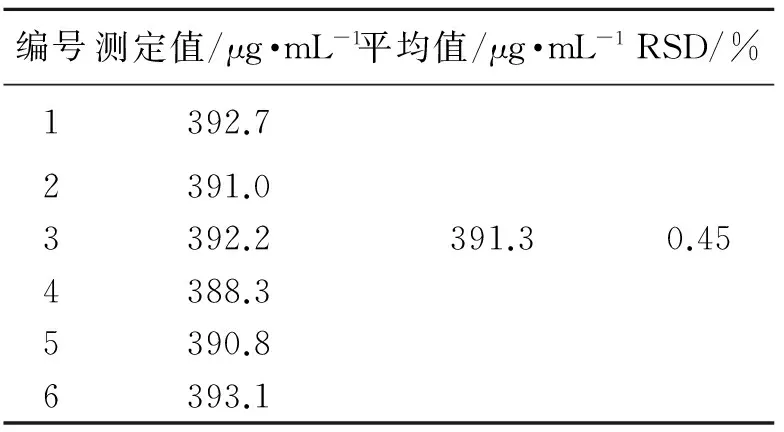
编号测定值/μg·mL-1平均值/μg·mL-1RSD/%1392.72391.03392.2391.30.454388.35390.86393.1
1 材料与色谱条件
1.1 材料
1.1.1 供试菌株:交沙霉素产生菌那波链霉菌交沙霉素变种(Streptomycesnarbonensisvar.Josamyceticus),由武汉天惠生物工程有限公司研究所保藏并提供.
1.1.2 实验仪器:美国Waters高效液相色谱仪.
1.1.3 培养基与试剂 交沙霉素对照品由武汉天惠生物工程有限公司提供.斜面培养基:土豆泥,10%;麦片,2.5%;精氨酸,0.02%;琼脂 2.0%;消前pH7.2~7.4.种子培养基:葡萄糖,1.0%;淀粉,1.0%;黄豆饼粉,1.5%;硫酸镁,0.05%;酵母粉,0.5%;碳酸钙,0.3%;磷酸氢二钾,0.5%;消前pH8.0.发酵培养基:葡萄糖,2.0%;棉籽饼粉,2.0%;豆油,1.0%;碳酸钙,0.3%;玉米淀粉,4.0%;磷酸二氢钾,0.03%;面筋粉,2.0%;硫酸镁,0.05%;消前pH 8.0.
1.2 色谱条件
色谱柱:C18反向柱4.6 mm×250 mm ;填料:Hypersil ODS2 5 μm;流动相:甲醇-0.02mol/L KH2PO4溶液,用磷酸调节pH值;柱温:室温;进样量:10 μL;检测波长:232 nm;流速:1 mL/min.
2 方法与结果
2.1 色谱条件的优化
2.1.1 流动相的优化 按参考文献[9]以甲醇与0.02 mol/L KH2PO4溶液二元系统作流动相,探索其中甲醇比例分别为60%,70%,80%,90%时对各成分保留时间及分离程度的影响.试验发现随着流动相中甲醇比例的增加,峰形逐渐改善,峰的保留时间也逐渐变短,但综合较短的保留时间和与其他的杂质峰分离度,以甲醇比例为80%为最佳.在甲醇-0.02 mol/L KH2PO4溶液(80∶20)条件下,以1 mol/L磷酸溶液调节pH值,以选择分离效果较佳保留时间t适中的缓冲液pH值,结果见图1.由图1可以看出,流动相缓冲液的pH越小,保留时间相应变小,考虑到缓冲液pH对色谱柱的损害,缓冲液的pH设置为3.
2.1.2 缓冲液浓度对色谱行为的影响 KH2PO4溶液浓度设置0.005,0.01,0.015,0.02 mol/L四个浓度,根据分离效果选择合适的KH2PO4溶液浓度.缓冲液浓度对色谱行为影响相对较小,浓度变小时,保留时间也相应变长,浓度过大又对影响色谱柱的使用寿命,所以综合考虑缓冲液浓度0.02 mol/L,用1 mol/L的磷酸调节pH值为3.
2.2 标准工作曲线、线性范围
准确称取交沙霉素标样0.01 g,用适量甲醇溶解,超声波处理,置于容量瓶中用甲醇定容至10 mL,并用流动相将其配置成31.25,62.5,125,250,400,500,800 μg/mL的标样,在设定的色谱条件下进行定量分析,以浓度为横坐标,以峰面积为纵坐标作标准曲线,得到分析方法的回归方程为y=49267x+804795,相关系数r=0.996 6,结果表明,交沙霉素浓度在31.25~800 μg/mL之间用HPLC检测具有很好的线性关系.
2.3 精密度试验
同一样品在相同色谱条件下进行6次平行测定,结果见表1.试验测得其峰面积的RSD为0.45%,说明方法的精密度良好.
2.4 稳定性试验
取同一样品,按上述方法配成样品溶液进行含量测定.将样品溶液分别在室温下放置0,4,8,16,24,48 h后进样测定,其峰面积的RSD为0.64%,表明该样品溶液在48 h内稳定性良好.

表2 交沙霉素加样回收试验结果(n=6)

图2 交沙霉素对照品的HPLC检测图谱

图3 供试发酵液的HPLC检测图谱
2.5 回收率试验
精密称取已知含量的同一批样品适量,加入标准品适量,用流动相溶解并制成每1 mL中约含1 mg的溶液,依上述方法测定,用标准曲线计算含量,并计算回收率,结果见表2.测得回收率在97.88%~100.07%之间,平均回收率在99.18%,RSD为0.79%,说明方法的准确度良好.
2.6 样品的测定
将供试菌株在斜面培养基上活化,于28℃培养7~10 d,得到新鲜的斜面孢子.将斜面孢子接入种子培养基,于28℃ 180 r/min摇床培养30 h.以10%接种量转入发酵培养基中,于28℃ 180 r/min摇床培养8 d后放瓶.移取交沙霉素发酵液5 mL加入4倍体积的甲醇,浸提24 h即得到具有生物活性的交沙霉素浸提液.在设定的色谱条件下,待仪器基线稳定后,连续注入数针标样溶液,计算各针峰面积的重复性,待相邻两针的峰面积变化<1.0%时,按照标样溶液、试样溶液、标样溶液的顺序进样测定.标样和供试发酵液的图谱见图2、3.
3 讨论
在优化HPLC法检测交沙霉素的色谱条件时,通过调整流动相的比例、流动相的pH、缓冲液浓度大小的变化,确定了适宜的色谱条件[色谱柱为C18反向柱(填料Hypersil ODS 25 μm,4.6 mm×250 mm);柱温为室温;流动相为磷酸缓冲液(0.02 mol/L磷酸二氢钾溶液,用1 mol/L的磷酸调节pH值为3)-甲醇(体积比为20∶80,pH3);流速为1.0 mL/min;紫外检测波长为232 nm;进样量为10 μL],能很好地改善峰形,保留时间可控制在6~7 min.有研究报道[10]使用乙腈和缓冲液作为流动相,但是考虑到乙腈的毒性,本试验中暂未使用.
在研究中,交沙霉素浓度在31.25~800 μg/mL范围内,其峰面积与浓度呈良好的线性关系(r=0.996 6),测得样品的相对标准偏差为0.45% ,方法回收率的相对标准偏差为0.49%,本法可用于交沙霉素定量测定.发酵液中的杂质成分对交沙霉素出峰的干扰较大,但供试发酵液样品的色谱图显示,本方法能使发酵液中交沙霉素主成分与其他杂质组分实现良好分离,能准确地测定交沙霉素的含量.
[1]江虹,何树华,湛海粼.交沙霉素-茜素的显色反应及其应用[J].化学试剂,2006,28(2):741-743.
[2]李华侃,肖井坤.交沙霉素与红紫素的荷移反应及其测定[J].光谱实验室,2006,23(6):1 303-1 306.
[3]江虹,何树华,张淑琼.交沙霉素的光度分析研究[J].分析科学学报,2007,23(1):76-78.
[4]Roets E, Lepoudre X, Rompaey V V, et al. Liquid chromatography of josamycin propionate on poly(styrene-divinylbenzene)[J].Journal of Chromatography A,1998,812:303-308.
[5]Min H, Chang Q H. Identification of the components of 16-membered macrolide antibiotics by LC/MS[J].Analytica Chimica Acta,2005,535(2):89-99.
[6]吴伟洁,汪虹,沈熊,等.高效液相色谱法测定交沙霉素血药浓度[J].中国临床药学杂志,2000,9(5):294-295.
[7]黄晓兰,许玫英.高效液相色谱法同时测定制药废水中的交沙霉素、茶碱及扑热息痛[J].色谱,2005,23(3):196-298.
[8]裴琳,王亮,丛江.HPLC法测定交沙霉素的含量及与微生物检定法的比较[J].中国药事,2005,8(8):643-644.
[9]农以宁.交沙霉素HPLC分离测定方法的研究[J].药物分析杂志,1993,13(6):386-389.
[10]李玉杰,徐晓洁,巩丽萍.反相高效液相色谱法测定交沙霉素片的含量[J].中国药业,2007,16(14):34-35.

