裸燕麦球蛋白提取条件及其功能特性研究*
蔺瑞,张美莉,刘全旺
1(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特,010018)2(内蒙古伊利实业集团股份有限公司,内蒙古呼和浩特,010080)
内蒙古是我国历年种植燕麦面积最大的省份,约占全国种植面积的35%以上[1]。在这一地区发展燕麦生产具有得天独厚的绿色生态条件。
燕麦具有抗血脂成分、高水溶性胶体、营养平衡的蛋白质等,它对提高人类健康水平有着非常重要的价值。因而被营养学家誉为“全价营养食品”[2]。
国内外大量研究表明,燕麦籽粒中的粗蛋白高达12% ~18%,居其他禾谷类作物之首。燕麦中蛋白质是任何谷物中氨基酸最平衡的谷物之一,这些蛋白质中含有18种氨基酸,其中8种是人体必需氨基酸,且配比合理、人体利用率高,其蛋白质营养价值可与鸡蛋媲美[3~5]。近些年来,西方国家由于过量食用动物蛋白,从而导致肥胖症、肝损伤、血糖、血脂异常等“富贵病”,于是,将目光转向大豆、燕麦等高营养植物蛋白。对于缺乏动物蛋白的第三世界国家和贫困地区,燕麦食品无疑是一种很好的植物蛋白来源[6]。
本试验采用Osborne分级法提取裸燕麦球蛋白,寻找最佳提取工艺条件提高蛋白提取率,并对裸燕麦球蛋白的溶解性、乳化性、起泡性、黏度等功能特性进行研究,为裸燕麦蛋白的开发利用提供理论依据。
1 材料与方法
1.1 材料及主要仪器
材料:裸燕麦,取自内蒙古武川县,贮藏于0~4℃;大豆色拉油,市售。
药品试剂:牛血清白蛋白(BSA)、VC(Sigma化学药品公司);考马斯亮蓝G-250、十二烷基硫酸钠(SDS)、邻二氮菲、硫酸亚铁、双氧水等为分析纯(AR)。
主要仪器:K9850全自动凯氏定氮仪(济南海能仪器有限公司),紫外可见分光光度计(北京普析通用仪器有限责任公司),H2500R-2高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),RE-52AA旋转蒸发器(上海亚荣生化仪器厂),FD-2冷冻干燥机(北京博医康实验仪器公司)。
1.2 实验方法
1.2 .1 Osborne法提取裸燕麦球蛋白
裸燕麦去壳、脱毛、磨粉,并在低温下用乙醚或石油醚浸泡80目裸燕麦粉去除脂肪,得到裸燕麦脱脂粉,于4℃下保存备用。采用Osborne[7]方法分级提取裸燕麦球蛋白、谷蛋白、醇溶蛋白,测定各贮藏蛋白的含量,并对提取球蛋白工艺条件进行优化。
1.2 .2 温度对裸燕麦球蛋白提取率的影响
分别在0~4℃,25~29℃,40~45℃下提取裸燕麦球蛋白,测定蛋白提取率及清除羟自由基能力[8]。
1.2 .3 单因素提取条件对球蛋白提取率的影响
1.2 .3.1 NaCl质量分数的影响
5 g脱脂裸燕麦粉在料液比1∶15(g∶mL)、提取时间40 min、NaCl质量分数分别为5%、8%、10%、15%NaCl的条件下,提取上清液,测定其蛋白浓度。
1.2 .3.2 料液比的影响
设计料液比分别为 1∶5、1∶8、1∶10、1∶12、1∶15、1∶20、1∶25,10%NaCl提取 40 min,测定其蛋白浓度。1.2.3.3 提取时间的影响
设计提取时间分别为 15、20、25、30、35、40、45、50 min,料液比 1∶15,10%NaCl,测定其蛋白浓度。
1.2 .3.4 提取次数的影响
在料液比1∶15、提取时间40 min、NaCl 10%的条件下,提取上清液,如此重复溶解、离心、收集上清液共7次。合并上清液并测定其蛋白浓度。
1.2 .4 正交试验设计优化球蛋白提取条件
在单因素试验的基础上,选取NaCl质量分数、料液比、提取时间为因素,设计正交试验(表1),以裸燕麦球蛋白提取率为指标进行考察。

表1 球蛋白提取因素与水平表
1.2 .5 裸燕麦球蛋白的溶解性测定[10]
依据对氮溶解指数(NSI)所述方法加以改进,将4份15 mL 1%裸燕麦球蛋白溶液,用0.5 mol/L HCl或0.5 mol/L NaOH溶液分别调 pH值至3.0、5.0、7.0、9.0,磁力搅拌 45 min 后,10 000 g 离心 15 min,采用考马斯亮蓝法测定上清液中的蛋白质含量,并绘制出NSI-pH曲线。

1.2 .6 裸燕麦球蛋白的乳化活性测定[11]
对Pearce K N所述方法加以改进,将12 mL 1%裸燕麦球蛋白溶液用0.1mol/L HCl或0.1mol/L NaOH分别调 pH 值 至3.0、5.0、7.0、9.0后,加入4 mL脱酸大豆色拉油,磁力搅拌1 min后,立即于容器底部取样50 μL,用0.1%SDS溶液稀释适当倍数,混匀后500 nm处测定吸光值,以SDS溶液作为空白。室温放置30 min后再次取样测定。计算并作图。
乳化活性(EAI)按下式计算:

乳化稳定性(ESI)按下式计算:

式中:c为样品浓度(g/mL);Φ为乳化液中油相的比例(0.25);L为比色杯光径(1 cm);N为稀释倍数;A0为0时的吸光度;A1为30 min后的吸光度;t时间间隔(30 min)。
1.2 .7 裸燕麦球蛋白的黏度测定
在35℃、pH值7.0条件下将裸燕麦球蛋白溶液分别配成 15、25、50、100、200 g/L 溶液,用黏度计测其表观黏度。
1.2 .8 裸燕麦球蛋白的起泡性测定[12]
分别称取 4份 20 mL,20 g/L样品溶液,用0.5mol/L HCl或0.5mol/L NaOH溶液分别调pH值至3.0、5.0、7.0、9.0,然后以 9 500 r/min 高速搅打 3 min,测量搅打停止时的液体总体积V0和搅打30 min和60 min后的液体总体积V1。

2 结果与分析
2.1 裸燕麦蛋白的组成分布
通过索氏抽提法测得裸燕麦中脂肪所占比例为19.8%。裸燕麦脱脂粉中总蛋白利用凯氏定氮法测得约占13%,各贮藏蛋白成分的分布情况如图1所示。裸燕麦蛋白质中的球蛋白为主要蛋白质,占裸燕麦总蛋白的55%,占脱脂粉的7.15%。其次是谷蛋白,占总蛋白的30%。醇溶蛋白占11%,其他蛋白占4%。这与胡新中[13]报道的燕麦蛋白组成相一致。
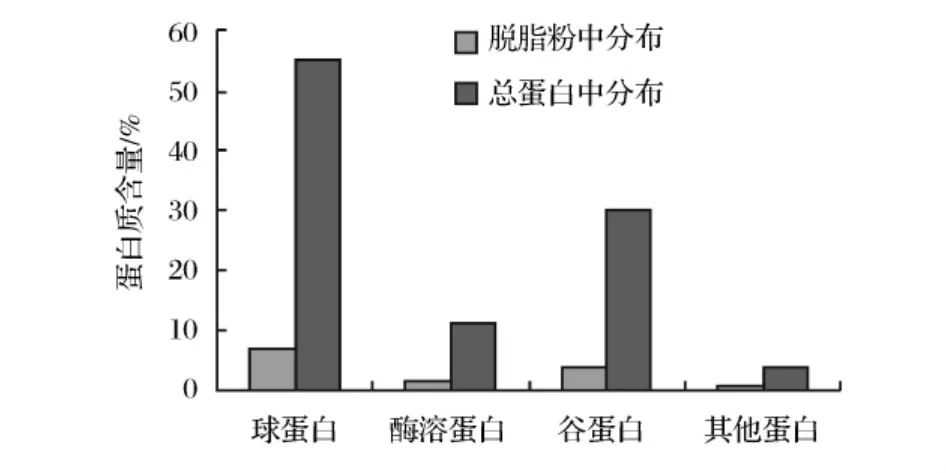
图1 蛋白质组分在裸燕麦蛋白中的分布
2.2 温度对裸燕麦球蛋白提取率的影响
为了确定适宜的提取温度,以蛋白提取率和清除羟自由基能力为考察指标进行试验。由表2可知,提取温度在40~45℃时球蛋白提取率最高为41.9%,而羟自由基清除率为28.5%。提取温度在0~4℃时球蛋白提取率为27.5%,而羟自由基清除率最高为47.1%,所以本试验选择提取温度为0~4℃。

表2 温度对球蛋白提取率及羟自由基清除率的影响
2.3 单因素提取条件对裸燕麦球蛋白提取率的影响
2.3.1 NaCl质量分数对球蛋白提取率的影响
球蛋白不溶于水和高浓度的盐溶液,但溶于稀盐溶液,故称为盐溶蛋白[14]。由图2可知,随着NaCl质量分数的增加,提取率有所上升,但当NaCl质量分数增加到10%时提取率达到最大值,而后稍有下降。故最适NaCl质量分数为10%。

图2 NaCl质量分数对球蛋白提取率的影响
2.3.2 料液比对裸燕麦球蛋白提取率的影响
由图3可知,随着料液比的增加,球蛋白提取率呈不规律波动。当料液比1∶12(g∶mL)时,球蛋白提取率达最高,为30.2%。如果料液比过小,提取体系的黏度过大,不利于蛋白质的溶出,使提取不完全;但增大料液比到一定比例后,蛋白溶出量达最大,而后趋于平缓或下滑。故最适料液比为1∶12。

图3 料液比对球蛋白提取率的影响
2.3.3 提取时间对裸燕麦球蛋白提取率的影响
由图4可知,随着提取时间的增加,球蛋白提取率不断上升,当提取时间为35 min时,球蛋白提取率最高,为32.0%,随后趋于平缓。提取时间不宜过长,否则蛋白质易变性或易受微生物污染。故最适提取时间为35 min。
2.3.4 提取次数对裸燕麦球蛋白提取率的影响
由图5可知,随着提取次数的增加,球蛋白提取率不断上升,当提取次数为5次时,球蛋白的提取率最高为72.5%,随后趋于平缓,表明残渣中球蛋白已基本提取完全。故最适提取次数为5次。

图4 提取时间对球蛋白提取率的影响

图5 提取次数对球蛋白提取率的影响
2.4 正交试验设计优化球蛋白提取条件
从表3中的提取率可以看出,A2B1C2的提取率最高为90.4%,通过极差R值的比较得出,影响本试验结果因素的主次顺序为NaCl质量分数>提取时间>料液比,表明NaCl质量分数是提取球蛋白的关键影响因素。通过比较k1、k2、k3,得最优试验方案为A2B1C3,考虑到试验效率,确定最佳提取条件为A2B1C2,即 NaCl质量分数10%,料液比1∶10,提取时间35 min。对最佳试验方案A2B1C2进行多次重复试验验证,结果表明该提取条件稳定,重现性好,提取率达到90%以上。
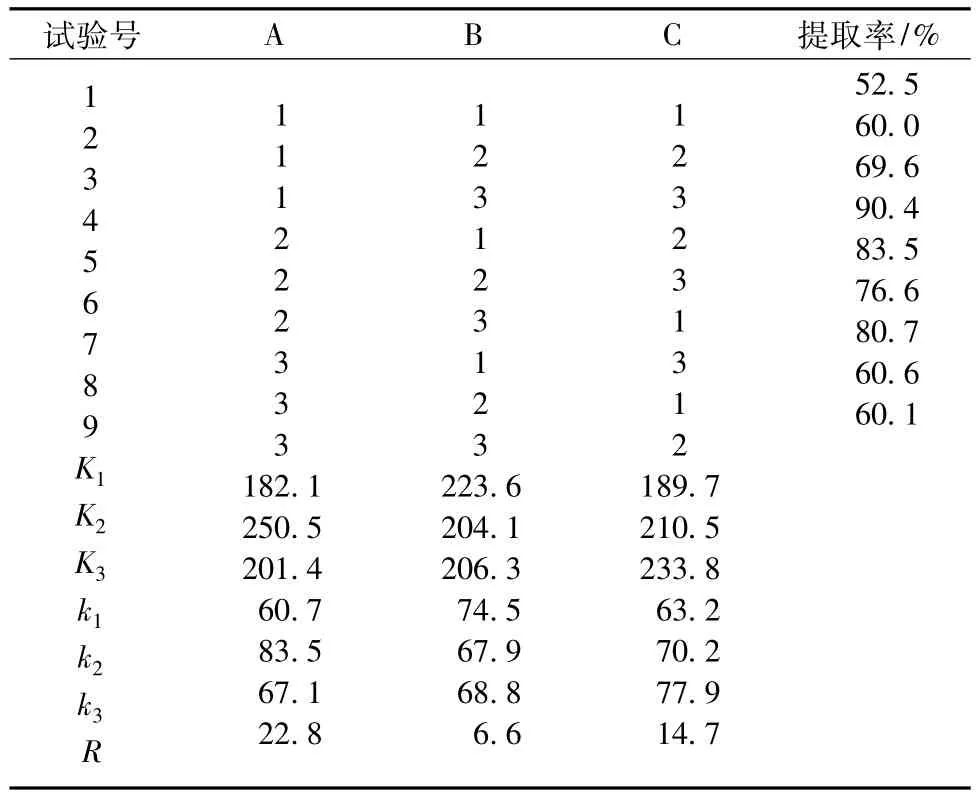
表3 球蛋白提取正交试验结果
2.5 裸燕麦球蛋白的溶解性
试验显示pH值对裸燕麦球蛋白溶解性有一定的影响(图6)。pH值在3.0~5.0时球蛋白溶解性是逐渐下降的,之后随着溶液pH值的增加,球蛋白的溶解性逐渐上升。pH值为5.0时的球蛋白溶解度最小为53.2%,而在碱性和酸性条件下,球蛋白获得了净正电荷和负电荷,增强了分子间的排斥力,分子分散性好,因此溶解度高[15]。这与荞麦球蛋白溶解度在pH值7~10时可达90%以上[16]和豇豆7S球蛋白的溶解性在pH<4.2和pH>6.8时可达90%以上的研究结果相似[17]。若把裸燕麦球蛋白添加到如焙烤制品和肉糜制品,既可强化营养,又能充分利用其溶解性,从而改善食品的内在品质和感官性能。

图6 裸燕麦球蛋白在不同pH下的溶解度曲线
2.6 裸燕麦球蛋白的乳化性
蛋白质乳化性是指蛋白质能使油与水形成稳定的乳化液而起乳化剂的作用,主要包括乳化能力和乳化稳定性[18]。由图7可知,当pH值在3.0~7.0时球蛋白乳化性及乳化稳定性是逐渐下降的,之后随着溶液pH值的增加而升高。pH值7.0时球蛋白乳化性及乳化稳定性最小,为18.1 m2/g和13.0 m2/g,而在碱性条件下乳化性及乳化稳定性最高为53.6 m2/g和20.2 m2/g,表明球蛋白易于展开和定向排列,降低水和油的表面张力,形成稳定的界面膜结构,故可作食品工业中良好的乳化剂。
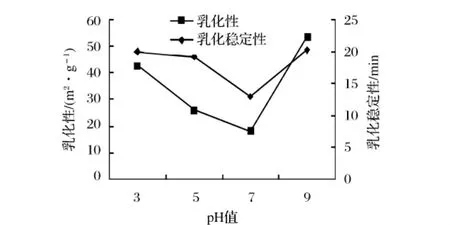
图7 裸燕麦球蛋白在不同PH下的乳化性曲线
2.7 裸燕麦球蛋白的黏度
黏度在调整食品的物性方面是很重要的。由图8可知,球蛋白浓度在1.5% ~5%时,黏度变化较为平缓,但当浓度高于10%时,黏度上升较快。球蛋白溶液黏度变化较小,具有在高浓度时低黏度的特性,特别适合应用在需要高蛋白质含量而又有较好流动性的食品中,既可以作为食品中氮源的良好补充,又不会影响食品的流体性质,有利于工业化操作。

图8 不同浓度裸燕麦球蛋白的粘度曲线
2.8 裸燕麦球蛋白的起泡性
由图9可知,球蛋白起泡性随着pH值的增加,呈现先减小后增大的趋势,并在pH值5.0时起泡性最低,而在碱性条件下,球蛋白起泡性增大。试验显示裸燕麦球蛋白具有较好的起泡能力,且气泡稳定性较好,有利于蛋白质分子更快速的吸附至气-液界面。

图9 裸燕麦球蛋白在不同PH下的起泡性
3 结论
(1)试验结果表明,裸燕麦中总蛋白约占13%,其中球蛋白占总蛋白的55%,为主要蛋白;其次为谷蛋白占30%;醇溶蛋白占11%,其他蛋白占4%。
(2)本试验选择提取蛋白活性最高的温度为0~4℃。在此温度下,提取裸燕麦球蛋白的最佳条件为NaCl质量分数 10%,料液比 1∶10(g∶mL),提取时间35 min,提取次数为5次,提取率可达90%以上。
(3)裸燕麦球蛋白pH值为5.0时的溶解度最小为53.2%,而在碱性和酸性条件下,溶解度较高。碱性条件下球蛋白乳化性可达53.6 m2/g。随着球蛋白浓度的增加,黏度也随之增加。碱性条件下,球蛋白起泡性可达86.9%,30 min和60 min气泡稳定性也较好。利用裸燕麦球蛋白功能特性改善食品的内在品质和感官性能极具潜力。
[1] 林汝法,柴岩,廖琴,等.中国小杂粮[M].北京:中国农业科技出版社,2002:126.
[2] 马德泉,田长叶,杨海鹏.裸燕麦营养与人类健康[J].青海农林科技,1998(1):33-35.
[3] 张丽萍,翟爱华.燕麦的营养功能特性及综合加工利用[J].食品与机械,2004,20(2):55-57.
[4] 冯俊.开发燕麦食品商机无限[J].中国粮食经济,1998(11):47-48.
[5] 魏决,罗雯.燕麦中蛋白质的提取、纯化及氨基酸成分分析[M]成都大学学报:自然科学版,2007(04):283-285.
[6] 马晓凤,刘森.燕麦品质分析及产业化开发途径的思考[J].农业工程学报,2005(2):242-244.
[7] Osborne L B Mendel.Nutritional properties of proteins of maize kernel[J].Journal of Biological Chemistry,1914(18):1-16.
[8] 侯文娟,张美莉,付媛,段艳.酶法水解荞麦球蛋白制备抗氧化活性肽的研究[J].食品科学,2009(23):274-280
[9] Bora P S.Functional properties of native and succinylated lentil(Lensculinaris)globulins [J].Food Chemistry,2002,77:171 -176.
[10] Pearce K N,Kinsella J E.Emulsifying properties of proteins:evaluation of aturbidimetric technique[J].Journal of Agricultural Food Chemistry,1978,26(3):716 -723.
[11] Waniska R D,Kinsella J E.Foaming properties of proteins:evaluation of a column aeration apparatus using albumin[J].Journal of Food Science,1979,44:1 398 -1 403.
[12] 胡新中.燕麦食品加工及功能特性研究进展[J].麦类作物学报,2005,25(5):122 -124.
[13] 王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002:158.
[14] Seena S,Sridhar K R.Physicochemical,functional and cooking properties of canavalia[J].Journal of Food Chemistry,2005,32:406 -412.
[15] 杨海霞,赵丽芹,付媛,侯文娟,张美莉.甜荞主要贮藏蛋白的分离纯化及功能特性研究[J].中国食品学报,2009,9(1):72 -76.
[17] Zhang Mei-li,Gao Ju-lin,Yang Hai-xia.Functional properties of 7s globulin extracted from cowpea vicilins[J].Cereal Chemistry,2009,86(3):261 -266.
[18] John E Kinsella.Functional properties of Soy Proteins[J].JACOS,1979,56:242 -258.

